| 다약제 내성균 치료 항생제 개발을 위한 항균 펩타이드와 펩토이드 | |
|---|---|
| Date 2018-04-16 16:14:43 |
|

교수
광주과학기술원 화학과
jseo@gist.ac.kr
1. 다약제 내성균 (multi-drug resistant bacteria) 문제
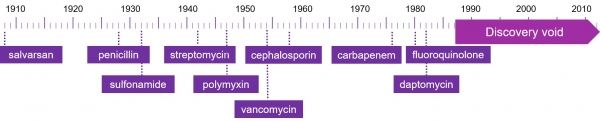
1928년 알렉산더 플레밍(1945년 노벨 생리의학상)이 페니실린을 발견하고, 기적의 항생제로 사용된 이후, 인류의 박테리아 감염으로 인한 사망률이 급격히 감소했다. 이후, sulfa drugs, tetracyclines, quinolones, aminoglycosides, vancomycins, rifamicyns 등 다양한 계열의 항생제들이 개발되어 왔지만, 어느 시점부터 제약회사들은 수익성을 이유로 항생제 신약 개발을 소홀히 해 왔다(그림 1, discovery void).
그림 1. 항생제 신약 discovery timeline
이와 동시에 병원이나 축산농가에서의 항생제 오남용으로 인하여, 박테리아들은 기존 항생제에 대한 내성 메커니즘을 확보하게 되었고, 항생제 내성균은 현재 전 세계적으로 인류의 건강을 위협하는 요인이 되었다. 2016년 World Economic Forum에 기고된 기사에 의하면, 작년 193개 유엔 국가들이 다약제 내성균(multi-drug resistance) 문제를 “one of the major health challenge of our time”으로 선언하였으며, 현재와 같은 상태가 지속된다면, 2050년까지 항생제 내성균으로 인한 사망자 수는 전 세계적으로 1000만 명에 이를 것으로 보고하고 있다. 2014년 현재 암으로 인한 사망자가 8백20만명, 항생제 내성균으로 인한 사망자가 70만명인 것을 감안한다면, 항생제 내성균 치료제의 연구 개발이 매우 시급함을 알 수 있게 된다[1,2].
항생제의 discovery void 동안에 박테리아들은 기존의 항생제에 대해 내성을 갖게 되었다. 특히, ESKAPE 병원균(Enterococcus faecium, Staphylococcus aureaus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa , and Enterobacter species)들, 예를 들면, VRE (Vancomycin-Resistant Enterococci), MRSA (Methicillin-Resistant Staphylococcus aureus), β-lactamase-producing 그램 음성균, carbapenemaseproducing 그램 음성균 등이 전 세계적으로 가장 큰 내성균 문제를 보여주고 있다. 2016년 미국 Center for Disease Control and Prevention (CDC)의 리포트에서, 미국 네바다주 Washoe 카운티의 새로운 항생제 내성균 감염 환자의 사망을 보고했다. 인도 여행 직후 전신성 염증반응 증후군으로 사망한 70대 여성은 현재 존재하는 어떤 항생제로도 치료가 안 되는 내성균 감염이 사망 원인임이 밝혀졌고, 추후 New Delhi metallo-beta-lactamase-producing Klebsiella pneumoniae 균주임이 밝혀졌다[3]. 이러한 “pan-resistant” 항생제 내성균의 출현과 새로이 임상에 도입되는 항생제 수의 급감은 기존의 항생제와 차별화된 새로운 메커니즘의 항생제 개발을 더욱 필요로 하게 한다.
2. 국내외 연구동향 – 펩타이드를 이용한 항생제 내성균 치료제 개발
지구상에 최초의 생명체가 출현한 후 30억년이 지난 현재, 다양한 생물 종들은 자신의 개체를 보호하기 위한 화학무기들을 개발해 왔다. 생명체의 가장 큰 적인 산소와 미생물의 위협에 대응하기 위하여 다양한 항산화제와 항균 물질들을 스스로 합성하여 왔다. 페니실린, 테트라사이클린, 아미노글리코사이드 등은 모두 천연물로서, 그 자체로서 항생제로 사용되거나, 약간의 화학적 변형을 통한 유도체 형태로 항생제로 사용되어 왔다. 자연이 진화를 통하여 최적화시킨 천연의 항생제는 새로운 항생제 신약개발에 커다란 힌트를 제공하여 왔다.
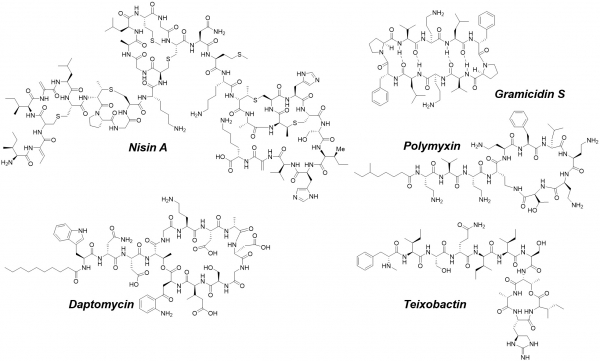
항생제 천연물 중 최근 가장 활발히 연구개발이 되고 있는 분야가 항균 펩타이드(antimicrobial peptide, AMP)이다. 박테리아와 같은 미생물부터 곤충, 양서류, 포유류, 인간 등 고등생물까지 개체를 보호하기 위한 내재 면역계(innate immune system)로서 항균 펩타이드를 발현한다. 항균 효과를 강조할 때 항균 펩타이드(antimicrobial peptide, AMP)로, 면역 조절(immunomodulatory) 효과를 강조할 때 숙주 방어 펩타이드(host-defense peptide, HDP)로 불리며, AMP와 HDP의 경계가 모호하게 혼용되는 경우가 종종 있다. 항균 펩타이드는 1922년 최초로 발견 되었고, 1980년대부터 활발히 연구 되어 왔다. 1928년 발견된 nisin A는 1980년대 미국과 유럽에서 식품 방부제로 허가되어 사용되어 왔고, gramicidin S, polymyxin, daptomycin 등이 현재 임상에서 사용되고 있다(표 1, 그림 2).
그림 2. 고리형 항균 펩타이드(cyclic AMP)의 구조
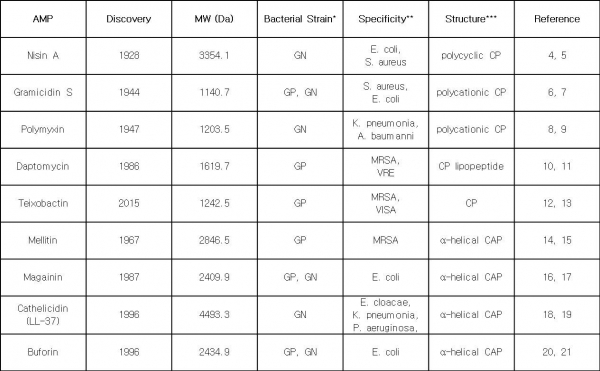
표 1. 항균 펩타이드(Amtimicrobial peptide, AMP)의 예시
*GP: Gram-positive, GN: Gram-negative; **MRSA (Methicillin-resistant Staphylococcus aureus ), VRE (Vancomycin-resistant enterococci ), VISA (Vancomycin-intermediate-susceptible Staphylococcus aureus ), K. pneumonia (Klebsiella pneumonia ), A.baumannii (Acinetobacter baumannii), E coli (Escherichia coli), S. aureus (Staphylococcus aureus), P. aeruginosa (Pseudomonas aeruginosa) ; ***CP: cyclic peptide; CAP: cationic amphipathic peptide
Discovery void 시기와 겹치면서 연구개발이 어느정도 침체된 경향이 있었으나, 최근 항생제 내성균 치료제 개발을 위한 플랫폼으로 다시 활발한 연구가 진행 중이다. 예를 들어, teixobactin은 Gram-positive 내성균에 대한 항생제로 개발 중이고, magainin의 유도체인 pexiganan은 당뇨병성 족부 궤양(diabetic foot ulcer) 치료제로 현재 임상 3상 시험이 진행 중이다.
3. 연구실의 연구 소개 – 양친성 나선구조를 이용한 항균 펩토이드 개발
대표적 생체고분자인 펩타이드와 단백질은 그 구조의 다양성과 촉매, 면역, 에너지 저장과 전환 등의 중요한 기능으로 인해 많은 연구가 되고 있는 핵심적인 유기 고분자 물질이다. 신약개발 분야에서 기존의 저분자 의약품과 더불어 단백질 및 펩타이드 기반 신약이 활발하게 상용화되고 있고, 재료 분야에서도 생체고분자 물질의 특성을 이용하기 위한 생체모방연구가 활발하게 이루어지고 있다. 생체 고분자가 갖고 있는 고유의 물성인 단분산성(monodispersity), 서열특이성(sequence specificity), 다양한 구조로의 접힘(folding), 그리고 단량체 수준에서부터 입력되는 정보가 고분자의 기능으로 발현되는 일련의 조절 가능한(tunable) 프로그래밍 과정은 생체 고분자가 갖고 있는 독특한 장점이다. 이러한 장점에도 불구하고, 체내의 다양한 메커니즘에 의해 빠르게 분해되는 생체 고분자는 안정성 측면에서 커다란 약점을 갖는다. 1990년대 초 미국 샌프란시스코 지역에서의 공동연구(UC Berkeley, UC San Francisco, 및 Chiron (현재 노바티스))에 의해 개발된 펩토이드(peptoid)는 단백질과 펩타이드의 안정성 측면의 약점을 극복하기 위해 신약개발 목적으로 많은 연구가 이루어졌고, 현재는 의약(항암, 항균, 세포침투, 유전자 전달)뿐 아니라 다양한 소재(촉매,센 서, 이산화탄소 포집, 인공광합성)로 응용하기 위한 연구가 활발히 이루어지고 있는 새로운 분자 구조 플랫폼이다. 본 연구실에서는 이러한 펩토이드를 플랫폼으로 사용하여 항균, 세포 소기관 타게팅 등 다양한 의약 및 생리활성물질 개발 연구를 수행하고 있다.
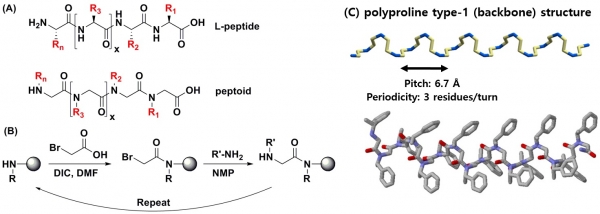
펩토이드는 펩타이드의 구조 이성질체로서 유사한 단량체 서열을 갖고 있지만, 주사슬(backbone)의 탄소가 아닌 질소에 곁가지(side chain)가 붙어있는 oligo-N-subsitituted glycine의 구조를 갖고 있고, 전체 펩토이드 분자의 접힘양상이 펩타이드와 완전히 다른 모습을 보인다(그림 3(A)). 펩토이드에는 카이랄성 탄소가 존재하지 않고, 주사슬의 아마이드 -NH기와 같은 수소결합 주개가 존재하지 않아서 펩타이드와 같은 메커니즘으로 알파-나선 구조를 형성하지 못한다. 그러나 주사슬 바로 옆 자리에 카이랄 메틸기를 갖는 특정 단량체를 사용하면 열역학적으로 가장 안정한 구조로 접힘을 발견하게 되었고, 이 접힘 구조가 펩타이드의 알파-나선 구조와 매우 유사함을 밝혀내게 되었다(그림 3(C)) [22]. 또한 펩타이드와는 달리 탄소가 아닌 질소에 작용기가 연결되어 있어 다양한 작용기를 펩토이드 서열에 포함시킬 수 있다는 장점과 합성이 용이한 고체상 펩토이드 합성 방법(그림 3(B))을 토대로 응용 범위를 확대하고 있다[23]. 이와 같이 펩토이드의 이차구조 형성 및 합성의 용이성을 통해 펩타이드 및 단백질의 기능을 모사할 수 있게 됨과 동시에 생체 내의 펩타이드 분해 효소에 대한 안정성 향상이라는 커다란 장점을 갖게 되었다.
그림 3. (A) 펩타이드와 펩토이드. (B) 펩토이드의 고체상 submonomer 합성법. (C) 펩토이드 나선구조의 특성.
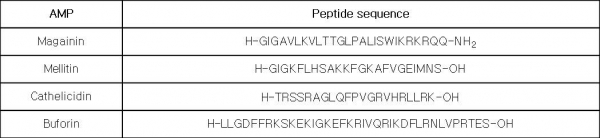
항균 펩타이드는 음전하를 가진 박테리아의 세포막에 작용하여 세포막 용혈 또는 세포막 투과의 메커니즘으로 세포 독성을 갖는다. 박테리아의 세포막에 정전기적 인력을 갖기 위해 항균 펩타이드는 공통적으로 lysine, arginine, histidine과 같은 양전하를 가진 아미노산을 포함하고 있으며, 세포막 인지질의 소수성 부분에 작용하기 위해 소수성 아미노산을 갖고 있다. 이러한 cationic amphipathic 구조가 양친성 항균 펩타이드들이 공통적으로 갖는 구조적 특성이라 할 수 있다(표 2).
표 2. 양친성 항균 펩타이드(Amphipathic amtimicrobial peptide)의 서열
첫 번째로 알려진 항균 펩타이드의 작용 메카니즘은 박테리아의 세포막에 구멍을 내어서 세포를 용혈시켜 죽이는 것으로 마치 계면활성제로 인지질을 녹이는 작용과 비슷하다 (lytic AMP: magainin, mellitin 등). 두 번째로 알려진 메커니즘은 항균 펩타이드의 세포막 투과 후, 박테리아 세포 내에 고농도로 존재하는 음이온을 띈 핵산이나 단백질과 응집(aggregation)을 통하여 세포의 모든 활동을 차단시키는 것이다 (non-lytic AMP: buforin 등). Human cathelicidin (LL-37)과 같이 아직 분명한 한가지 메커니즘이 밝혀지지 않은 non-specific 메커니즘의 항균 펩타이드도 있다. 이러한 메커니즘 모두 박테리아가 세포막의 인지질 조성을 바꾸지 않는 한 항생제에 대한 내성을 발현하기 어렵기 때문에 항균 펩타이드는 새로운 항균 신약 후보 물질로 많은 관심을 받아 왔다. 또한 항균 펩타이드는 다양한 박테리아 종에 대해서 broad-spectrum 항균 효과를 보인다.
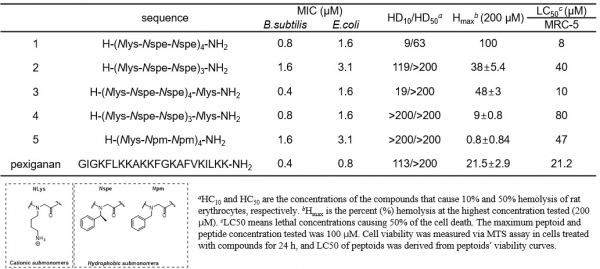
이러한 항균 펩타이드의 가능성에도 불구하고 생체 내 펩타이드 분해 효소에 의한 빠른 가수분해와 독성 문제 때문에, 이 펩타이드의 항생제 신약으로서의 개발에는 어려움이 있어 왔다. 따라서 항균 펩타이드 유사 물질로 항균 펩토이드 개발이 촉진되었다. 그림 4의 펩토이드 1은 cationic amphipathic 구조로 소수성 단량체인 N spe와 양이온 단량체인 N Lys으로 구성되어 있고, 전체적으로 나선 구조를 갖도록 단량체의 서열이 구성되어 있다. 이 펩토이드 1은 낮은 농도에서 (~1.6 μM) 그램 음성균에 대한 항균 효과를 갖고, 앞에 기술한 두 메카니즘 중 두 번째인 세포막 투과 메카니즘을 갖는 것으로 밝혀졌다[24]. 펩토이드 1의 변형인 펩토이드 5는 나선구조를 주는 chiral methyl 그룹을 갖는 N spe대신에 achiral 단량체 N pm을 사용하였고, 전체적으로 항균활성(minimal inhibitory concentration: MIC) 값이 저하되었으나, 적혈구 세포에 대해 낮은 독성이 나타나 선택성이 향상됨이 보고되었다.
본 연구실에서는 항균 펩토이드(antimicrobial peptoid)의 좋은 효능을 유지하면서 박테리아에 대한 선택성을 높이고 독성을 낮추기 위하여 다양한 라이브러리를 합성해 왔다. 그 예시로서 그림 4의 펩토이드 3과 4는 전체적인 양이온 비율을 증가시키면서, 그램 음성균에 대한 항균 활성이 펩토이드 1과 비슷하게 유지 되었고, 적혈구 세포에 대한 hemolytic activity가 크게 감소함을 관찰하였다. 특히 4번 컴파운드의 경우 MRC-5 (human lung fibroblast) 세포에 대한 독성이 매우 낮음(LC50 = ~80 μM)을 보여서 항균 펩토이드의 독성 문제를 크게 향상시켰다[25]. 펩토이드의 나선구조의 미세한 folding-unfolding 조절을 한 신규 항균 펩토이드 라이브러리 합성을 통하여, moderately helical 구조의 펩토이드들이 항균 효능을 유지하면서 독성이 크게 감소하는 것을 발견하였다(unpublished data, 특허 출원2018). 이러한 구조-활성 관계(structure-activity relationship) 연구를 통해서 다음과 같은 중요한 디자인 정보가 제시되었다. 첫째, 펩토이드의 과도한 소수성과 나선 구조는 높은 용혈 현상과 독성을 유발한다. 둘째, 양이온 전하의 수는 +3 보다 높아야 박테리아 세포에 대한 선택성이 높다. 세번째, 독성이 낮은 펩토이드는 보통 풀린 구조를 갖고 있다가, 음전하 세포막과 만나는 순간 나선 구조가 유도된다. 따라서, 나선구조가 강한 펩토이드는 항균 효과도 좋지만, 독성 또한 높은 것이 밝혀졌다. 현재 본 연구실에서는 나선구조의 folding정도와 소수성 및 양이온의 조성을 변화시키고, 새로운 펩토이드 구조의 도입을 통하여 임상에서 사용 가능한 항균 펩토이드 개발을 위한 연구를 수행 중이다.
그림 4. 항균 펩토이드의 항균 활성(MIC) 및 선택성(hemolysis/cytotoxicity) 데이타 예시
4. 전망
항생제 내성균 문제의 경제적 영향에 대한 예측이 보고되었다. 미국의 의료시스템에서만 매년 22-35조원(21-34billion dollars), 그리고 추가적인 병원 입원 일수가 8백만일로 추산되었다. 이미 10년 전에 항생제 내성균으로 인해 국내 총생산(GDP, gross domestic product)이 0.4-1.6% 감소할 것으로 예측되었고, 이는 현재 전 세계적으로 수조원을 훨씬 뛰어넘는 경제적 영향을 갖는다. 이러한 엄청난 파급효과로 인하여, 국내외 연구팀과 제약회사들은 새로운 항생제 연구개발에 다시 박차를 가하고 있다. 항생제 신약개발 연구는 합성 신약 접근법, 미생물을 이용한 항균 펩타이드 대량 생산법 개발, 항균 효과의 메커니즘 및 내성균 연구, 동물 모델 및 임상 연구 등 다양한 분야에서 활발한 교류 및 공동연구가 필요하다. 2014년 국제 보건기구(WHO)에서 발표된 성명이다. “Antibiotic resistance is no longer aprediction for the future; it is happening right now, across the world, and is putting at risk the ability to treat common infections in the community and hospitals. Without urgent, coordinated action, the world is heading towards a post-antibiotic era, in which common infections and minor injuries, which have been treatable for decades, can once again kill .” 현재 항생제 내성균 치료제 개발이 국내외에서 활발하게 진행되고 있고, 새로운 메커니즘의 항생제 개발을 통하여 post-antibiotic era의 도래를 시급히 막는 것이 필요하다.
참고문헌
1. O’Neill, J. et al. (2014). “Tackling drug-resistance infections globally.” Review on Antimicrobial Resistance.
2. World Health Organization. (2014). “Antimicrobial resistance: Global report on surveillance.”
3. Chem. L. (2017). ¡°Notes from the Field: Pan-Resistant New Delhi Metallo-Beta-Lactamase-Producing Klebsiella pneumoniae— Washoe County, Nevada, 2016.” Morbidity and Mortality Weekly Report. 66(1): 33.
4. Zhou, H. et al. (2013). “Mechanisms of nisin resistance in Gram-positive bacteria.” Ann. Microbiol. 64(2): 413-120.
5. Stevens, K. A. et al. (1992). “Effect of Treatment Conditions on Nisin Inactivation of Gram-negative Bacteria.” J. Food Prot. 55(10):763-766.
6. Kondejewski, L. H. et al. (2009). “Gramicidin S is active against both gram-positive and gram-negative bacteria.” Int. J. Pepride Protein Res. 47(6): 460-466.
7. Prenner, E. J. et al. (1999). “The interaction of the antimicrobial peptide gramicidin S with lipid bilayer model and biological membranes.” Biochim. Biophys. Acta. 1462(1-2): 201-221.
8. Velkov, T. et al. (2013). “Surface changes and polymyxin interactions with a resistant strain of Klebsiella pneumonia.” Innate Immun. 0(0): 1-14.
9. Olaitan, A. O. et al. (2014). “Mechanisms of polymyxin resistance: acquired and intrinsic resistance in bacteria.” Front. Microbiol. 5: 1-19.
10. Steenbergen, J. N. et al. (2004). “Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections.” J.Antimicrob. Chemother. 55(3): 283-288.
11. Rybak, M. J. et al. (2000). “In vitro activities of daptomycin, vancomycin, linezolid, and quinupristin-dalfopristin against staphylococci and enterococci, including vancomycin-intermediate and -resistant strains.” Antimicrob. Agents Chemother. 44(4):1062-1066.
12. Ling, L. L. et al. (2015). “A new antibiotic kills pathogens without detectable resistance.” Nature 517(7537): 455–459.
13. Piddock, L. J. V. “Teixobactin, the first of a new class of antibiotics discovered by iChip technology” J. Antimicrob. Chemother. 70(10): 2679–2680.
14. Asthana, N. et al. (2004). “Dissection of antibacterial and toxic activity of melittin.” J. Biol. Chem. 279(53): 55042-55050.
15. Fennell, J. F. et al. (1968). “Antibacterial action of melittin, a polypeptide from bee venom.” Exp. Biol. Med. 127(3): 707-710.
16. Matsuzaki, K. et al. (1997). “Interactions of an antimicrobial peptide, magainin 2, with outer and inner membranes of Gramnegative bacteria.” Biochim. Biophys. Acta. 1327(1): 119-130.
17. Zasloff, M. et al. (1987). “Magainins, a class of antimicrobial peptides from Xenopus skin: Isolation, characterization of two active forms, and partial cDNA sequence of a precursor.” Proc. Natl. Acad. Sci. USA 84(15): 5449-5453.
18. Kos´ciuczuk, E. M. et al. (2012). “Cathelicidins: family of antimicrobial peptides. A review.” Mol. Biol. Rep. 39(12): 10957–10970.
19. Lee, P. H. A. et al. (2005). “Expression of an additional cathelicidin antimicrobial peptide protects against bacterial skin infection.”Proc. Natl. Acad. Sci. USA 102(10): 3750-3755.
20. Park, C. B. et al. (1998). “Mechanism of action of the antimicrobial peptide buforin ii: buforin ii kills microorganisms by penetrating the cell membrane and inhibiting cellular functions.” Biochem. Biophys. Res. Commun. 244(1): 253–257.
21. Cho, J. H. et al. (2009). “Buforins: Histone H2A-derived antimicrobial peptides from toad stomach.” Biochim. Biophys. Acta.1788(8): 1564-1569.
22. Kirshenbaum, K. et al. (1998). “Sequence-specific polypeptoids: A diverse family of heteropolymers with stable secondary structure.” Proc. Natl. Acad. Sci. USA 95(8): 4303-4308.
23. Zuckermann, R. N. et al. (1992). “Efficient method for the preparation of peptoids [oligo(n-substituted glycines)] by submonomer solid-phase synthesis.” J. Am. Chem. Soc. 114(26): 10646-10647.
24. Chongsiriwatana, N. P. et al. (2008). “Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides.”Proc. Natl. Acad. Sci. USA 105(8): 2794-2799.
25. Lee, J. et al. (2018). “Effect of side chain hydrophobicity and cationic charge on antimicrobial activity and cytotoxicity of helical peptoids.” Bioorg. Med. Chem. Lett. 28(2): 170-173.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update