| 효과적인 암 진단 및 치료를 위한 엑소좀 분석 기술 | |
|---|---|
| Date 2018-04-16 16:38:29 |
|

교수
건국대학교 생물공학과
kskonkuk@gmail.com
1. 서론
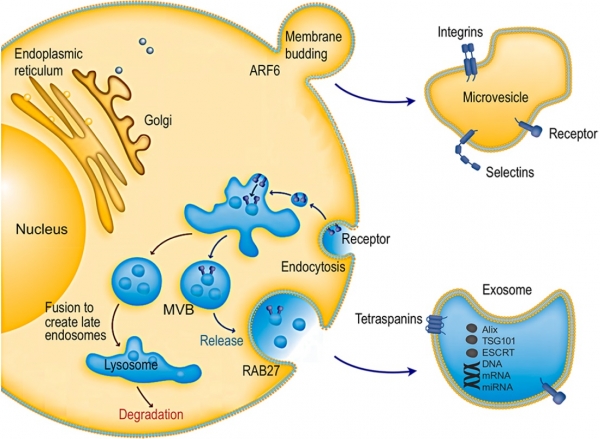
34년째 한국인 사망 원인 1위를 차지하고 있는 암의 경우, 1기에 진단이 내려져 치료를 받은 환자들은 5년 동안 생존할 확률이 거의 100%에 가까운 반면, 4기에 치료를 시작하면 그 확률이 22%로 줄어든다. 이와 같이 암을 초기에 정확하게 진단하는 기술은 생존에 있어서 중요하다. 현재 암 진단을 위한 표준 진단 방법인 조직 생체검사(Tissue biopsy)는 암의 진화에 따라 변화하는 정보를 추적 관찰하기 어렵고, 조직 샘플의 채취를 위해 내시경이나 바늘 등의 도구를 이용해 인체에 침습적이고, 환자는 물론 의사에게도 위험부담이 있다. 또한, 종양의 발생 위치나 크기, 환자 상태에 따라 조직 생검을 시행할 수 없는 경우도 있으며, 하나의 종양에서 발견된 유전 정보는 다양하고, 전이(metastasis)를 통한 2차 종양은 새로운 양상을 나타냄으로써 적절한 치료를 위한 정확한 정보를 제공하기 어렵다는 문제가 있다. 이러한 기존 진단 방법의 문제점을 극복하기 위해 최근 암 진단 시장의 패러다임이 비 침습적인 방법으로 변화하고 있으며, 액체 생체검사(liquid biopsy)는 혈액 등의 체액 검사만으로 암 발생 및 전이 등에 대한 상세한 관찰이 가능하고, 정밀-표적 항암 치료에 사용될 수 있기 때문에 암 진단 및 치료를 위한 차세대 전략으로 떠오르고 있다[1]. 2015년 MIT가 선정한 10대 미래유망기술 중 하나로 선정된 액체 생체검사는, 혈액 내에 존재하는 순환종양세포(circulating tumor cells), 세포유리순환종양 DNA (circulating tumor DNA), 엑소좀(exosome) 등을 이용하여 분석이 진행된다. 특히, 세포에서 분비되어 체액을 떠다니는 작은 소포체(30~200 nm)로 부모세포와 동일한 유전 및 단백질 정보를 지니고 있으며, 인지질 이중층으로 포장되어 있어 구조적으로 안정적이고 혈액 내에 풍부한 양으로 존재하는 엑소좀은 가장 유망한 바이오 마커로 주목을 받고 있다(그림 1)(2, 3).
그림 1. 부모세포에서 생성 및 방출되는 엑소좀의 과정을 나타내는 그림. 본 그림은 참고문헌(2, 3) 에서 발췌하였음.
이번 최신 연구동향에서는 효과적인 암의 진단 및 치료를 위한 최신 엑소좀 분석 기술에 대해서 이야기하고자 한다. 특히, 본 연구자가 박사 후 과정 연구를 수행한 하버드/Massachusetts General Hospital-Center for Systems Biology의 Ralph Weissleder 및 이학호 교수님 연구실에서 개발된 엑소좀 분석 기술 및 임상 적용 연구에 대해 집중적으로 살펴보고자 한다.
2. 본론
2.1 Nanoplasmonic Exosome (nPLEX)
2000년대 초반 엑소좀에 대한 연구가 본격적으로 시작된 이후 관련 연구 문헌은 급속도로 증가하여 2017년에는 1,700편 이상의 관련 연구 논문이 발표되었다[4]. 엑소좀은 한때 필요 없는 세포 쓰레기의 작은 쓰레기통으로 여겨졌지만, 세포들이 이를 이용해서 실제로 소통하고 있음이 밝혀졌다. 또한, 엑소좀은 부모세포와 동일한 유전 및 단백질 정보를 지니고 있으며, 이를 통해 해당 세포의 건강과 근원에 대한 정보를 제공할 수 있다고 알려져 있다.
첫 번째로 설명드릴 Nanoplasmonic Exosome(nPLEX)는 엑소좀에 존재하는 단백질의 분석을 위해 개발된 기술로, 금속 기판과 유전체의 접점 부분에서 발생하는 굴절률의 변화를 측정하는 표면 플라스몬 공명(surface plasmon resonance) 방식에 기반을 두고 있다(그림 2a) [5-7]. 구체적으로, 특정 항체가 표지된 금속 기판에 항원-항체 반응을 통하여 엑소좀이 결합하게 되면, 굴절률의 변화가 발생하게 되고, 이는 광 투과 스펙트럼(optical transmission spectra)의 피크를 장파장 영역으로 이동시킨다(그림 2b). 이러한 피크의 이동은 금속기판에 결합된 물질의 질량과 상관관계를 보이며, 이를 기반으로 엑소좀 단백질의 정량적인 분석이 가능하다. 그림 2c에 보이듯이, 개발된 시스템을 이용하여 3000개의 엑소좀까지 분석해낼 수 있었으며, 이는 기존의 단백질 분석방법인 Western blotting 과 ELISA와 비교하여 102~104 배정도 민감하다.
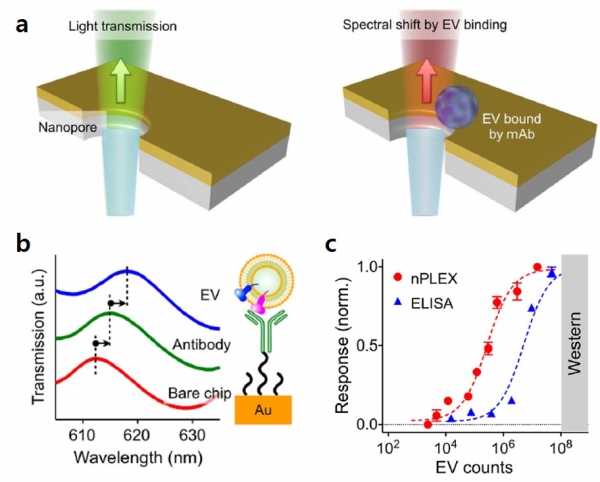
그림 2. 엑소좀 단백질 분석을 위한 nPLEX 시스템. (a, b) 엑소좀 결합에 의한 스펙트럼 변화를 나타내는 모식도. (c) 기존의 단백질 분석 시스템과 nPLEX 시스템의 민감도 비교 결과. 본 그림은 참고문헌(5, 6)에서 발췌하였음.
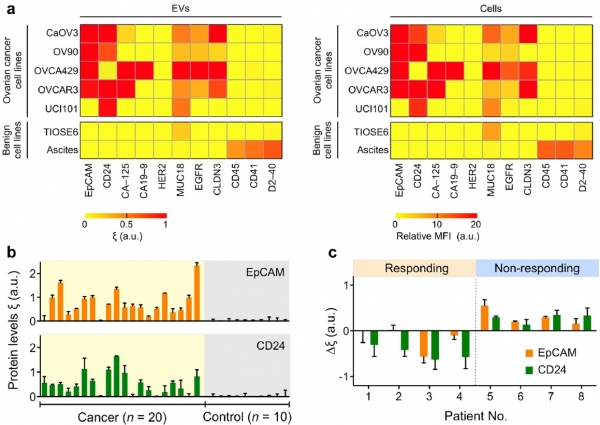
본 기술은 실제 임상 샘플의 분석을 통하여 유효성이 검증되었으며, 첫 번째로, 난소암 진단을 위한 단백질 분석에 적용되었다. 그림 3a에 보이듯이, 난소암(CaOV3, OV90, OVCA429, OVCAR3, UCI101) 및 정상 세포주(TIOSE6, Ascites)에서 유래된 엑소좀의 분석을 통하여 난소암 진단을 위한 EpCAM 및 CD24 단백질 마커를 선정하였다. 선정된 단백질 마커는 실제 임상 샘플(n=30)에서 97%의 정확도로 난소암 환자를 진단해 낼 수 있었다(그림 3b).
그림 3. nPLEX 시스템을 이용한 난소암 검진 결과. (a) 난소암과 정상 세포주에서 유래된 엑소좀의 단백질 마커를 분석한 결과. (b, c) 실제 임상 샘플에서 개발된 시스템 및 단백질 마커의 유효성 검증 결과. 본 그림은 참고문헌(5)에서 발췌하였음.
또한, 항암 치료 과정에 있는 환자의 추적 관리를 통하여, 선정된 단백질 마커가 항암제 효과를 확인하기 위해 사용될 수 있음을 확인하였다. 두 번째로, 본 기술은 췌장암의 진단에 적용되었으며, 난소암의 진단과 유사하게, 췌장암 진단을 위한 복합 단백질 마커(EGFR, EpCAM, MUC1, GPC1, WNT2)를 선정할 수 있었다. 선정된 복합 바이오 마커는 실제 임상샘플(n=43)에서 84%의 정확도로 췌장암 환자를 진단해 낼 수 있었다. 이는 기존 췌장암 진단을 위한 단일 단백질 마커(CA19-9)보다 높은 정확도를 나타냄을 확인할 수 있었다. 본 기술은 현재 Exosome Diagnostics 회사와 함께 상업화단계에 있으며, 2018년 1월 초기 버전의 bench-top 장비가 Shahky 라는 이름으로 출시되었다[8] .
2.2 Immuno-magnetic exosome RNA (iMER)
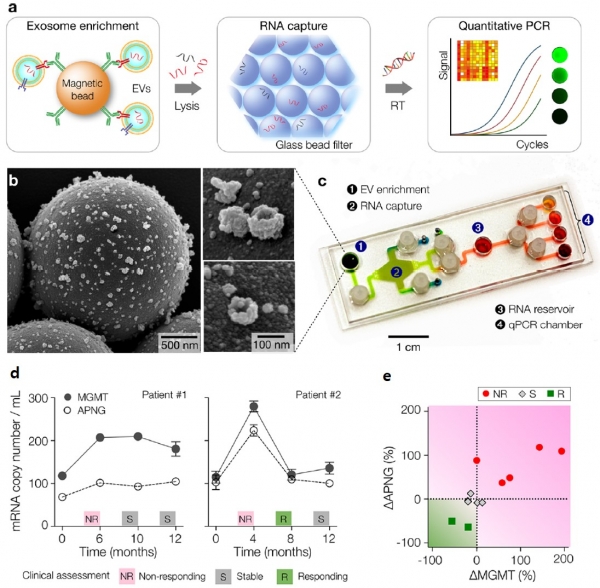
두 번째로 설명드릴 Immuno-magnetic exosome RNA (iMER) 시스템은 엑소좀에 존재하는 RNA를 분석하는 기술로, 미세유체 기술을 이용하여 엑소좀 분리, RNA 추출, RNA 증폭 과정을 하나의 chip 상에서 수행할 수 있다. 그림4에 보이듯이, 항체가 결합된 자성입자를 이용하여 암 특이적인 엑소좀을 분리하고, chip 상에서 엑소좀을 용해시킨 후에, 마지막으로 실시간 중합효소연쇄반응(qPCR)을 진행함으로써 엑소좀에 존재하는 유전정보를 손쉽게 분석할 수 있다(그림 4, a-c). 개발된 시스템은 100 μL 소량의 혈액으로부터 3시간 이내에 엑소좀 RNA 분석 결과를 얻을 수 있는 장점을 가지고 있다. 본 기술은 신경교모세포종(glioblastorma multiform) 진단을 위한 엑소좀 mRNA 분석에 적용되었으며, 구체적으로, 교모세포종 치료를 위한 Temozolomide (TMZ) 항암제의 처리 과정에서 발생하는 환자 반응을 관찰하기 위하여, 두 가지 핵단백질(MGMT: O6-methylguanine DNA methyltransferase 및 APNG: alkylpurine-DNA-N-glycosylase)을 선정하고 실험을 진행하였다. 핵단백질의 경우 핵 내부에 존재하여 엑소좀으로 전달되기 어렵기 때문에, 핵단백질 정보를 담고 있는 mRNA를 이용하여 신경교모세포종 치료 효과를 관찰하였다. 그림 4d, e에 보이듯이, TMZ 항암제를 투여중인 신경교모세포종 환자를 이용하여 엑소좀 mRNA 분석을 진행한 결과, 항암제가 효과적으로 작동하는 경우 MGMT 및 APNG mRNA 수치가 낮아지는 반면, 항암제가 제대로 작동하지 않는 경우 그 수치가 상승하는 것을 확인할 수 있었다.
그림 4. (a) 미세유체 기술을 이용한 엑소좀 RNA 분석 과정을 나타내는 그림. (b) 엑소좀 추출을 위한 자성 입자에 결합된 엑소좀을 나타내는 SEM 사진. (c) 개발된 iMER chip 의 사진. (d, e) 실제 임상 샘플에서 개발된 시스템 및 단백질 마커의 유효성 검증 결과. 본 그림은 참고문헌(9)에서 발췌하였음.
3. 결론
미국의 BBC research에 따르면, 액체 생체검사 시장의 경우, 2015년 기준 세계시장 규모가 16억 달러로 추산되며, 매년 22.3% 성장하여 2020년에 45억 달러에 이를 것으로 전망된다[10]. 이와 같이 막대한 세계 액체 생체검사 시장에서 선도적 위치를 선점하고, 새로운 국가 성장 동력 발굴을 위해 액체 생체검사를 위한 신개념 핵심 원천기술의 개발이 필요한 상황이다. 이번 최신 연구동향에서 소개한 엑소좀은 액체 생체검사의 목적에 부합하는 우수한 장점을 지니고 있으며, 부모 세포와 동일한 유전 및 단백질 정보를 지니고 있기 때문에, 부모 세포의 대리인으로 역할을 하며, 암을 조기에 진단하고 항암 치료 효과를 예측하기 위해 활발히 연구되고 있다. 본 연구자는 엑소좀 바이오 마커의 효과적인 분석 기술 개발을 위한 연구를 수행하고 있으며, 향후 난치성 질환의 조기 진단 및 건강 상태의 주기적 모니터링을 통해 건강한 미래사회를 구축하는 데 기여하고자 한다.
이 글은 2018년도 정부(미래창조과학부)의 재원으로 한국연구재단의 지원을 받아 수행된 생애첫연구사업임 (NRF-2017R1C1B5017724).
참고문헌
1. Ko, J.; Carpenter, E.; Issadore, D. Detection and isolation of circulating exosomes and microvesicles for cancer monitoring and diagnostics using micro-/nano-based devices, Analyst, 2016, 141(2), 450-460.
2. http://docs. abcam.com/pdf/general/secreted_extracellular_vesicles_web.pdf
3. Shao, H.; Im, H.; Castro, C.M.; Breakefield, X., Weissleder, R., Lee, H. New technologies for analysis of extracellular vesicles.Chem. Rev. 2018 (DOI: 10.1021/acs.chemrev.7b00534)
4. PubMed
5. Im, H.; Shao, H.; Park, Y. I.; Peterson, V. M.; Castro, C. M.; Weissleder, R.; Lee, H. Label-free detection and molecular profiling of exosomes with a nano-plasmonic sensor. Nat. Biotechnol. 2014, 32, 490-495.
6. Yang, K.S.; Im, H.; Hong, S.; Pergolini, I.; Del Castillo, A.F.; Wang, R.; Clardy, S.; Huang, C.H.; Pille, C.; Ferrone, S.; Yang, R.;Castro, C.M.; Lee, H.; Del Castillo, C.F.; Weissleder, R. Multiparametric plasma EV profiling facilitates diagnosis of pancreatic malignancy. Sci. Transl. Med. 2017, 9(391), eaal3226.
7. Park, J.; Im, H.; Hong, S.; Castro, C.M.; Weissleder, R.; Lee, H. Analyses of intravesicular exosomal proteins using a nanoplasmonic system, ACS Photonics, 2018, 5 (2), 487–494.
8. http://www.exosomedx.com/news-events/press-releases/exosome-diagnostics-places-early-access-shahkytm-exosomalprotein-detection
9. Shao, H.; Chung, J.; Lee, K.; Balaj, L.; Min, C.; Carter, B. S.; Hochberg, F. H.; Breakefield, X. O.; Lee, H.; Weissleder, R. Chipbased analysis of exosomal mRNA mdiating dug resistance in glioblastoma. Nat. Commun. 2015, 6, 6999.
10. http://blog.bccresearch.com/liquid-biopsy-market-gets-off-to-big-start-in-2016
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update