| 구조변환 압타머: FET 기반 바이오센서의 한계 극복 | |
|---|---|
| Date 2019-04-09 12:06:28 |
|

교수 통합과정
포항공과대학교(POSTECH) 신소재공학과
seungsoo@postech.act.kr minjong@postech.ac.kr
1. FET 기반 바이오센서 연구 동향
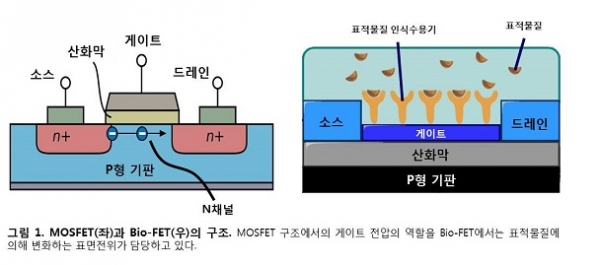
전계효과 트랜지스터(Field Effect Transistor, FET) 기반의 바이오센서(Bio-FET)는 표적물질의 결합에 의해 유도되는 표면전위 변화로 작동되는 트랜지스터이다. Bio-FET은 크게 표적물질 인식수용기 부분과 FET 부분으로 구성된다. 표적물질에 특이적 결합이 가능한 표적물질 인식수용기는 이러한 Bio-FET의 필수적 요소이고, 이를 위해 항체와 압타머와 같은 표적인식물질이 주로 사용된다. 표적인식물질 기반의 Bio-FET을 이용하면 표적물질 인식수용기와 표적물질의 결합을 전기적인 신호로 변환하여 실시간, 정량적 표적물질 검출이 가능하게 된다[1, 2].
일반적인 반도체 센서는 MOSFET(Metal-Oxide-Semiconductor FET, 그림 1A) 구조를 이루고 있다. 이러한 구조 하의 게이트(gate)에 양 전압, 그리고 소스(source)에는 음 전압이 걸리게 되면, 산화막 아래에 있는 반도체 영역의 표면전자 축적으로 인하여 “N채널”이 형성된다. 그러나 게이트와 소스 사이에 음의 전압이 걸리거나 전압이 사라질 경우 기존의 N채널은 사라지게 된다. 이렇게 선택적 형성되는 N채널을 통해 소스와 드레인(drain) 사이에 선택적으로 전류가 흐르기 때문에, 게이트 전압의 조절은 전류의 흐름과 직접적으로 연결된다. 이와 비슷한 원리로, Bio-FET에서는 전하를 띤 표적물질이 표적물질 인식수용기에 결합할 때, 게이트의 표면전위 변화가 유도될 수 있다. 이러한 전위 변화는 N채널을 열거나 닫는 기존의 MOSFET에서의 게이트 전압 조절과 동일한 역할을 수행하고, 이로 인해 소스에서 드레인으로 흐르는 전류의 양에 변화가 일어날 수 있다[3]. FET 시스템은 이러한 전류 변화와 더불어 근본적 구조에 의한 신호 증폭 능력을 갖추고 있기 때문에 적은 양의 표적물질 검출이라는 바이오센서의 궁극적 목표에 매우 적합한 장점들을 갖고 있다 하겠다.
하지만 지금까지 개발되어 온 Bio-FET은 두 가지 근본적 한계를 갖는다. 첫 번째는 물리적 Debye 길이의 적용 한계, 그리고 두 번째는 표적물질 전하 제한성의 한계이다.

첫 번째 한계는 Bio-FET의 작동 환경과 밀접한 관련을 갖는다. Bio-FET은 전기적인 변화에 기반하여 표적물질 검출을 수행한다. 만약 이온 농도가 높은 용액 속에서 Bio-FET을 작동시키고자 한다면, 용액 속의 이온이 전기적인 신호를 상쇄(neutralization)시켜 FET의 전기적 변화를 측정하는 것이 불가능해질 수 있다. 이러한 현상을 일반적으로 전기적인 신호가 차폐되었다고 표현한다. 바이오센서를 사용해야 할 생리적인 상황은 항상 높은 이온 농도를 갖고 있기 때문에, 앞서 언급한 차폐 현상은 Bio-FET이 실질적으로 구동되는 데 있어 큰 한계로 작용한다. 이러한 차폐의 정도를 표현하는 개념이 존재하고, 이를 Debye 길이라고 나타낸다. Debye 길이는 전하를 띠고 있는 입자의 영향이 미치는 거리를 나타낸다[4]. 생리학적 액체(physiological fluid) 내에서 이 길이는 1 nm 이하가 되기 때문에 현실적으로 바이오센서가 정상 작동하는 데에는 큰 무리가 있다(표 1). 그 이유는 전하를 띤 표적물질이 표적물질 인식수용기에 결합하더라도 결합된 표적물질과 게이트 표면과의 거리를 항상 1 nm 이하로 유지시키는 것이 매우 어렵기 때문이다.
표 1. 이온 농도에 따른 Debye 길이 변화. Debye 길이, 즉 전하를 띤 표적물질이 검출될 수 있는 범위는 생리학적 액체인 PBS(Phosphate Buffered Saline)나 aCSF(artificial CerebroSpinal Fluid)의 농도에 반비례하여 감소하게 된다[4].
완충 용액 이온 농도(mM) | Debye 길이(nm) | |
0.01×PBS | 1.627 | 7.53 |
0.1×PBS | 16.27 | 2.38 |
1.0×PBS | 162.7 | 0.75 |
1.0×aCSF | 159.5 | 0.74 |
두 번째 한계는 FET 기반 바이오센서는 전하를 가지고 있는 물질만 인식이 가능하다는 점이다. 따라서 표적물질 인식수용기가 전하가 없는 표적물질을 인식하고자 할 때, FET의 전기적인 신호 변화를 유도하는 것은 근본적으로 불가능하다.
결과적으로 기존의 Bio-FET은 1) 표적물질이 반드시 전하를 띠어야 하고, 2) 매우 낮은 이온 농도에 의해 게이트 표면과 표적물질 사이의 거리가 Debye 길이 이내에 위치해야 하는 상당히 제한적 상황에서만 작동할 수 있다. 따라서 이러한 실용적 한계들을 해결하기 위해서는 기존의 Bio-FET의 구동 메커니즘에 의존하지 않는 새로운 기술의 등장이 요구될 수 밖에 없다.
2. 구조변환 압타머를 이용한 새로운 FET 바이오센서 개발
최근에 구조변환 압타머를 이용하여 위에서 언급한 Bio-FET의 두 가지 한계를 극복한 흥미로운 연구가 발표된 바있다. 구조변환 압타머는 표적물질과 단순 결합하는 핵산 기반의 일반적 압타머와는 달리, 표적물질과의 결합에 의해 유도되는 기계적 3차원 구조의 변환을 동반하는 새로운 개념의 표적인식물질이다. 이제까지의 Bio-FET 연구들은 표적물질과 표적물질 인식수용기의 결합 자체에 기반하여 표적물질을 검출해 내는 것에 집중하였지만[1], Nakatsuka와 동료들의 새로운 연구는 표적물질에 의해 유도되는 압타머의 구조변환을 통해 표적물질을 검출해 내는 독창적 메커니즘의 FET 기반 바이오센서(이하 압타머-FET)를 제시하였다[5].
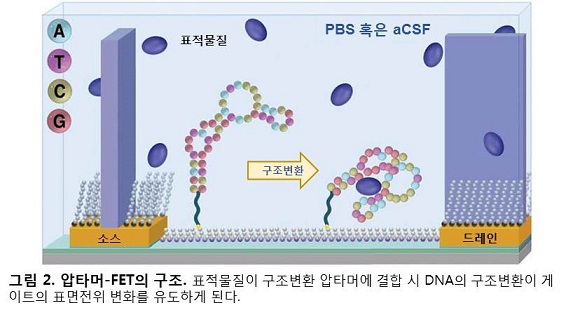
Nakatsuka와 동료연구자들은 DNA 가닥의 3차원 구조가 변하면 전하의 분포가 바뀔 것으로 예상하였다. 기존의 Bio-FET에서는 전하를 띤 표적물질이 표적물질 인식수용기에 부착되면 게이트의 표면전위에 변화가 유도되었음에 반해, 이번 연구의 압타머-FET은 음전하를 띠고 있는 DNA 자체의 구조변환을 통해 게이트의 표면전위에 변화를 이끌어내고자 하였다(그림 2, 3).
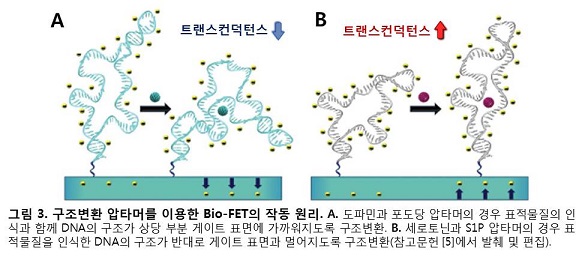
압타머-FET의 제작을 위해 도파민(dopamine), 세로토닌(serotonin), 포도당 그리고 S1P(sphingosine-1-phosphate) 총 4가지 물질에 선택적으로 반응하는 구조변환 압타머들이 사용되었다. 각각의 표적물질들에 대한 압타머들의 K_d(결합 친화성) 값을 측정한 결과, 150 nM(도파민), 30 nM(세로토닌), 10mM(포도당), 180 nM(S1P)의 결합 친화성이 확인되었다. 이러한 특성을 갖는 구조변환 압타머들을 표적물질 인식수용기로 이용하여 기존의 Bio-FET과 동일한 구조에 기반하여 압타머-FET이 제작되었다(그림 2).
압타머-FET에 인식수용기로 사용된 네 가지 압타머들은 모두 구조변환 압타머들 이지만, 도파민과 포도당 압타머는 세로토닌, S1P 압타머와 다른 구동 경향을 보이고 있음이 확인되었다. 도파민과 포도당 압타머의 경우는 표적물질과 결합하였을 때, 음전하를 띤 DNA 골격이 상당 부분 게이트 표면의 N채널에 가까워지도록 구조변환한다. 그 결과 N채널의 전자들이 전기적 척력으로 밀려나면서 트랜스컨덕턴스(transconductance)가 감소하게 된다(그림 3A). 이와는 반대로, 세로토닌과 S1P 압타머의 경우는 음전하를 띤 DNA 골격이 상당 부분 N 채널과 멀어지면서 트랜스컨덕턴스가 증가하게 된다(그림 3B).
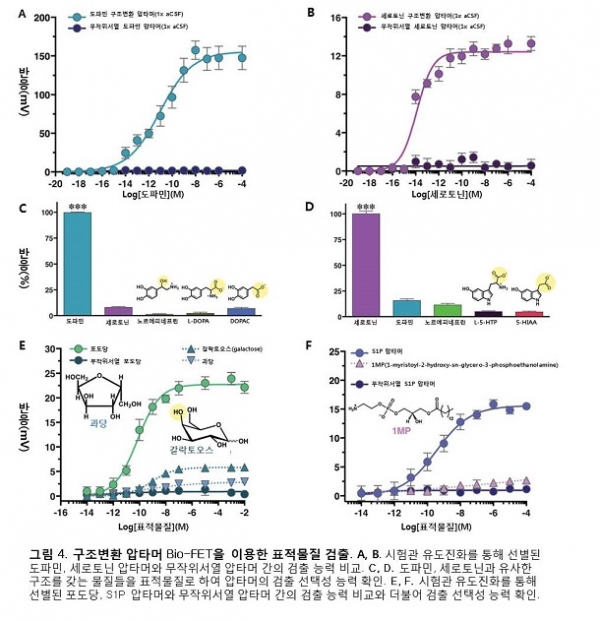
압타머-FET은 DNA 자체의 전하를 이용하였기 때문에 전하가 없는 물질도 표적물질로 채택될 수 있다는 매우 큰 장점이 있다. 또한 표적물질 인식수용기로 쓰이는 DNA는 표면에 직접적인 접촉을 하고 있고, 음전하가 DNA 전체에 걸쳐 분포되어 있기 때문에 Debye 길이의 영향도 거의 받지 않는다. 이를 확인하고자 각각의 표적물질들의 농도를 다르게 하여 실제 압타머-FET의 표적물질 검출 능력을 실험해본 결과, 네 가지 경우 모두 생리적인 이온 농도를 갖는 1xPBS나 aCSF(artificial cerebrospinal fluid)에서도 높은 민감성(적은 양의 표적물질까지 검출해 낼 수 있는 능력, sensitivity)과 선택성(표적물질만 선택적으로 검출할 수 있는 능력, selectivity)을 갖고 있음이 증명되었다(그림 4).
구조변환 압타머가 아닌 무작위 DNA 서열에서도 비슷한 결과가 나올 수 있는 가능성을 배제하기 위하여 뉴클레오타이드(nucleotide)의 비율은 동일하지만 서열은 다른 무작위서열 압타머(scrambled aptamer)를 대조군으로 한 실험이 추가적으로 진행되었고, 구조변환 압타머와는 다르게 표적물질에 대한 특별한 검출 반응을 나타내지 않음이 확인되었다(그림 4A,B, E, F). 이와 더불어, 비슷한 분자구조를 갖는 표적물질에 대한 검출 여부도 실험을 통해 확인되었으며, 놀랍게도 원하는 표적물질 이외에는 별다른 신호가 검출되지 않는 높은 선택성(selectivity)의 능력을 갖고 있음이 증명되었다(그림 4C-F). 특히 기존의 도파민 검출센서들은 도파민 뿐만아니라 노르에피네프린(norepinephrine)에도 신호 검출이 이루어지는 낮은 선택성을 갖고 있는 한계를 드러내어 왔지만[2, 6], 이번 연구에서 개발된 압타머-FET은 노르에피네프린, 세로토닌, 티라민(tyramine) 등의 다른 유사물질들 모두에 반응하지 않는 바이오센서로서 독보적인 능력을 보유하고 있음이 확인된다(그림 4C).
3. 시험관 유도진화를 이용한 FET 기반 바이오센서용 구조변환 압타머 개발
압타머-FET의 핵심 기술은 표적물질과의 결합에 의해 유도되는 구조의 변환을 동반하는 구조변환 압타머이다. 구조변환 압타머는 기존의 압타머와 마찬가지로 시험관 유도진화 기술(SELEX, Systematic Evolution of Ligands by EXponential enrichment)을 통해 선별된다. 본 연구진은 매우 다양한 표적물질들에 대한 여러 유형의 구조변환 압타머들을 시험관 유도진화의 과정을 통해 새롭게 개발하고 이를 다양한 용도로 응용할 수 있는 방안 모색 연구들을 성공적으로 진행해 온 바 있다[7-10].
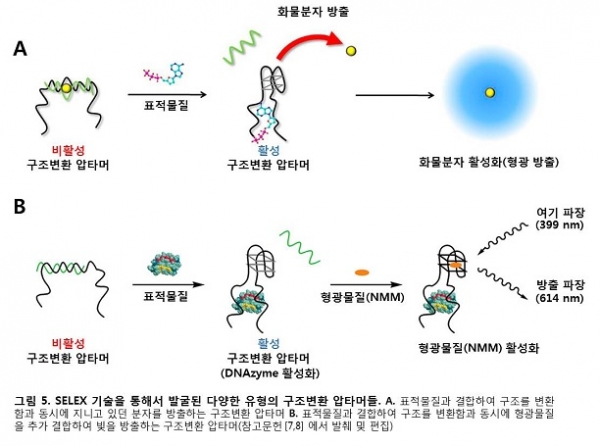
시험관 유도진화는 보통 1013~16개에 달하는 무작위 핵산 배열 속에서 원하는 기능의 배열을 찾아내는 기술이기에, 복잡한 계산이나 분자구조 설계의 필요 없이 원하는 구조변환 압타머를 손쉽게 찾아낼 수 있다. 본 연구진은 압타머의 구조변환 기능에 그치지 않고, 독자적인 시험관 유도진화 방법들에 기반하여 3차원 구조가 변환함과 동시에 추가로 특정기능을 수행할 수 있는 다목적 구조변환 압타머들을 성공적으로 선별해 내었다. 그 예의 첫 번째로 구조변환 압타머가 표적물질에 의해 기계적 구조가 변환할 때, 기존의 압타머에 물리적 결합되어 있던 화물 분자(cargo molecule)가 방출되는 추가적 기능을 수행할 수 있음을 선보였다(그림 5A)[7]. 두 번째의 예로서 구조변환 압타머가 표적물질에 의해 구조가 변환될 수 있을 뿐만 아니라, 그로 인한 DNAzyme의 활성화를 통해 형광물질(N-methylmesoporphyrin IX, NMM)의 추가적 결합에 기반한 형광신호의 증폭기능을 수행할 수 있음이 확인되었다. 이러한 기능을 통해 표적물질에 의한 구조변환이 실시간, 정량적으로 검출될 수 있음이 증명되었다(그림 5B)[8].
본 글에서 언급된 압타머-FET과 Bio-FET을 포함한 모든 표적물질 검출센서의 민감성과 선택성이란 센서의 필수적 특성들은 결국 표적물질 인식수용기의 결합친화도와 결합선택성에 의해서 근본적으로 결정된다. 따라서 표적물질 검출센서의 민감성, 선택성을 높이고자 하는 궁극적 목표를 위해 현재 많은 연구진들이 표적물질 인식수용기의 결합친화도와 결합선택성을 높이는 연구들을 널리 진행하고 있다[11-13]. 본 연구진 또한 기존의 시험관 유도진화 기술의 효율성, 그리고 표적물질 인식수용기인 압타머의 선택성을 획기적으로 늘릴 수 있는 혁신적 연구들을 진행한 바 있고[14, 15], 현재 기존에 없던 새로운 메커니즘에 기반한 표적물질 인식수용기를 구현하기 위한 새로운 유형의 시험관 유도진화 기술을 연구 및 개발 중에 있다.
4. 전망
시험관 유도진화 기술로 선별해 낸 구조변환 압타머에 기반한 압타머-FET은 기존의 Bio-FET이 가지고 있던 한계들을 멋지게 극복해 낼 수 있음을 증명하였다. 이러한 새로운 기술의 등장으로 인해 생리적 환경이란 독특한 상황에서도 표적물질의 실시간 검출이 가능함이 확인되었고, 압타머-FET의 기능은 생물학, 의약, 헬스케어 등 다양한 분야에서 적극 응용될 수 있을 것이라 여겨진다.
기술적인 발전 뿐만 아니라 압타머-FET은 시험관 유도진화 기술이 공학적 측면에서 적극 활용될 수 있음을 입증하였다는 데 또 하나의 의미를 갖는다. 창의적인 시험관 유도진화의 설계 및 개발을 통해, 구조변환 이외에도 다양한 흥미로운 기능들을 갖는 압타머 혹은 DNAzyme이 선별될 수 있음이 본 연구진에 의해 증명된 바 있다[7-10,41,15]. 이러한 다목적 구조변환 압타머들의 개발과 응용을 통해, 표적물질 검출 이외의 더욱더 다양한 분야들로 시험관 유도진화기술이 활용될 수 있을 것으로 기대된다.
현재 각 분야의 공학기술들은 그 한계에 가까워지고 있다. 1965년에 창안된 “반도체 집적회로의 성능이 24개월마다 2배로 증가한다”는 무어의 법칙도 물리적, 경제적 이유로 2016년 공식적인 종말을 맞이하였다. 생물학, 화학 분야에서 연구되어 왔던 압타머, 항체와 같은 표적물질 인식수용기, 그리고 반도체공학, 전기공학 분야에서 연구되어 왔던 FET은 서로 독립적인 영역 속에서 연구들이 이루어짐에 따라 각각의 한계점을 드러내어 오고 있었다. 그러나 압타머-FET의 새로운 등장은 Bio-FET의 개발을 향해 독립적으로만 이루어지던 두 연구분야의 ‘융합’의 결과물임이 분명하고, 이를 통해 기존의 한계를 뛰어넘었을 뿐만 아니라 완전히 새로운 메커니즘에 기반한 혁신적 기술을 완성하였다.
해결할 수 없는 것처럼 보이던 난제들도 무관하다고 생각한 분야의 지식을 통해 쉽게 해결될 수도 있다. 때때로 기술적 큰 진일보는 전혀 다른 분야로부터 비롯되기도 한다. 본 연구자는 이러한 학제간의 융합이 향후 창의적인 과학, 공학 연구가 나아가야 할 방향이라 굳게 믿고 있고, 압타머-FET은 바로 그 융합을 이룬 훌륭한 모델임이 분명하다.
참고문헌
1. Y. Cui, et al., “Nanowire nanosensors for highly sensitive and selective detection of biological and chemical species”, Science 293, 1289–1292 (2001)
2. J. Kim et al., “Fabrication of High-Performance Ultrathin In2O3 Film Field-Effect Transistors and Biosensors Using Chemical Lift-Off Lithography”, ACS Nano 9, 4572-4582 (2015)
3. F. Maddalena, et al., “Organic field-effect transistor-based biosensors functionalized with protein receptors”, J. Appl. Phys. 108, 124501 (2010)
4. A. Vacic, et al., “Determination of Molecular Configuration by Debye Length Modulation”, J. Am. Chem. Soc. 133, 13886-13889 (2011)
5. N. Nakatsuka et al., “Aptamer–field-effect transistors overcome Debye length limitations for small-molecule sensing”, Science 362, 319-324 (2018)
6. R. Walsh, et al., “Retention of function in the DNA homolog of the RNA dopamine aptamer”, Biochem. Biophys. Res. Commun. 388, 732–735 (2009).
7. S. S. Oh, et al., “In vitro selection of shape-changing DNA Nanostructures capable of binding-induced cargo release”, ACS Nano 7 (11), 9675-9683 (2013)
8. S. S. Oh, et al., “In vitro selection of structure-switching, self-reporting aptamers”, Pro. Natl. Acad. Sci. USA 107, 14053-14058 (2010)
9. F. Fong, et al., “In vitro selection of pH-activated DNA nanostructures”, Angew. Chem. Int. Edit. 128, 15484 (2016)
10. H. Qu, et al., “A rapid, label-free strategy to isolate high-quality aptamers for metal ions”, ACS Nano, 10, 7558 (2016)
11. M. Kimoto, et al., “Generation of high-affinity DNA aptamers using an expanded genetic alphabet”, Nat. Biotechnol. 31, 453-457 (2013)
12. K. M. Ahmad, et al., “Selection is more intelligent than design: improving the affinity of a bivalent ligand through directed evolution”, Nucleic Acids Res. 40, 11777-11783 (2012)
13. H. Hasegawa, et al., “Improvement of aptamer affinity by dimerization”, Sensors 8, 1090-1098 (2008)
14. S. S. Oh, et al., “Improving aptamer selection efficiency through volume dilution, magnetic concentration, and continuous washing in microfluidic channels”, Anal. Chem. 83, 6883-6889 (2011)
15. S. S. Oh, et al., “Rapid generation of highly specific aptamers via micromagnetic selection”, Anal. Chem. 83, 1866 (2011)
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update