| 바이오의약품 제형기술개발 | |
|---|---|
| Date 2019-10-04 23:09:40 |
|

부장
오송첨단의료산업진흥재단 신약개발지원센터 신약개발프로세스지원부
wonchan@kbiohealth.kr
1. 서론
세계적으로 고령화, 난치성 질환 및 의료비 증가로 인해 제약산업에 대한 관심이 높아지고 규모 또한 확대되고 있는 추세이다. 이 중 난치성·퇴행성 질환의 치료에 우수한 바이오의약품은 혁신적인 성장견인 산업으로 성장할 것으로 기대되고 있다. 화학합성의약품과 바이오의약품으로 양분되는 의약품산업에서 생물체 유래 물질을 기반으로 하는 바이오의약품은 화학합성의약품에 비해 부작용이 적고 독성이 낮아 난치성, 만성질환 치료제로 큰 장점이 있다. 이에 따라 바이오의약품에 대한 관심이 증폭되고 수요 또한 증가하며 전체 의약품 시장에서 차지하는 비중이 점차 커지고 있다[1]. 바이오의약품은 화학합성의약품과는 달리 분자량이 크고 구조도 복잡하기 때문에 복잡한 생물공정을 거쳐 생산된다. 제형(formulation)의 경우에도 경구 복용, 즉 약을 먹게 되면 위에서 분해가 되기 때문에 주사제 형태로 제품화되며, 주사제는 다시 용액에 희석하여 주사하는 주사제와 미리 주사기에 주입된 상태로 판매되는 프리필드(prefilled) 주사제 등 다양한 형태로 구분된다. 바이오의약품은 제품개발에 있어서 제형의 개발도 매우 큰 비중을 차지하기 때문에 물질뿐만 아니라 공정 및 제형에 대한 기술과 특허도 중요하다. 화학합성의약품과는 매우 다른 바이오의약품 특성 상 제품개발에 있어 약효를 극대화하고 부작용을 최소화할 수 있는 다양한 신제형기술 확보가 바이오의약품 시장에서 경쟁력 강화의 기반이 될 것으로 본다.
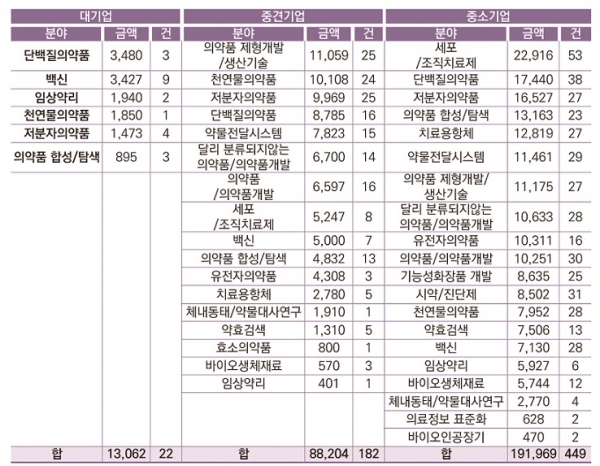
한국제약바이오협회에 따르면 2015년부터 2017년까지 3년간 신약개발분야 국가 R&D 투자 현황의 의약품/의약품 개발 분야에서 기초연구와 응용연구가 각각 24.7%, 18.8%의 비중을 차지하고, 실질적인 제품, 기술개발부분인 개발연구는 49.1%로 나타났다[2]. 기업들의 개발연구 지원부분에서는 대기업은 단백질의약품, 백신, 임상약리 부분을, 중견기업은 의약품 제형개발/생산기술, 천연물의약품, 저분자의약품부분을, 중소기업은 세포/조직치료제, 단백질의약품, 저분자 의약품 순으로 많은 비중을 차지하는 것으로 조사되었다(표 1). 이는 국내에서도 의약품 제형개발 연구에 대한 많은 필요성이 대두되고 활성화되어 있음을 보여준다. 본 기고에서는 오송첨단의료산업진흥재단 신약개발지원센터(이하 ‘신약개발지원센터’)의 바이오의약품 제형 기술에 대해 소개하고자 한다.
표 1. 기업분류별 의약품/의약품개발분야 정부 투자 현황 (2015년~2017년 합) (단위: 백만, %)
2. 본론
제형은 주성분과 부형제 등을 조합하여 최종적인 의약품으로 제조하는 과정을 의미하며, 약물의 용도에 맞게 정제, 캡슐, 주사 등의 형태로 투여하는 것을 뜻하기도 한다. 제형의 주요 목적은 의약품으로써 안정성을 유지해 주는 것으로, 의약품의 생산과정에서부터 최종 인체 내에서 약효로 작용할 때까지의 약물의 원래 구조와 역가를 유지해야 한다. 의약품 안정성의 정의는 연구결과가 허용하는 한도 내에서의 의약품의 약효(Efficacy)와 안전성(Safety)을 유지하는 것이다[3].
신약개발지원센터는 바이오신약의 stress 조건, stability indication assay를 통해 바이오의약품의 불안정화의 주요 인자를 발굴하여 바이오신약을 안정화 시킬 수 있는 선도제형(Preformulation) 연구개발 지원과, DOE(Design of Experiment)를 통한 동결건조 사이클 최적화를 통해 동결건조 제형개발을 지원하고 있다.
2.1. 바이오의약품의 선도제형 개발
신약개발과정에서 후보 약물물질들의 물리화학적 성질을 분석하고 생산공정 및 보관 중 노출되는 stress 요인에 대하여 발생되는 변성들에 대해 분석하고 평가하여 제형 개발에 필요한 주요 정보를 확인한다(표 2). 안정성 분석 및 평가항목은 freeze-thaw test, agitation test, protease activity test, photosensitivity test와 forced oxidation test 등 여러 가혹조건 시험을 통해 개발약물의 변화에 대한 개발자료 확보와 pH, ionic strength, surfactant와 같은 주요인자를 도출한다(그림 1).가속안정성 시험은 pH, buffer, 그리고 삼투조절제(tonicity modifier)가 원료의약품(drug substance)에 미치는 연관성을 찾기 위해 보통 10 종류 이상의 제형 후보를 시험한다. pH4.0~pH8.0 범위의 buffer 조건 하에서 주사제에 적합한 isotonic 농도의 ionic/non-ionic tonicity modifier별, 그리고 agitation test를 통해 결정된 surfactant를 포함하여 제형후보 매트릭스를 구성한다.
표 2. Stress conditions for preliminary study
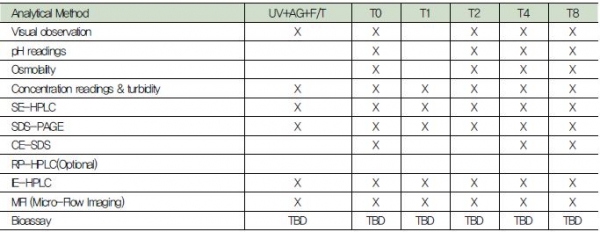
가속안정성 시험의 제형은 냉동(-70℃ 혹은 –20℃), 냉장(4℃), 가속(25℃), 그리고 가혹(37℃ 혹은 40℃) 온도 조건에서 보관하고 보관온도와 시간에 따른 안정성 지표가 되는 다양한 분석을 수행하여 최대 안정성을 유지하는 제형 조건을 탐색한다. 분석방법의 예시로는 육안관찰, 흡광계수를 이용한 농도측정 등이 있다(표.3). MFI(Micro-Flow Imaging) 장비를 이용한 sub-visible particle 입자 분석을 통해 바이오의약품의 면역원성 위험성을 야기할 수 있는 응집체 및 불순물을 최소화하는 제형 조건을 탐색한다(그림 2).
표 3. 분석법 예시
2.2. 바이오의약품의 동결건조제형(Lyophilization formulation) 개발
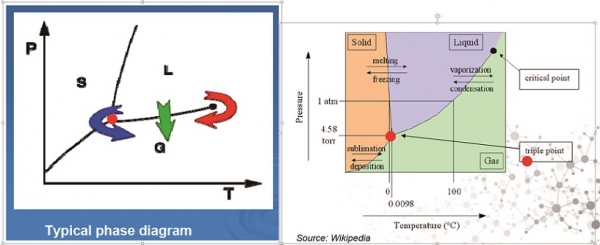
동결건조제형은 원료의약품을 냉동시킨 상태에서 진공을 가하여 얼음을 승화시켜 건조하는 공정(freeze-drying)을 통해 액체 상태로 건조할 경우 발생할 수 있는 단백질의약품의 변성 또는 분해를 최소화 시킬 수 있다[3,4,5,6]. 건조공정을 통해 수분을 95~99%까지 제거함으로써 변성에 약한 단백질들을 오랫동안 보존할 수 있는 방법으로 사용되고 있다. 동결건조란 물질을 동결시키고 주변의 압력을 낮춤으로써 얼음을 직접 증기로 만드는 승화(sublimation)에 의해 얻어지며, 여기서 주변압을 낮춘다는 의미는 물의 3중점(triple point) 이하로 압력을 낮춘다는 것을 의미한다(그림 3). 얼음형태인 물은 낮은 압력에서 열에너지를 받으면 액체로 변하는 것이 아니라 water vapor로 직접 승화하며, 승화된 얼음 결정체들은 공간을 남기기 때문에, 건조 후 물질들은 많은 틈을 포함하고 있어 수분 흡수가 용이해 재수화시 빠르게 녹을 수 있다.
그림 3. 동결건조
그러나 많은 단백질들은 건조과정에서 변성되어 재수화 후 용액상태로 만들었을 때 역가를 환원할 수 없기 때문에 동결건조제형 개발 시 고려해야 할 주요 요소들이 있다. 동결에 의한 단백질의 구조는 특히 buffer에 이용되는 용질의 농도가 올라가게 되고 일부 침전현상이 있거나 결정화 현상에 따라 pH의 변화에 의해 변성될 수 있으며, 단백질이 동결 시 얼음 결정 표면에 흡착하여 변성이 되는 것을 방지해 주어야 한다. 이러한 단백질의 변성을 방지하기 위해 동결건조 과정에서 계면활성제, 비환원 당류나 아미노산을 첨가하여 동결건조제형을 설계한다.
동결건조에서 고려되어야 하는 또 하나의 요소는, 동결시료의 냉동특성을 유지하는 온도와 vapor pressure 온도 간의 균형을 유지하는 것으로써 시료분말이 가지는 Glass transition temperature(Tg)를 확인하는 것이다. Tg 온도 이하에서는 비결정 물질의 강도가 유리처럼 강해져 단백질의 구조 변화는 물론 기타 반응 물질의 유동성까지 급격히 감소하여 단백질의 안정성이 증가하게 된다[3,6].
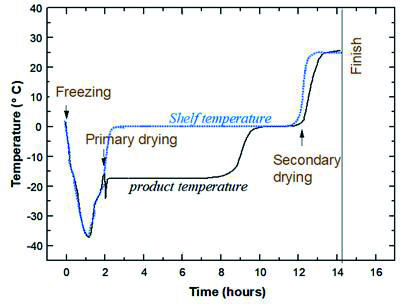
그림 4. 동결건조단계(Lyophilization cycle) 예시
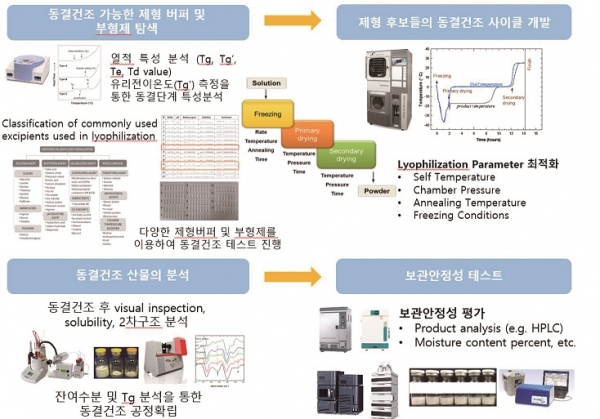
동결건조의 단계는 냉동(freezing), 1차 건조(primary drying), 2차 건조(secondary drying)로 나눌 수 있다(그림 4). 냉동 후 1차 건조는 승화를 통해 얼음을 제거하며, 1차 건조가 끝난 후 잔류 수분을 제거하기 위해 온도를 상승시켜 건조산물과 결합된 수분을 제거하는 2차 건조를 수행한다. 동결건조 사이클에서 주요 파라미터 (parameter)인 온도(Shelf temperature, product temperature)와 시간, 압력(Chamber pressure)에 관한 값들과 cake의 collapse 유무 및 활성결과를 분석하여 각 사이클 단계별 최적화를 수행하여 동결건조제형 개발을 지원한다(그림 5).
그림 5. 동결건조제형개발 workflow
3. 맺음말
바이오의약품의 제형연구는 매년 수요가 지속적으로 증가하고 있는 기술이지만 국내 개별 중소·벤처기업에서 구축하기 힘든 기술이기도 하다. 신약개발지원센터는 바이오의약 연구에 필요한 기술과 인프라가 모두 집약되어 국내 연구·개발자들이 바이오신약 연구를 위해 활용할 수 있는 곳이다.
최근 바이오의약품 시장에서 셀트리온과 알테오젠 등이 기존 정맥투여 주사제형보다 투여 편의성과 의료비 절감 효과가 높은 피하주사 제형기술을 적용한 제품을 개발하여 시장 경쟁력을 갖추게 되어 시장에서의 우위를 점할 수 있는 가능성을 키웠다. 피하주사 제형을 위해서는 고농도의 약물이 필요한데, 신약개발지원센터는 이러한 고농도제형기술을 위해 IntegrityBio사의 고농도 제형플랫폼 기술을 도입하였고 센터 내 기술을 구축하여 국내 연구자에게 기술서비스를 지원할 계획에 있다.
오송첨단의료산업진흥재단 신약개발지원센터는 앞으로도 연구자의 수요에 맞춰 제형기술을 비롯한 바이오신약개발의 가장 혁신적인 해답을 제공함으로써 연구자, 기업과 함께 성장하고 글로벌 경쟁력을 확보할 수 있도록 지속적으로 기술을 구축하고 지원할 것이다.
참고문헌
1. EvaluatePharma(2018.06.), World Preview 2018, Outlook to 2024.
2. KPBMA Brief 한국제약바이오협회 정책보고서 2019 Vol.18
3. 장병선. 단백질 의약 제품의 Formulation 및 Delivery에 관한 업계 동향과 미래 연구방향. BioWave, 1(1) (2009)
4. Chang, B. S. and Patro, S. Y. American Association of Pharmaceutical Scientists, (2004), p113-138
5. Ankit Baheti, Lokesh Kumar, Arvind K. Bansal. J. Excipients and Food Chem. (2010) 1 (1), p41-54 .
6. Carpenter, J.F and Chang, B. S (1996) Lyophilization of biopharmaceutical products in Issues in Pharmaceutical process
engineering, Vol 2 eds by Avis, K. and Wu, V. 199-264.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update