| 최신 항체치료제 기술 개발 현황 | |
|---|---|
| Date 2019-10-04 23:48:05 |
|

교수 / 석사과정
강원대학교 의생명과학대학 의생명융합학부
hjhong@kangwon.ac.kr / ghdwitn55@kangwon.ac.kr
항체치료제는 바이오의약품 중에서 가장 빠른 성장률을 보이고 있다. 항체치료제가 급부상하게 된 주요 이유는 우선 항체 분자의 안정성, 표적에 대한 특이성 및 높은 역가와 도메인 구조 기반의 항체공학 기술의 성공적인 개발 때문이다. 생쥐 단일클론항체로부터 인간화항체 및 인간 단일클론항체 제조기술이 개발되었고, 계속하여 기존 항체치료제의 효능을 더 높이기 위한 Fc engineering, 이중특이항체, 항체-항암제 결합체 등의 biobetter 항체치료제의 개발 기술이 발전되고 있으며, 최근에는 면역 관문 저해제(CTLA, PD-1, PD-L1을 억제하는 항체)인 제3세대 면역항암제의 개발로 기존 표적 항체치료제나 biobetter 제품들과 병합치료가 이루어지고 있다. 지금까지 76 종의 항체치료제가 암, 자가면역질환, 골다공증, 바이러스 감염 예방, 황반변성 등의 치료에 임상적으로 사용되고 있고, 또한 질환의 복잡한 병리 기전의 규명을 바탕으로 치료 효율을 높일 수 있는 혁신적인 항체치료제들이 개발되어 기존 단일클론 항체들을 대체해가는 추세이다[1]. 본고에서는 항체의 구조와 기능적 특성을 review하고, 이를 바탕으로 한 신규 항체의 제작 기술들과 biobetter 항체 치료제의 개발 기술을 소개하고자 한다.
1. 항체(IgG)의 구조적 특성
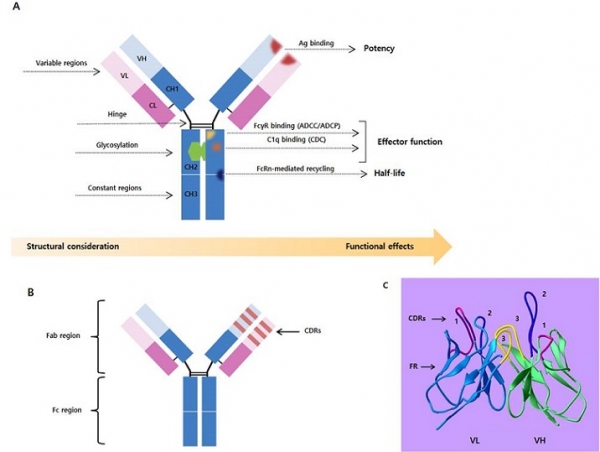
우리 몸 속에 있는 항체는 5개의 immunoglobulin(Ig) isotype(IgG, IgM, IgD, IgA, IgE)이 존재하고 있으나, 항체치료제는 IgG가 사용되고 있다. IgG에는 4개의 subclass(IgG1, IgG2, IgG3, IgG4)가 존재하며 구조가 조금씩 다르다. IgG는 중쇄(heavy chain) 두 분자와 경쇄(light chain) 두 분자로 조립되어 있는 tetramer 구조의 Y자 모양을 갖고 있다(그림 1A). IgG의 중쇄에는 4개의 subclass(γ1, γ2, γ3, γ4)가 존재하고 경쇄에는 2 개의 subclass(κ, λ)가 존재한다. IgG의 중쇄는 각각 항체마다 아미노산 서열이 다른 가변영역(VH)과 subclass 별(γ1, γ2, γ3, γ4)의 불변영역(Cγ1, Cγ2, Cγ3, Cγ4)으로 구성되어 있다. 중쇄의 불변영역은 다시 CH1, H(hinge), CH2, CH3 도메인(domain)으로 구분된다(그림 1A). 경쇄는 κ, λ class 별로 아미노산 서열이 다른 가변영역(Vκ, Vλ)과 불변영역(Cκ, Cλ) 도메인으로 구성되어 있다. 중쇄 불변영역 CH1 도메인과 경쇄 불변영역은 inter disulfide bond를 통하여 heterodimer를 형성하고 있고, 중쇄는 hinge region 사이의 inter disulfide bond를 통하여 homodimer를 형성한다.
항체의 중쇄(VH) 및 경쇄(VL) 가변영역 안에는 항체마다 아미노산 서열이 특히 다른 3 개의 hypervariable region이 각각 존재하는데, 항원과 직접적으로 결합하는 부위이기 때문에 상보성 결정 영역(complementarity determining regions, CDRs)이라고도 부른다(그림 1B). 각 가변영역의 입체 구조를 살펴보면 3개의 CDR들(CDR1, CDR2, CDR3)이 항체의 표면에 고리(loop) 모양을 하고 있고, 고리 아래에 FR(framework region)이 CDR 고리들의 구조를 지지하고 있다(그림 1C). 항체-항원 결합체 구조를 분석하여 보면, 항체마다 항원과의 결합 양상이 다른데, 중쇄의 3 CDRs과 경쇄의 3 CDRs이 모두 항원과 직접적으로 결합하는 경우도 있고, 일부만 항원과 결합하는 경우도 있다. 항체의 구조에서 hinge 위의 부분은 항원 결합 기능을 나타내는 Fab(antibody binding fragment)이 있고, 아래 부분에는 Fc(crystalizable fragment)가 있다.
Figure 1. Antibody structure and function. (A) Structural features and functions of antibody. (B) Fab and Fc regions of antibody. The arrow indicates complementarity determining regions (CDRs). (C) The structures of the CDRs and the FRs. The three CDRs of VL (blue) and VH (green) are numbered.
항체 Fc의 hinge와 CH2 도메인에는 면역세포의 Fcγ receptor(FcγR)나 보체(complement)에 결합하는 부위가 존재하고 effector 기능을 나타내며, CH2 도메인의 아스파라진 잔기(IgG1의 경우 Asn297)는 당화(N-glycosylation)가 되어 있다. 당의 성분은 항체의 열 안정성, PK 및 FcγR와의 결합력에 영향을 미친다. CH2와 CH3 도메인 사이에는 항체의 in vivo half life를 길게 해주는 FcRn(neonatal Fc receptor, protectoin receptor) 결합 부위가 존재한다(그림 1A).
2. 항체(IgG)의 기능
2-1) 중화 효능
항체의 기본적인 기능은 표적 항원의 중화(neutralization)이다. 항체는 가변영역을 통하여 바이러스나 박테리아의 표면에 존재하는 항원에 결합하여 이들을 에워싸서 무력화시키거나 이들이 분비하는 독소를 중화시킨다. 또한, 세포의 성장인자나 성장인자수용체(growth factor receptor)에 결합하여 이들의 작용을 저해함으로써 세포의 성장을 억제시킨다.
2-2) Effector function
항체가 체내에 감염하는 세포나 암세포 표면에 결합하여 이들을 에워싸게 되면 항체의 Fc에 면역세포 macroph age, dendritic cell (DC), natural killer cell (NK)의 FcγR나 혈액에 존재하는 보체가 결합하게 되고 결국 이런 표적 세포들은 죽임을 당한다. 이러한 항체의 effector 기능에는 NK 세포가 표적 세포를 용해시키는 ADCC(antibody-dependent cell-mediated cytotoxicity), macrophage나 DC가 표적 세포를 phagocytosis하는 ADCP(antibody-dependent cellular phagocytosis), 혈액에 존재하는 보체(첫 번째 component가 C1q)가 oligomerized(pentamer or hexamer) 항체에 결합한 후 일련의 다른 보체들의 활성화를 통하여 결국 표적 세포에 구멍을 형성하여 세포를 죽이는 CDC(complement-dependent cytotoxicity)가 있다. 항체의 effector 기능에 의하여 표적 세포가 용해되거나 섭취되면, 결국 DC 같은 항원제시세포(antigen-presenting cells)가 MHC II Class를 통하여 CD4+ T 세포를 활성화시키고 또한 MHC I Class를 통하여 CD8+ T 세포를 활성화시켜서 면역반응의 증폭을 유도할 수 있다.
인체에는 6 종류의 FcγRs(FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRIIIa, FcγRIIIb)가 존재하는데 이들의 발현 양상은 면역세포마다 다르게 나타나고 IgG와의 결합력도 차이가 있다. 예를 들면, FcγRI과 FcγRIIa는 macrophages, monocytes, DC에서 많이 발현되어 ADCP에 관여하고 IgG1과의 결합력이 높다. 반면, FcγRIIIa는 NK 세포에 많이 발현되며 ADCC에 관여하지만 IgG1와의 결합력은 약한 편이다. Fc 위에 이 수용체들이 결합하는 부위도 결정되었다[2].
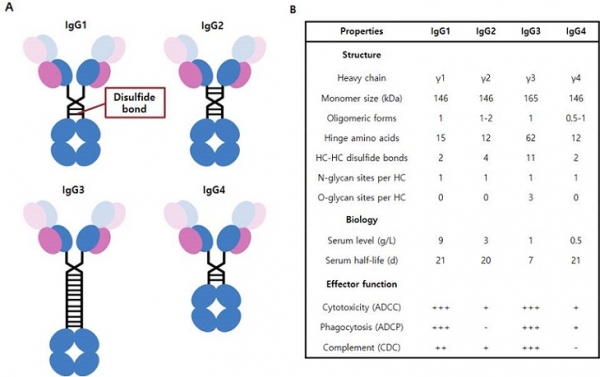
인체 내 IgG에는 4 종의 subclass(IgG1, IgG2, IgG3, IgG4)가 존재한다(그림 2A). IgG1과 IgG3는 각각 총 IgG의 67%, 7%에 해당하고 ADCC, ADCP 및 CDC의 기능을 나타내는 반면, IgG2와 IgG4는 총 IgG의 22%, 4%에 각각 해당하고 effector 기능이 거의 없다. 또한 CH2 도메인의 Asn297에 결합되어 있는 N-glycan도 FcγR와의 결합에 관여하고, 당 성분에 따라 ADCC, ADCP 효능이 다르게 나타낸다.
Figure 2. Characteristics of human IgG subclasses. (A) Structure of human IgG subclasses. Disulfide bonds are indicated by horizontal lines. (B) Structural and biological properties of human IgG subclasses and their effector function degree.
2-3) Neonatal Fc receptor (FcRn) 결합능
IgG Fc의 CH2-CH3 도메인 interface 에는 항체의 인체 내 반감기를 길게 해주는 FcRn (protection receptor)에 결합하는 부위가 존재한다(그림 1A). FcRn은 혈관내피세포 등에서 발현되며, IgG와의 결합력은 약산성일 때 강하고 중성 pH에서는 약하다. 따라서, 혈액에 존재하는 IgG가 pinocytosis에 의하여 혈관내피세포 안으로 endosome 상태로 들어오면, 약산성(pH, 6.0-6.5) 상태의 lysosome과 융합하게 되고 그 결과 IgG는 lysosome 내에 존재하는 FcRn과 결합하게 되므로 lysosome 효소들의 분해로부터 보호되고 있다가, 이 endosome이 recycling에 의하여 세포막과 융합하면 pH 7.4 상태에 노출되어 IgG는 FcRn으로부터 분리되어 다시 혈관 속으로 배출되어, IgG의 인체 내 반감기가 매우 길어진다(그림 3).
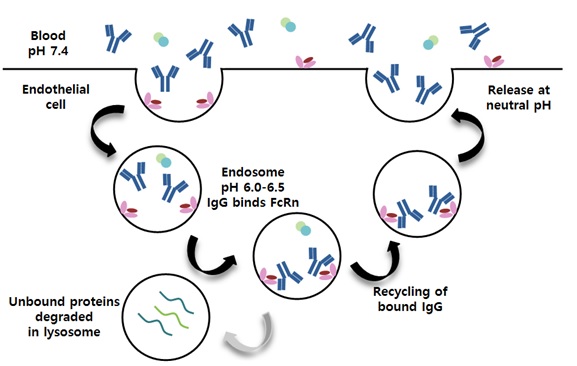
Figure 3. Overview of FcRn mediated antibody recycling pathway
IgG subclass의 혈중 반감기는 차이가 있다. IgG1, IgG2, IgG4의 인체 내 반감기는 평균 3주이나, IgG3의 반감기는 1주 정도이다(그림 2B). 그러나, Fc가 없는 항체 절편의 인체 내 반감기는 2-3시간 내외이다. 따라서, 다른 단백질 치료제의 반감기를 늘리기 위해 Fc와 융합단백질의 형태를 만든다.
2-4) 박테리아의 Protein A, G, L에 대한 결합능
박테리아 Staphylococcus aureus의 Protein A와 Streptococcus 의 Protein G 단백질은 항체의 Fc에 매우 특이적으로 결합하고, Peptostreptococcus magnus의 Protein L은 항체의 κ 경쇄에 특이적으로 결합하며, Mycoplasma genitalium의 Protein M은 κ, λ 경쇄의 가변영역에 특이적으로 결합한다. 이 기능은 항체의 정제에 이용되고 있다.
2-5) 항체의약품의 개발을 위한 IgG subclass의 선택
상기한 바와 같이 IgG1, IgG2, IgG3, IgG4의 혈중 농도, 인체 내 반감기, effector 기능, 물성이 다르다(그림 2B). IgG1은 effector 기능을 나타내며 안정적인 구조를 갖고 있으며, IgG2는 effector 기능이 거의 없으며 IgG1 보다 hinge region이 짧고 disulfide bond가 더 많으며 응집현상이 잘 생긴다. IgG3는 effector 기능을 나타내지만 생체 내 반감기가 IgG1에 비하여 훨씬 짧으며, IgG4는 effector 기능이 거의 없으며 hinge region이 IgG1 보다 더 유연하여 Fab arm exchange (FAE) 현상이 생겨 안정성이 낮다. 따라서, effector 기능이 필요한 항체치료제의 개발에 IgG1을 사용하고, effector 기능이 필요하지 않을 경우 IgG2나 IgG4의 물성을 개량하여 사용한다.
경쇄의 경우, 인체 내에서 κ, λ의 비율은 대략 2:1로 존재하지만, FDA의 승인을 얻은 항체치료제의 경우 κ, λ의 비율은 9:1이다[1]. 이유는 마우스 하이브리도마 제작 시 대부분 κ 경쇄를 갖는 단일클론항체가 생성되고, κ의 물성이 λ보다 더 우수하기 때문이다[3].
3. 신규 항체 발굴 기술(Antibody discovery strategies)
표적 항원의 특정 에피토프에 결합하는 생쥐 단일클론항체를 제작할 수 있는 하이브리도마 기술이 1975년에 개발되었다. 그러나, 쥐 단일클론항체를 인체에 반복적으로 투여하면 HAMA (human anti-mouse antibody) response를 유발하여 효능이 매우 감소하고 부작용이 생긴다. 따라서, 치료용 항체를 개발하기 위해서는 생쥐 단일클론항체로부터 키메릭 항체(chimeric antibody)와 인간화 항체(humanized antibody)를 제조한다. 또는 생쥐 단일클론항체를 제조하지 않고 인간 항체 라이브러리의 phage display 기술과 인간 항체 유전자의 transgenic mice를 이용하여 인간 단일클론항체를 개발한다. 최근에는 환자의 혈액 내에 질환 표적에 대한 항체가 존재할 경우, 항체를 생산하는 B세포로부터 직접 항체유전자를 클로닝하여 인간 단일클론항체(True HumanTM Monoclonal Antiby)를 제조하는 방법이 개발되었다.
3-1) 인간화항체 제조기술
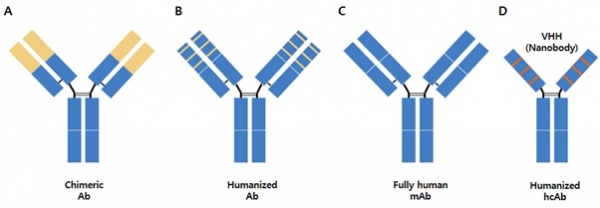
키메릭 항체를 제조하기 위해서는 우선 질환의 표적 항원에 대한 쥐 단일클론항체를 제작하고, 동물실험에서 치료효능을 나타내는 항체를 선발한 다음, 이 항체의 가변영역(VH, Vκ) 유전자들을 클로닝하고, 바람직한 인간 IgG subclass의 불변영역(예, Cγ1, Cκ) 유전자와 재조합시켜 chimeric 유전자를 만든 후, 포유동물세포인 human embryonic kidney (HEK) 세포나 chinese hamster ovary (CHO) 세포에 도입시켜 항체를 발현시킨다(그림 4A). 이렇게 제조된 키메릭 항체는 쥐 항체에 비하여 인체 내 면역반응이 크게 줄어들어 임상적인 치료 효능을 나타내었다(예, Rituxan과 Remicade는 대표적 블록버스터 항체치료제). 그러나 키메릭 항체는 쥐 유래의 항체 가변영역을 포함하고 있으므로 인체에 반복투여할 경우 면역반응을 유발할 수 있다.
키메릭 항체의 생쥐 유래 가변영역을 인간화시키기 위해서 가변영역 내의 항원결합부위에 해당하는 CDRs을 쥐 가변영역과 유사한 서열을 갖는 인간 항체의 framework(FR)에 이식시키는 ‘CDR-grafting’방법이 사용되고 있다(그림 4B). 그러나 단순히 CDRs 만을 이식할 경우 인간화 항체의 친화도가 떨어지는 경우가 많으므로, CDR의 아미노산 잔기들과 중요하게 상호작용하는 FR 아미노산 잔기들을 함께 인간 항체 FR에 이식시켜 인간화 항체의 가변영역을 제작하고 그 이후의 과정은 키메라 항체와 동일하다. 제작된 인간화 항체는 원하는 수준의 친화도와 물성을 얻기 위해 항체의 변이를 통한 최적화 과정을 거친다. 지금까지 암, 자가면역질환, 골다공증, 바이러스 감염 예방, 황반변성 등의 치료제로 수십 종의 인간화 항체가 FDA 승인을 받게 되었고, 암세포에서 과다발현되는 Her2에 대한 Herceptin과 혈관신생인자인 VEGF(vascular endothelial growth factor)에 대한 Avastin은 암치료제로서 대표적 blockbuster 인간화 항체 제품이다.
쥐의 면역반응을 통하여 개발한 인간화 항체는 소동물의 표적 항원에 결합하지 않으므로, 소동물을 이용한 비임상 연구에서 항체의 임상적인 안전성과 유효성을 예측하기 어렵다. 인간과 동물의 표적 항원에 다 결합하는 항체를 제작하기 위하여 인간 항체 라이브러리를 이용한 파지 디스플레이(phage display) 기술이 이용된다.
Figure 4. Schematic representation of (A) chimeric antibody, (B) humanized antibody, (C) fully human monoclonal antibody and (D) humanized heavy chain antibody (hcAb).
3-2) 인간 단일클론 항체 제조기술
인간 단일클론항체(fully human monoclonal antibody)는 하이브리도마 기술을 이용하여 만들기 어렵고 인체에 주사할 수 있는 항원의 종류가 제한되어 있으므로, 인간 항체 라이브러리의 파지 디스플레이 기술과 인간 항체 유전자의 transgenic mice를 이용하여 주로 제조되고 있다(그림 4C).
① 인간 항체 라이브러리의 파지 디스플레이 기술
파지 디스플레이 기술은 대장균에 기생하는 M13 박테리오파지(bacteriophage)의 life cycle을 이용하여 1985년 미국 George P. Smith에 의해 처음 고안되었고, 1990년 영국 MRC의 Sir Gregory P. Winter에 의해 인간 항체의 발굴에 처음 응용되었다. 이 기술은 매우 효과적이고 high throughput screening이 가능하므로, 여러 다른 display 기술(박테리아, 바이러스, yeast, mammalian surface display)에 비하여 가장 많이 사용되고 있다. 이 기술을 이용하여 최초로 만들어진 TNF-α에 대한 인간 항체(상품명 Humira)는 2002년 FDA의 승인을 받아 현재 전 세계 항체의약품 매출 1위를 기록하고 있으며, 80 종의 항체가 임상시험 단계에 진입하였다[1]. 이러한 혁신적인 분자 진화 기술은 항체치료제의 성공적인 개발에 크게 기여하였고, 이 공로를 인정받아 위 두 학자는 2018년 노벨 화학상을 공동 수상하였다.
우선, 인간 항체 라이브러리는 인간의 다양한 VH 및 VL 유전자들을 scFv(single chain Fv: VH와 VL을 링커로 연결한 single chain)나 Fab의 형태로 파지 표면 단백질(pIII) 앞에 융합시킨 형태로 phagemid vector에 클로닝하여 제작한다. 인간 항체 라이브러리의 종류에는 인체 B-림프구로부터 분리한 항체 유전자 서열로 만든 naive antibody library, immune library, 구조적 안정성이 좋고 대장균에서 발현이 잘되는 인간 항체 가변영역의 FR과 인간 항체의 CDR 서열을 모방하여 합성한 synthetic antibody library, 및 naive와 synthetic library를 조합한 semi-synthetic library가 있다. 항체 라이브러리의 다양성이 높을수록 항원 결합 친화도가 높은 항체를 얻을 수 있으므로, 보통 1010 이상의 다양성을 갖는 라이브러리를 제작한다.
인간 항체 라이브러리를 파지 표면에 디스플레이 시키기 위해서는 상기 scFv나 Fab 라이브러리를 발현하고 있는 박테리아에 M13 helper 파지를 감염시키고 밤새 배양하여 파지를 생산한다. 이어서 파지 표면에 디스플레이 된 항체 라이브러리를 특정 항원에 결합시킨 후, 패닝(panning) 방법을 이용하여 특이하게 결합하는 항체들을 선별하여 항체 절편 형태로 항원결합능을 분석한다. 이후 선택한 항체 절편을 IgG로 전환하여 포유동물세포에서 발현시키고, 생산된 인간 항체들의 항원결합능, 물성, PK, 효능 등을 분석한다. 인간 단일클론항체의 최적화 과정은 인간화 항체의 최적화 과정과 유사하며, CDRs 및 FRs의 잔기들을 변이시킨 후 파지 디스플레이 기술을 이용하기도 한다.
② Transgenic mice 이용 기술
생쥐의 중쇄 및 경쇄 유전자들을 불활성화시키고 대신 인간 항체 유전자들을 이식한 transgenic mice(XenoMouseTM, HuMab-MouseⓇ)에 항원을 주사하여 면역화시키고 B 세포들을 분리한 다음, 하이브리도마를 제조하거나 항체 유전자 라이브러리를 제작하여 파지 디스플레이 방법으로 인간 단일클론항체를 발굴한다.
이 기술을 이용하여 기존 키메릭 항체 치료제의 타겟인 EGFR, TNF-α, CD20에 대한 인간 단일클론항체 Vectibix, Simponi, Arzerra가 2세대 항체로 출시되었으며, 새로운 타겟으로 관절염 치료용의 IL-1β에 대한 Ilalis, 건선 치료용의 IL-12/IL-23에 대한 Stelara, 골다공증 치료용의 RANKL에 대한 Prolia, 탄저균 독소 예방용의 Raxibacumab 등 의 수십 종의 인간 항체가 출시되었다.
③ True HumanTM monoclonal antibody 기술
사람 혈액 내에 질환의 표적에 대한 항체가 높은 수준으로 존재할 경우, 이 항체를 분비하는 B 세포를 EBV(Epstein-Barr virus)로 불멸화시킨 후 해당 항체유전자를 클로닝 및 발현하여 인간 단일클론항체를 제조하는 기술이 최근 보고되었다. 예를 들면, MABp1은 IL-1α에 대한 true Human™ monoclonal antibody 로서 대장암 치료를 대상으로 2017년 임상 3상 개발단계에 들어갔으며, 2018년에는 아토피 피부염 치료를 위해 임상 2상 개발에 진입하였고, 그 외 다수의 질환에 대해 임상시험연구가 진행되고 있다[4].
3-3) hcAb 기반 항체치료제의 제조 기술
낙타(또는 라마)는 경쇄와 중쇄로 구성된 정상적인 구조의 항체 외에도 경쇄를 포함하지 않고 중쇄로만 구성되어 있는 중쇄항체(hcAb)를 만든다(그림 4D). 이 항체의 분자량은 80 kDa으로 IgG 보다 크기가 더 작고, CDR3의 길이도 IgG의 중쇄 CDR3 보다 긴 항체들이 있어 IgG가 인식하지 못하는 항원에 결합할 수 있으며, 항체 절편보다 크기가 더 작은 nanobody를 만들 수 있다. hcAb 기반의 항체를 개발하기 위해서는 항원으로 면역화시킨 낙타로부터 B 세포를 얻은 다음, 파지 디스플레이 방법으로 항체를 선별하고 인간화 항체로 전환한다. 2019년에 vWF에 대한 bivalent nanobody(bi-nanobody, 그림 6A)인 caplacizumab이 자가면역질환인 aTTP(acquired thrombotic thrombocytopenic purpura)의 치료를 위하여 nanobody로서는 처음으로 FDA의 승인을 받았다.
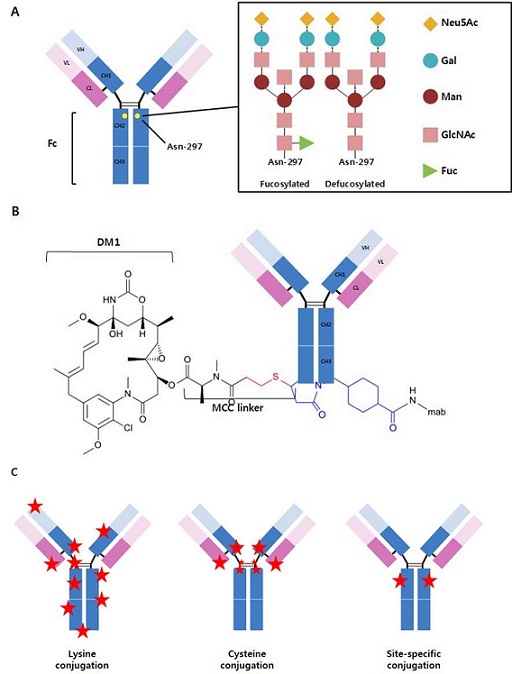
Figure 5. Schematic representation of the biobetter antibody formats. (A) Glyco-engineering (defucosylation). Yellow circles in the CH2 domains indicate N-glycosylation sites at asparagine 297 (Asn297). The Solid lines and dotted lines indicate core structure and variable structures, respectively. Fuc; Fucose, GlcNAc; N-Acetylglucosamine, Man; Mannose, Gal; Galactose, Neu5Ac; N-Acetylneuraminic acid. Glyco-engineered antibodies that removed fucose are preferred to enhance Fc-mediated effector functions. (B) Schematic structure of antibody-drug conjugate. (C) Drug conjugation methods for ADC development.
4. Biobetter antibodies
인간화 및 인간 단일클론항체 기술 개발의 성공에도 불구하고, 기존 항체의 효능을 더 높이기 위한 항체공학기술들이 계속 개발되었다. 예를 들면, 항체의 effector 기능을 향상시키거나 체내 반감기를 늘리기 위한 Fc-engineering, 항체의 암세포 살상능력을 더 높이기 위한 antibody-drug conjugate (ADC), 두 가지 다른 항원에 동시에 결합하는 여러 형태의 이중특이항체(bispecific antibody) 및 항체의 조직이나 암으로의 침투력을 향상시키기 위한 항체절편 기술들이 개발되었다(그림 5, 6).
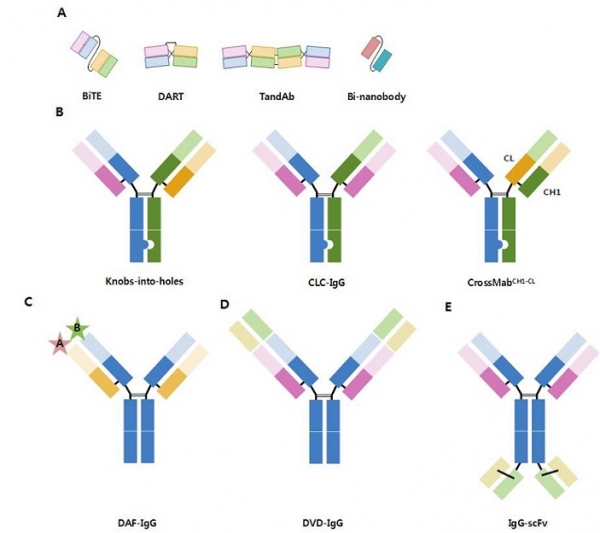
Figure 6. Schematic representation of the bispecific antibody formats. (A) Antibody fragments including BiTE, DART, TandAb and Bi-nanobody. (B) Asymmetric IgG including Knobs-into-holes, CLC-IgG and CrossMabCH1-CL. (C-E) Other bispecific antibody formats including (C) DAF-IgG, (D) DVD-IgG and (E) IgG-scFv.
4-1) Effector 기능 향상을 위한 Fc engineering
항체의 Fc는 여러 면역 세포들이 발현하는 FcγR(FcγRI, FcγRII, FcγRIII)나 보체의 C1q와 결합하는데, 면역세포들 중에서 암세포에 대한 ADCC 기능을 주로 나타내는 NK 세포는 FcγRIIIa를 발현하고 있다. 그러나 Fc와 FcγRIIIa 간의 결합능이 10-7 정도로 약하고 암 부위에 NK 세포가 풍부하지 않으므로, Fc engineering을 통하여 Fc의 FcγRIIIa 에 대한 결합능을 높여줌으로써 항체의 ADCC 기능을 향상시켜주는 것은 항체의 암치료 효능을 높이기 위한 중요한 전략이 된다[5].
실제로, IgG1 Fc의 Asn297에 붙어있는 N-glycan의 성분 중에서 fucose를 제거해주면 Fc의 FcγRIIIa 에 대한 결합능이 높아져 ADCC 기능의 향상이 발견됨에 따라, fucose 전이효소인 alpha 1-6 fucosyltransferase(FUT8)를 knockout 시킨 CHO 세포주(POTELLIGENT®)에서 항체를 생산하는 기술이 일본 Kyowa Hakko Kirin사에 의하여 개발되었다(그림 5A). 이 platform 기술을 이용한 첫 번째 glyco-engineered 항체로 CCR4를 발현하는 T leukemia-lymphoma의 치료용 항체(mogamulizumab)가 2012년에 일본에서 의약품으로 승인을 받았다. 또한, 스위스의 GlycArt사에서 당전환 효소 GnTIII를 과발현하는 CHO 세포를 이용하여 fucose가 거의 없는 항체를 생산하는 기술을 개발하였고, 그 결과 2013년 CD20에 결합하는 retuximab(1세대 항체)의 2세대 항체인 obinituzumab이 개발되어 CLL(chronic lymphocytic leukemia)의 치료제로 승인받았다. 임상시험 결과 이 항체는 retuximab에 비하여 더 나은 치료효능을 나타냈지만 부작용도 더 많이 유발하는 것으로 관찰되었다[6]. 현재 20 여종의 항체들이 임상 개발 단계에 있다.
한편, Fc내의 FcγR 결합 부위에 있는 1~5 개의 아미노산의 변이를 통해 Fc-FcγR 및 C1q 결합력을 향상시킨 결과 ADCC/ADCP 및 CDC 기능이 향상된 항체의 개발 사례도 보고되었다[7].
4-2) Pharmacokinetics(PK)를 조절하기 위한 Fc engineering
IgG의 CH2-CH3 도메인에는 FcRn에 결합하는 부위가 존재하고 있으므로, 이 FcRn 결합부위의 아미노산 서열을 변경하여 약산성 조건에서 FcRn에 대한 결합능을 높여주면 항체의 반감기가 증가되어 그 결과 항체의 효능이 향상된다. 예를 들면, M252Y/S254T/T256E (YTE)의 변이를 갖는 항체는 pH 6에서 FcRn에 대한 결합능이 약 10배 증가하였고, 그 결과 인체 내 혈중 반감기가 약 2~4배 증가하였다[8,9]. 또한, M428L/N434S (LS)의 변이를 갖는 항체도 혈중 농도가 높아짐으로 인해 항암 효능이 증가됨이 보고되었다[10].
역으로, 중성 pH와 약산성 pH에서 모두 FcRn에 대해 높은 친화력을 갖는 IgG 변이체는 endogenous 항체나 항원의 분해를 가속화시키고, 중성 pH에서 FcRn에 대해 높은 친화력을 갖는 IgG 변이체(sweeping antibody)는 lysosome에서 분해가 잘되어 병원성 항원 물질의 제거를 가속화시키는 것으로 보고되었다[11,12].
4-3) Antibody-drug conjugate (ADC) 기술
항체 Fc의 effector 기능은 강력하지 않으므로 항암 치료를 위하여 저분자 항암제와 병합치료가 이루어지고 있다. 그러나 저분자 항암제는 암세포뿐만 아니라 빠르게 증식하는 정상 세포들도 죽이므로 독성 문제를 유발한다. 따라서 암 특이적인 항체에 독성이 강한 항암제를 결합시켜 암세포에만 항암제가 전달되도록 하는 ADC 기술이 개발되었다.
ADC를 제조하기 위해서는 암세포 표면의 표적에 결합하여 암세포 내로 들어갈 수 있는 치료용 항체와 보편적인 항암제보다 세포 독성이 100-1000배 더 강한 약물 및 약물을 항체에 결합시켜 주는 링커(linker)가 필요하다(그림 5B).
ADC의 작용 기전은 ADC가 암세포의 표적 단백질에 결합한 후 endosome 형태로 세포 안으로 들어가서 리소좀(lysosome)과 융합하게 되면 약산성 환경에 노출되는데, 이때 리소좀의 단백질 분해효소에 의하여 링커가 가수분해되면, 약물이 항체로부터 유리되어 리소좀으로부터 세포질로 유출되고, 이어서 약물이 타겟에 결합하여 세포분열을 억제하면 암세포는 결국 죽게 된다. 이중 일정 양의 약물은 세포 밖으로 유출되어 주변세포에 들어가 by-stander effect로 세포를 죽일 수 있다.
바람직한 ADC는, ADC의 링커가 안정하여 혈중에서 분해되지 않고, 원래의 항체와 동일한 항원결합능을 나타내며, 암세포에 결합한 후 4-5시간 이내에 빨리 세포 내로 들어가며, 약물이 세포질로 잘 유출되어야 한다. 현재까지 5 종의 ADC(Adcetris, Kadcyla, Mylotarg, Besponsa, polatuzumab vedotin)가 혈액암과 유방암의 치료제로 각각 FDA 승인을 받았고, 이 중 Mylotarg는 세포독성 문제로 시장에서 철회되었으며, 현재 수십 건의 ADC의 임상 개발이 진행되고 있다(표 1).
Table 1. Overview of ADC developed in recent years and their clinical status. Abbreviations: MMAE = monomethylauristatin; DM =maytansinoid; PSMA = prostate-specific membrane antigen; GPNMB = transmembrane glycoprotein NMB; NaPi = sodiumdependent inorganic phosphate; CEACAM = carcinoembryonic antigen-related cell adhesion molecule; EGFR = epidermal growth fector receptor.
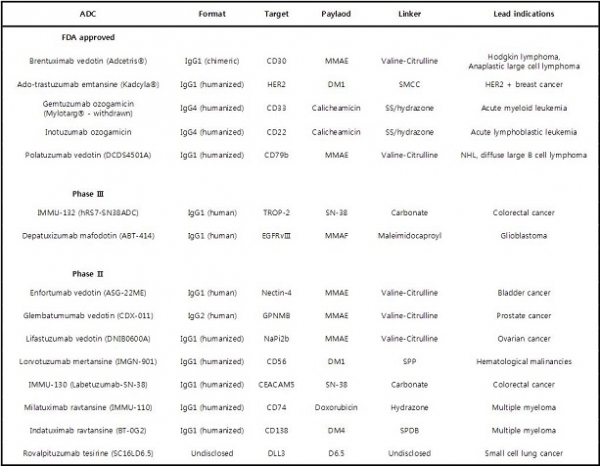
ADC 제조에 사용되고 있는 약물, 링커, 약물-항체의 결합 방식 및 지금까지 개발된 ADC 개발현황을 간략히 요약하면 다음과 같다.
① 약물
ADC에 주로 사용되고 있는 약물은 auristatins 계열의 MMAE(monomethyl auristatin E)와 MMAF(monomethyl auristatin F), maytansinoids (DM1, DM4) 및 calicheamicin 이다. Auristatin과 maytansinoid는 세포질 내에서 세포의 분열에 관여하는 tubulin에 결합함으로써 빨리 자라는 세포의 분열을 저해하여 세포의 사멸을 유도하고, calicheamicin은 핵 내의 DNA에 결합하여 DNA를 절단함으로써 세포를 죽인다.
② 링커
항체와 항암제를 연결시키는 링커는 혈액에서는 안정하고, 세포 안의 리소좀에서는 완전히 잘려야 하며, ADC가 응집되지 않도록 polar 해야 한다는 것이다. ADC 제작에 사용되는 cleavable 링커로는 리소좀의 cathepsin B 효소에 의해 잘리는 dipeptide linker(valine-citrulline), 리소좀의 약산성 pH에 민감한 hydrazone, reducing 조건에 민감한 disulfide(SPP, SPDB)가 있는데, 이 중 valine-citrulline dipeptide linker가 가장 널리 사용되고 있다[13,14]. Adcetris는 이 링커를 포함하는 ADC이다(표 1).
Cleavable 링커 외에도 non-cleavable 링커를 사용한 ADC도 리소좀에서 분해되어, 아미노산이 붙어있는 채로 항암제가 세포질로 유출되어 세포사멸 효과를 잘 나타냄이 확인되었다. 예를 들면, non-cleavable thioether(SMCC) 링커를 갖는 T-DM1(trastuzumab-DM1)은 cleavable disulfide reducible 링커를 갖는 ADC 보다 혈중 안정성이 더 높고 off-target 독성이 더 낮은 결과로 동물시험에서 효능이 더 높게 나타나는 것으로 보고되었다[15,16.]
③항체와 링커-항암제의 conjugation 전략
ADC 개발 초기에는 항체의 lysine 잔기에 링커를 결합시켰다. 그러나 항체 표면에는 약 80개의 lysine 잔기가 있으므로 약물이 결합하는 부위와 수가 heterogeneous 하므로(그림 5C), 항암 효능과 약물의 독성(off-target activity)을 고려하여 항체 한 분자에 결합된 약물의 수(drug/antibody ratio, DAR)가 평균 4가 되는 ADC를 분리하여 치료제로 개발하였고, 지금까지 3 제품(gemtuzumab ozogamicin, trastzumab emtansine, inotuzumab ozogamicin)이 FDA 의 승인을 받았다. 또한, lysine 잔기 외에도 항체의 중쇄-중쇄, 중쇄-경쇄 간의 interchain disulfide bonds를 환원시켜 약물을 결합시키고 DAR가 약 4인 ADC를 분리하여 개발한 2개의 제품(brentuximab vedotin, polatuzumab vedotin)이 FDA 승인을 받았다.
이어서 homogeneous한 ADC의 제조를 위하여 다양한 site-specific ADC 제조 전략들이 개발되고 있다[17]. 예를 들면, 항체의 중쇄 또는 경쇄 내에 약물을 결합시킬 이상적인 위치의 1개 또는 2개의 아미노산 잔기를 cysteine, noncanonical or non-natural 아미노산으로 치환하거나, peptide tag을 항체에 포함시키거나 또는 Asn297에 붙어있는 N-glycan의 fucose 대신 6-thiofucose로 치환하여 약물을 결합시킨 DAR가 2 또는 4의 ADC들이 개발되었다. 이들은 더 높은 값의 DAR을 갖는 ADC보다 응집이 덜 되고 안정성이 더 높으며 향상된 therapeutic index 와 PK를 나타내었다[18]. 다른 site-specific ADC 제조 전략들이 계속 보고되고 있으며, 앞으로 임상시험이 진행됨에 따라 가장 안전하고 효과가 좋은 전략이 판명될 것으로 전망한다.
4-4) 항체 절편(Antibody fragment)
항체 절편으로 Fab, single-chain antibody fragment(scFv), nanobody(VHH)가 주로 사용되며, nanobody인 경우에는 anti-camel antibody response를 방지하기 위하여 인간화 항체로 제작한다. 항체 절편은 whole IgG에 비하여 크기가 작고 Fc가 없으므로 조직의 침투율이 높고, 인체 내의 반감기가 짧으며, effector functino이 없고, 박테리아에서 대량생산이 가능하다. 또한, 항원과 monovalent 결합을 하므로 avidity effect가 없어 IgG에 비해 결합력이 낮다. 따라서, 항체 절편은 effector function이 없고 항원결합능만 필요할 경우의 치료 목적이나 생체 진단용으로 개발된다. 항체 절편을 치료용 목적으로 사용하기 위해 반감기를 늘리고자 할 때에는 PEG를 붙이거나 FcRn에 결합가능한 albumin 또는 albumin에 결합하는 항체 절편을 융합시킨다. 또한 effector 기능을 위하여 암 항원에 결합하는 항체 절편과 cytotoxic T 세포에 결합하는 항체 절편과의 bispecific 항체를 제조하여 암치료제로 개발하고 있다. 항체 절편들의 개발 사례를 요약하면 다음과 같다.
①Antigen-binding fragments (Fabs)
Fab은 약 50 kDa의 크기이고, 대량생산을 위해서 IgG를 papain 효소로 절단한 후 Fab만을 분리하거나 박테리아에서 재조합 방법으로 생산한다. 지금까지 미국 FDA의 승인을 받아 임상적으로 사용되고 있는 항체 절편은 혈소판 당단백질인 GPIIb/IIIa에 대한 chimeric Fab(abciximab), VEGF에 대한 humanized Fab(ranibizumab), TNF-α에 대한 PEGylated humanized Fab(certolizumab), dabigatran에 대한 humanized Fab 등이다.
②Single-chain variable fragments (ScFvs), diabody
ScFv는 약 28 kDa의 크기이고 중쇄와 경쇄의 Fv를 10~25 아미노산 길이의 친수성 펩타이드 링커로 연결시킨 단일 폴리펩타이드이다. 이 링커의 길이를 5 아미노산 길이로 더 짧게 하면 diabody의 구조가 만들어진다. ScFv의 단독 형태로 제품은 아직 출시되지 않았으나, 특이성이 다른 두 scFv를 연결한 이중특이 단백질(blinatumomab)은 암치료용 제품으로 출시되었다.
③Nanobody
낙타나 라마로부터 유래된 VHH는 15 kDa의 크기로서 인간 항체의 VH 서열과 유사하고, 인간 single domain antibody 보다 박테리아에서의 soluble expression 효율이 높고 물성이 좋으며, phage display 기술에도 잘 적용된다. 따라서 이중항체의 제작에도 scFv나 Fab 보다 더 유리하다.
4-5) 이중특이항체(Bispecific antibody)
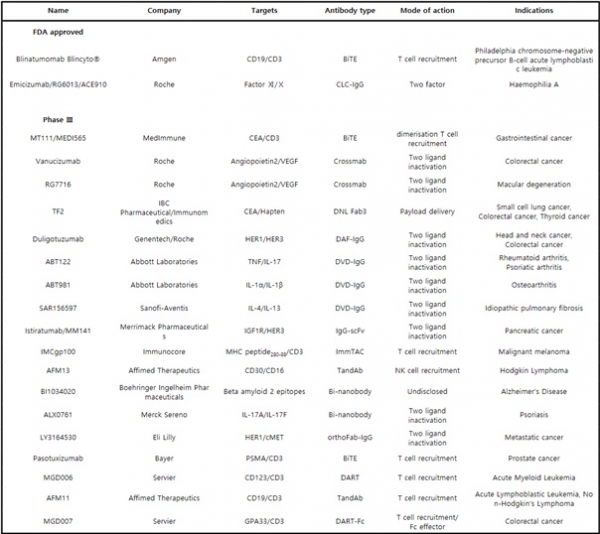
최근 항체공학기술의 발전과 암, 면역체계에 대한 이해가 상승되면서, 두 가지 다른 항원에 동시에 결합함으로써 기존 항체치료제와는 다른 novel mechanism으로 치료 효능을 더 향상시키고 암에 대한 내성을 감소시키는 이중특이항체들이 개발되어, 현재 임상적으로 사용되고 있거나 임상시험이 진행 중이다(표 2). 가장 대표적인 이중특이항체의 개발 전략에 대하여 간략히 요약하면 다음과 같다(그림 6).
Table 2. Bispecific antibodies developed in recent years and their clinical status. Abbreviations: BiTE = bispecific T cell engager; CLC = common light chain; DNL = dock-and-lock; Fab = antigen binding fragment; DAF = dual acting Fab; DVD-IgG = dual variable domain immunoglobulin; scFv = single chain variable fragment; ImmTAC = immune-mobilizing monoclonal TCRs against cancer; TandAb = tandem diabody; DART = dual affinity re-targeting molecule; Fc = fragment of crystallization; EPCAM = epithelial cell adhesion molecule; CEA = carcinoembryonic antigen; VEGF = vascular endothelial growth factor; TNF = tumor necrosis factor; IGFR = insulin growth factor receptor; MHC = major histocompatibility complex; PSMA = prostate-specific membrane antigen; GP = glycoprotein; NK = natural killer.
①항체 절편 (BiTE, DART, TandAb, bi-nanobody)
BiTE (bispecific T-cell engager)는 암세포에 결합하는 scFv와 살상능력이 가장 강한 T 면역세포의 CD3에 결합하는 scFv를 연결한 scFv-scFv의 bivalent 이중특이항체이다(그림 6A)[19]. 이중 B 세포의 CD19과 CD3를 동시에 결합하는 blinatumomab은 B-ALL(B cell acute lymphoblastic leukemia)의 치료제로 FDA 승인을 받아 임상적으로 사용되고 있고, 소화기암과 전립선암의 치료를 위한 다른 암 표적(CEA, PSMA)에 결합하는 BiTE도 개발되어 각각 임상 3상과 1상 시험이 진행 중이다[20]. 이외에도 diabody 형태의 DART(dual affinity re-tarteting)가 개발되었고, CD123/CD3에 대한 DART가 임상 1상 개발 단계에 있다(그림 6A)[21]. 그리고 두 분자의 diabody로 조립된 tetravalent bispecific 분자인 Tandem diabody(TandAb)도 개발되어, CD19과 면역세포(T의 CD3 또는 NK의 CD16)에 각각 결합하는 diabody로 구성된 TandAb이 임상 1상 개발 단계에 있다(그림 6A)[22]. 또한 bispecific nanobody도 임상 1상 개발 단계에 있다. 그러나 BiTE, DART, TandAb, binanobody에는 Fc가 없기 때문에 반감기가 짧으며 대부분 혈액 질환 치료를 적응증으로 하고 있다.
②Asymmetric IgG
IgG 구조의 이중특이항체 형태로는 asymmetric IgG가 있다(그림 6B). 이중 맨 처음 개발된 형태는 Triomab으로서 서로 다른 항원에 결합하는 다른 종 유래의 항체가 조립된 IgG이다. 예를 들면, EPCAM에 대한 rat 항체와 CD3에 대한 mouse 항체로 구성된 catumaxomab이 개발되어 2009년에 FDA 승인을 얻었으나 상업적인 이유로 시장에서 철회되었다.
후에 중쇄의 heterodimerization 전략이 개발되었고 가장 먼저 시도된 방법이 서로 다른 두 항체의 중쇄 CH3 도메인에 ‘knobs-into-holes’변이(한 중쇄에 T366Y, 다른 중쇄에 Y407T)를 시켜서 같은 중쇄끼리는 homodimerization이 잘 되지 않고 다른 중쇄 간의 heterodimerization이 더 잘 되는 기술이 개발되었고, 이어서 두 다른 중쇄 간의 heterodimerization이 정전기적인 결합 방식으로 이루어지게 하는 변이(한 중쇄는 K392D/K409D, 다른 중쇄는 E356K/D399K)가 개발되었다[23,24,25].
또한, 유전자 서열을 변경하지 않고 이중특이항체의 한 Fab arm의 중쇄-경쇄 도메인만을 스와핑하는 ‘CrossMab’ 기술이 개발되었다. 특히 Fab의 CH1-CL 도메인 스와핑이 가장 좋은 방법으로 보고되었다[26,27]. 현재 혈관생성인자인 VEGF와 angiopoietin 2에 동시에 결합하는 asymmetric IgG 형태의 이중특이항체(vanucizumab, RG7716)가 개발되어 대장암이나 황반변성을 적응증으로 임상 2상 개발을 진행하고 있다[20]. 그리고 knobs-into-holes 변이를 갖는 asymmetric IgG에 동일한 경쇄(common light chain, CLC)가 포함된 이중특이항체(CLC-IgG) 형태가 개발되었다. 이 항체(emicizumab)는 Factor IX과 Factor X에 동시에 결합하는 혈우병의 치료제로서 FDA의 승인을 받았다[28].
③Dual-acting Fab(DAF)-IgG
한 항체가 구조적 유사성을 갖는 두 종류의 항원에 결합 가능한 dual-acting Fab(DAF)-IgG가 개발되었다(그림 6C)[29]. 한 예로, duligotuzumab은 Her1(EGFR)과 HER3에 결합 가능한 IgG로서 암세포의 두 신호전달경로를 억제시킬 수 있으며 현재 두경부암 치료를 위해 임상 2상 개발 단계에 있다.
④항원 결합 도메인과 IgG의 융합
DVD(dual variable domain)-Ig 는 tetravalent bispecific antibody로서 한 항체의 중쇄 및 경쇄 가변영역의 N-말단 위에 다른 특이성을 갖는 항체의 중쇄 및 경쇄 가변영역이 융합된 이중특이항체이다(그림 6D)[30]. 이는 주로 두 개의 다른 수용성 인자(예, 싸이토카인)에 결합하는 용도로 개발되었다. 예를 들면, ABT122는 TNFα와 IL-17에 동시에 결합하고, ABT981은 IL-1α와 IL-1β에, SAR156597은 IL-4와 IL-13에 동시에 결합하는 염증 치료용 이중특이항체로서, 현재 임상 2상 개발 단계에 있다[30].
그리고 scFv나 nanobody를 IgG의 중쇄나 경쇄의 N-말단 혹은 C-말단에 융합시킨 이중특이항체들도 개발되고 있다(그림 6E). 이들 중 IGF1R과 HER3에 동시에 결합하는 tetravalent bispecific antibody인 istiratumab(MM141)은 IgG에 scFv를 융합시킨 형태이다. 현재 췌장암 치료제로 임상2상 개발 단계에 있다[31].
5. 물성
항체는 크기가 크고 복합적인 구조를 갖고 있기 때문에 고농도로 존재할 때 응집(aggregation)이 생기기 쉽다. 항체치료제가 성공적으로 개발되기 위해서는 항체 후보물질의 친화도와 효능 외에 developability (약으로서 적합함)의 요건을 갖추어야 한다. 특히 항체치료제는 많은 양을 소액의 용액에 담아 배달되기 때문에 보통 100 mg/ml 이상의 농축된 항체 제제화가 필요하며, 이 과정에서 항체의 응집이 생기기 쉽다. 단백질의 응집은 안정성과 연관되어 있으며, 응집이 일어나면 항체치료제의 활성이 감소하고 면역반응을 유발한다. 따라서, 항체를 스크리닝할 때 물성이 좋다고 알려진 항체 scaffold들을 선정하고, 또한 항체가 응집될 만한 서열들을 protein engineering을 통하여 제거한다. 이때 항체의 affinity, 특이성 및 안정성도 같이 최적화되어야 한다. 또한, 응집이 더 생기지 않도록 formulation 전략들을 개발한다[32,33].
6. 결론
지난 30년간 인간화항체, 인간 단일클론항체, 항체 절편, Fc engineering, ADC 및 이중특이항체의 항체 플랫폼 기술 개발의 성공으로, 신규 타겟에 대한 항체들의 개발 외에도 기존 타겟과 동일하지만 기존 항체와는 다른 작용 기전을 갖거나 부작용을 줄임으로써 치료 효율이 향상된 biobetter 항체들이 계속 개발되어 왔다. 최근에는 정밀의약 개발을 위해 환자의 임상-오믹스 빅데이터를 기반으로 항체의 타겟과 에피토프를 선정하고, 친화도, valency, IgG subclass, ADC 또는 bispecific(or multispecific) 항체 제조 등을 고려한 최적화된 항체치료제 개발이 시도되고 있다. 또한, 기존 항체치료제들의 특허가 만료됨에 따라 biosimilar 항체 제품들이 출시되어 의료 수가를 낮출 수 있게 되고, 따라서 더 많은 환자들의 치료에 항체가 사용될 수 있을 것으로 기대된다.
참고문헌
1. Kaplon, Hélène, and Janice M. Reichert. “Antibodies to watch in 2019.” MAbs. Vol. 11. No. 2. Taylor &Francis, 2019.
2. Shields, Robert L., et al. “High resolution mapping of the binding site on human IgG1 for FcγRI, FcγRII, FcγRIII, and FcRn anddesign of IgG1 variants with improved binding to the FcγR.” Journal of Biological Chemistry 276.9 (2001): 6591-6604.
3. Ewert, Stefan, et al. “Biophysical properties of human antibody variable domains.” Journal of molecular biology 325.3 (2003): 531-553.
4. Hong, David S., et al. “MABp1, a first-in-class true human antibody targeting interleukin-1α in refractory cancers: an open-label, phase 1 dose-escalation and expansion study.” The lancet oncology 15.6 (2014): 656-666.
5. Lazar, Greg A., et al. “Engineered antibody Fc variants with enhanced effector function.” Proceedings of the National Academy of Sciences 103.11 (2006): 4005-4010.
6. Marcus, Robert, et al. “Obinutuzumab for the first-line treatment of follicular lymphoma.” New England Journal of Medicine 377.14 (2017): 1331-1344.
7. Stavenhagen, Jeffrey B., et al. “Fc optimization of therapeutic antibodies enhances their ability to kill tumor cells in vitro and controls tumor expansion in vivo via low-affinity activating Fcγ receptors.” Cancer research 67.18 (2007): 8882-8890.
8. Dall’Acqua, William F., Peter A. Kiener, and Herren Wu. “Properties of human IgG1s engineered for enhanced binding to the neonatal Fc receptor (FcRn).” Journal of Biological Chemistry 281.33 (2006): 23514-23524.
9. Robbie, Gabriel J., et al. “A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults.” Antimicrobial agents and chemotherapy 57.12 (2013): 6147-6153.8.
10. Zalevsky, Jonathan, et al. “Enhanced antibody half-life improves in vivo activity.” Nature biotechnology 28.2 (2010): 157.9.
11. Ward, E. Sally, Siva Charan Devanaboyina, and Raimund J. Ober. “Targeting FcRn for the modulation of antibody dynamics.” Molecular immunology 67.2 (2015): 131-141.
12. Igawa, Tomoyuki, Kenta Haraya, and Kunihiro Hattori. “Sweeping antibody as a novel therapeutic antibody modality capable of eliminating soluble antigens from circulation.” Immunological reviews 270.1 (2016): 132-151.
13. Jain, Nareshkumar, et al. “Current ADC linker chemistry.” Pharmaceutical research 32.11 (2015): 3526-3540.
14. Dubowchik, Gene M., et al. “Cathepsin B-labile dipeptide linkers for lysosomal release of doxorubicin from internalizing immunoconjugates: model studies of enzymatic drug release and antigen-specific in vitro anticancer activity.” Bioconjugate chemistry 13.4 (2002): 855-869.12.
15. Girish, Sandhya, et al. “Clinical pharmacology of trastuzumab emtansine (T-DM1): an antibody–drug conjugate in development for the treatment of HER2-positive cancer.” Cancer chemotherapy and pharmacology 69.5 (2012): 1229-1240.
16. Erickson, Hans K., et al. “The effect of different linkers on target cell catabolism and pharmacokinetics/pharmacodynamics of trastuzumab maytansinoid conjugates.” Molecular cancer therapeutics 11.5 (2012): 1133-1142.
17. Beck, Alain, et al. “Strategies and challenges for the next generation of antibody–drug conjugates.” Nature reviews Drug discovery 16.5 (2017): 315.
18. Agarwal, Paresh, and Carolyn R. Bertozzi. “Site-specific antibody–drug conjugates: the nexus of bioorthogonal chemistry, protein engineering, and drug development.” Bioconjugate chemistry 26.2 (2015): 176-192.
19. Baeuerle, Patrick A., Peter Kufer, and Ralf Bargou. “BiTE: Teaching antibodies to engage T-cells for cancer therapy.” Current opinion in molecular therapeutics 11.1 (2009): 22-30.
20. Elgundi, Zehra, et al. “The state-of-play and future of antibody therapeutics.” Advanced drug delivery reviews 122 (2017): 2-19.
21. Johnson, Syd, et al. “Effector cell recruitment with novel Fv-based dual-affinity re-targeting protein leads to potent tumor cytolysis and in vivo B-cell depletion.” Journal of molecular biology 399.3 (2010): 436-449.
22. McAleese, Fionnuala, and Markus Eser. “RECRUIT-TandAbsⓇ: harnessing the immune system to kill cancer cells.” Future oncology 8.6 (2012): 687-695.
23. Ridgway, John BB, Leonard G. Presta, and Paul Carter. “‘Knobs-into-holes’engineering of antibody CH3 domains for heavy chain heterodimerization.” Protein Engineering, Design and Selection 9.7 (1996): 617-621.
24. Atwell, Shane, et al. “Stable heterodimers from remodeling the domain interface of a homodimer using a phage display library.” Journal of molecular biology 270.1 (1997): 26-35.
25. Merchant, A. Margaret, et al. “An efficient route to human bispecific IgG.” Nature biotechnology 16.7 (1998): 677
26. Schaefer, Wolfgang, et al. “Immunoglobulin domain crossover as a generic approach for the production of bispecific IgG antibodies.” Proceedings of the National academy of Sciences 108.27 (2011): 11187-11192.
27. Klein, Christian, Wolfgang Schaefer, and Jörg T. Regula. “The use of CrossMAb technology for the generation of bi-and multispecific antibodies.” MAbs. Vol. 8. No. 6. Taylor &Francis, 2016.
28. Sampei, Zenjiro, et al. “Identification and multidimensional optimization of an asymmetric bispecific IgG antibody mimicking the function of factor VIII cofactor activity.” PloS one 8.2 (2013): e57479.
29. Schaefer, Gabriele, et al. “A two-in-one antibody against HER3 and EGFR has superior inhibitory activity compared with monospecific antibodies.” Cancer cell 20.4 (2011): 472-486.
30. Wu, Chengbin, et al. “Simultaneous targeting of multiple disease mediators by a dual-variable-domain immunoglobulin.” Nature biotechnology 25.11 (2007): 1290.
31. Camblin, Adam J., et al. “Dual inhibition of IGF-1R and ErbB3 enhances the activity of gemcitabine and nab-paclitaxel in preclinical models of pancreatic cancer.” Clinical Cancer Research 24.12 (2018): 2873-2885.
32. Elgundi, Zehra, et al. “The state-of-play and future of antibody therapeutics.” Advanced drug delivery reviews 122 (2017): 2-19.
33. Goulet, Dennis R., and William M. Atkins. “Considerations for the Design of Antibody-Based Therapeutics.” Journal of pharmaceutical sciences (2019).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update