| 빛에 감응하는 구조체를 이용한 | |
|---|---|
| Date 2019-10-05 16:57:30 |
|

교수 / 박사과정
서울시립대학교 생명과학과
inheechoi1@uos.ac.kr / seungki2@uos.ac.kr
1. 서론
최근, 정교하게 제작된 다중기능성 구조체들을 이용하여 약물이 생체 내의 목표로 하는 조직이나 기관 등 필요한 부위에 정확하게 전달될 수 있는 약물전달시스템을 개발하는 연구가 활발히 이루어 지고 있다. 이러한 기술은 일차적으로 실제 약물 투여량의 감소뿐만 아니라 그에 따른 부작용에 대한 우려를 감소시킬 수 있다는 장점을 가진다. 이외에도 약물전달시스템은 (1) 난용성이나 흡수가 잘 되지 않는 약물의 생체 내 흡수율을 높여주기 위한 연구, (2) 약물의 약효를 장기간 유지시켜주는 서방형 제재에 대한 연구, (3) 목표 부위에 항체 등을 이용하여 더욱 정확하게 약물을 운반시키는 방법에 대한 연구, (4) 다양한 자극에 감응하여 원하는 시점에 약물을 방출시키는 기능성 약물 전달에 대한 연구 등으로 크게 나뉠 수 있다.
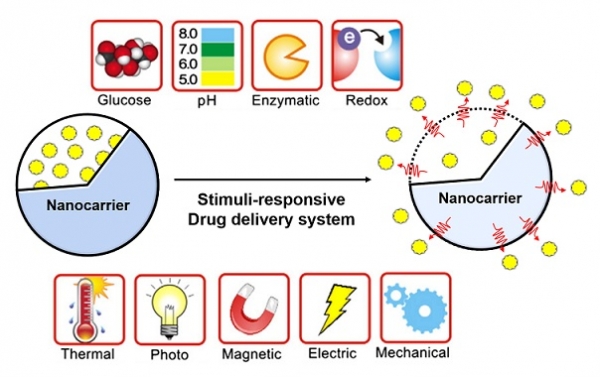
다양한 물리화학적 자극에 감응하여 약물을 방출시킬 수 있는 기능성 약물전달시스템은, 이를 위한 구조체 자체의 물성에 대한 연구를 비롯하여 자극 감응 메커니즘, 체내 환경과의 상호작용에 관련된 연구가 함께 수행되고 있다. 한편, 기능성 약물전달시스템을 위한 자극은 크게 물리적 자극(온도, 빛 등)과 화학적 자극(pH, 이온, 효소 반응 등)으로 구분할 수 있다. 이러한 자극에 감응할 수 있는 화합물(예: 고분자) 및 구조를 이용하여 다양한 구조체(예: 나노캐리어, 나노필름)를 제작하는 연구가 활발히 수행되고 있으며, 이러한 구조체는 외부 자극에 반응하여 구조의 변화 혹은 주위 환경의 변화를 유도하여 약물을 전달할 수 있게 된다(그림 1). 자극감응성 구조를 이용하는 방식은 더 나아가 원하는 시점에 표적위치에서 약물을 방출 시킬 수 있는 새로운 약물 전달시스템의 개발을 가능하게 한다.
그림 1. 기능성 약물 전달에 사용되는 다양한 외부 자극에 대한 예시
그 중, 빛은 원하는 시간(자극의 개시와 종료가 즉각적임) 및 공간 특이적으로 자극을 줄 수 있으며, 비침습적으로 적용할 수 있기 때문에 기능성 약물전달시스템의 외부 자극으로 특히 주목을 받고 있다. 이에, 빛에 감응하는 부위(예: 화학 링커, 나노입자 등)를 삽입하여 파장 특이성, 즉, 자외선(<400 nm), 가시광선 (400 nm-700 nm), 또는 근적외선(700 nm<)에 감응하도록 제조하여 활용되고 있다. 특히, 근적외선 영역의 빛은 피부 및 조직 투과력이 우수하며, 에너지가 상대적으로 다른 파장대의 빛에 비해 낮기 때문에 타겟 조직이나 기관의 손상을 최소화할 수 있어 응용 가능성이 매우 크다. 본 기고문에서는 빛에 감응하는 나노캐리어 및 구조체를 이용한 약물전달시스템의 최신 연구동향을 다루고자 한다. 특히, 빛에 의해 (1) 구조적 변화가 유도되는 화합물을 이용한 약물전달, (2) 구조가 분해됨을 이용한 약물전달, 그리고 (3) 광열전환효과를 통한 약물전달 시스템에 대해 소개하고자 한다.
2. 빛에 의한 약물전달체의 구조적 변화를 이용한 약물 전달시스템
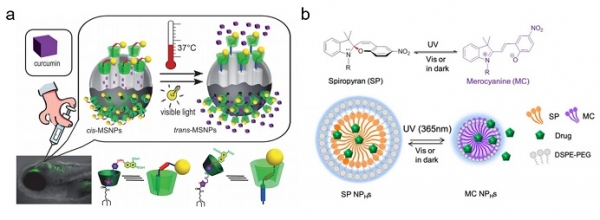
빛에 의한 구조적 변화를 이용한 약물 전달 구조체는 광 감응성 부위를 포함한 화학적 구조로부터 유도될 수 있다[1]. 특히, 광이성질체화 특성을 갖는 화합물이 빛에 의해 구조나 형태가 가역적으로 변화가능하여 주로 적용되어져 왔다. 그 중 아조벤젠(azobenzene)의 경우는 대표적인 광이성질체성 화합물로서 N=N 결합에 의해 연결된 두 개의 페닐 그룹을 포함하고 있으며, 자외선 조사 하에 트랜스(trans)형에서 시스(cis)형으로 변화될 수 있는 성질을 가지고 있다[2]. Hong, Y. et al.은 아조벤젠 계열의 화합물과 사이클로덱스트린의 호스트-게스트 상호작용을 이용하여 빛에 의해 조절된 약물전달을 위해 실리카 나노입자의 표면에 컨쥬게이션 하였다 (그림 2a)[3]. 이때, 아조벤젠 화합물은 가시광선 영역에서 트랜스형으로 구조가 변환되어 실리카 나노입자를 막고 있던 사이클로덱스트린을 바깥쪽으로 이동시켜 내부에 존재하는 약물을 효과적으로 방출시킬 수 있음을 확인하였다. 이러한 광이성질체화를 이용한 자극 감응성 약물전달 시스템의 중요한 이점은 이들 화합물이 약물 방출을 “on/off” 할 수 있는 스위치로서 역할을 할 수 있다는 것이다.
한편, Tong, R. et al.은 빛(특히 청색광)에 감응하여 친수성에서 소수성으로 전이되는 성질을 가지는 스피노피란(spiropyran)[4]과 지질을 혼합하여 나노캐리어의 크기가 조절되어 약물을 전달할 수 있음을 보고하였다 (그림 2b)[5]. 빛이 없을 때에는 약물의 방출이 최소화되었으며, 빛을 조사한 경우, 스피노피란과 지질의 소수성 결합이 강해짐에 따라 구조가 쪼그라들게(shrinkage) 되어 조절된 약물 방출이 가능하게 된다. 상기 가역적인 구조변화를 나타내는 화합물들을 이용하는 경우, 빛이 조사됨에 따라 원하는 부위에서 선택적인 약물 전달을 수행할 수 있게 된다.
그림 2. 빛에 의한 약물전달체의 구조적 변화를 이용한 약물전달시스템의 예시. (a) 광이성질체화성 화합물의 구조적 변화를 이용한 약물 전달[3]. (b) 빛에 의해 친수성/소수성의 전이를 유발하여 나노캐리어의 크기의 조절을 이용한 약물 전달[5].
3. 빛에 의한 약물전달체 구조의 분해를 이용한 약물전달시스템
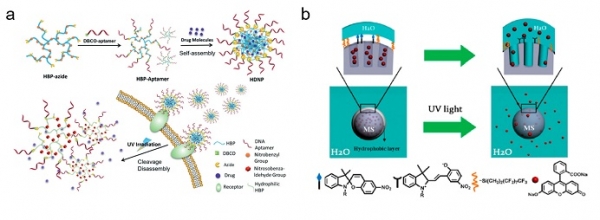
자외선을 포함한 에너지가 상대적으로 높은 빛의 경우에는 화합물의 구조를 분해시킬 수 있을 만큼 충분한 에너지를 가진다. 2-니트로벤질계(O-nitrobenzyl group)는 이러한 목적에 가장 부합하는 광 감응성 화합물로 알려져 있다[6,7]. 특히, 이러한 화합물은 빛에 의한 분해 이후에 생기는 부산물의 대부분이 생체적합성이 높은 물질들로 알려져 있기 때문에 약물전달시스템을 포함한 다양한 분야에서 널리 적용되고 있다. Lu, Y. et al.은 자외선 파장에 감응하는 2-니트로벤질 아크릴레이트로 개질 된 고분자 사슬을 이용하여 약물이 포함된 자가조립형 고분자 나노입자를 제조하였다(그림 3a)[8]. 이 구조는 자외선을 조사하였을 때, 구조의 깨짐이 발생하여 단량체로 분해될 수 있으며 원하는 시점에 효과적으로 약물을 방출할 수 있음이 보고되었다. 더 나아가 부산물을 포함한 화합물이 세포 내 독성을 야기하지 않음을 증명하였다.
하지만, 상기 예시와 같이 구조체의 전체적인 분해를 통해서만 약물 전달을 유도하는 것은 아니다. 약물전달체 표면에 존재하는 일부의 화학결합을 끊어줌으로써 역시 약물 전달이 가능하다. Linfeng, C. et al.은 실리카 나노입자의 표면을 소수성인 스피노피란 유도체로 개질 시켜 약물전달시스템에 적용하였고(그림 3b)[9], 자외선 조사에 의해 표면을 감싸고 있던 화합물의 구조가 일부 끊어지게 하였다. 이때, 입자의 표면이 친수성으로 변함으로써 안쪽에 내재되어 있던 약물이 수용액으로 쉽게 방출될 수 있었다.
상기에서 주로 활용된 자외선 영역의 빛은 피부 투과성이 낮으며 세포 손상을 유도할 수 있기 때문에 보다 긴 파장의 빛을 이용하는 방법이 최근 관심을 받고 있다. 특히 장파장의 빛을 흡수하여 단파장으로 전환시킬 수 있는 상향전환(upconversion) 특성을 갖는 구조체를 활용하는 사례가 보고되고 있다. 예를 들어, 란탄 계열의 원소로 도핑된 상향전환 나노입자, 삼중항-삼중항 소멸에 의한 빛 에너지의 상향전환을 유도하는 고분자 등을 사용하는 경우, 장파장의 빛을 흡수하여 약물전달체의 구조적 변형을 유도하여 약물 방출을 유발하는 전략도 최근 보고되었다[10,11].
그림 3. 빛에 의한 약물전달체의 구조적 깨짐을 이용한 약물전달시스템의 예시. (a) 빛에 감응하는 2-니트로벤질 아크릴레이트가 포함된 나노입자의 사용[8]. (b) 실리카 나노캐리어 표면에 접합된 빛에 의하여 친수성/소수성으로 전환 가능한 스피노피란의 이용[9].
4. 광열전환효과를 이용한 약물전달시스템
상기에서 거론한 광 감응성 성분을 포함하는 화합물을 이용하여 구조의 변화 혹은 분해가 가능한 나노캐리어를 제작하기 위해서는 정교한 입체화학에 대한 이해가 필요하다. 이에 덧붙여, 최근에는 빛을 흡수하면 국소적으로 열로 변환시킬 수 있는 나노물질뿐만 아니라 이를 열 감응성 소재 등과 접합시켜 활용하는 약물전달시스템이 보고되고 있다. 빛을 흡수하여 국소적인 열이 발생되는 현상을 광열전환(photothermal conversion)효과라고 하며, 자유전하가 풍부한 금속물질로 구성된 나노입자 혹은 유전체(예: 탄소로 구성된 저차원의 물질), 빛을 잘 흡수할 수 있는 고분자 등이 주로 사용되고 있다.
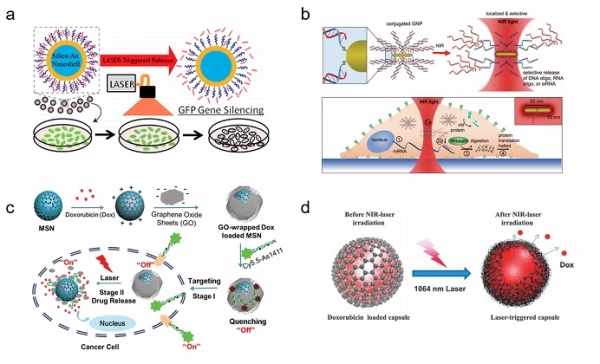
특히 생체 적합성이 뛰어난 금 나노입자의 경우 표면 플라즈몬 공명 현상에 의해 특정 파장의 빛을 흡수하여 입자 주변에 국소적인 열을 발생시킬 수 있다. 발생된 열은 금 나노입자에 컨쥬게이션된 화학적 결합을 변형시킬 수 있다. 가령, 빛을 이용하여 나노입자 주변의 온도를 올려줌으로써 입자 표면에 컨쥬게이션된 표적 유전체와 상보결합을 이루고 있는 수소결합을 끊어 단일 가닥을 효과적으로 방출할 수 있게 된다. Ryan, H. et al.은 표면이 금 나노입자로 둘러 싸여 있는 실리카 나노캐리어를 이용하여(그림 4a)[12], 빛(특히 근적외선 영역의 파장)을 조사했을 때 상보결합을 분해시켜 RNA 가닥을 세포 내부로 효과적으로 전달하는 안티센스 치료법에 대한 연구를 수행하였다. 이와 유사하게, Lee, S. E. et al.은 근적외선 영역의 빛을 흡수할 수 있는 금 나노막대 입자를 이용하여 siRNA를 원하는 시점에 전달할 수 있음을 보고하였다(그림 4b)[13]. 이 연구에서는 전달하고자 하는 siRNA와 상보적인 서열을 가지는 RNA 가닥이 결합된 금 나노막대 입자를 이용하여, 특정 파장의 빛에 의해 결합이 끊어지게 하여 유전자 침묵화(gene silencing)를 유도할수 있는 방법을 제시하였다.
또 다른 구조체로서, 탄소 기반의 물질은 빛을 광범위하게 흡수하기에 광열전환효과가 우수하다고 알려져 있다. 그 중 산화 그래핀은 근적외선 영역의 파장을 강하게 흡수하며, 이를 이용한 국소적인 열 발생이 가능하다고 알려져 있다[14]. 빛에 감응하는 약물전달시스템 개발을 위한 산화 그래핀은 대개 약물전달체의 표면을 코팅하는 제재로 사용되고 있다. 이 때, 산화 그래핀의 넓은 표면적 및 특이한 구조적 특성을 이용하여 약물 로딩 및 전달 효율을 높이는 데 적용될 수 있었다[15,16]. Yuxia, T. et al.은 실리카 나노캐리어의 표면을 정전기적 결합을 이용하여 산화 그래핀으로 코팅된 입자를 제조하였다(그림 4c)[17]. 실리카 표면에 코팅된 산화 그래핀을 세포에 내재화 시킨 후, 근적외선을 이용하여 산화 그래핀을 실리카 표면으로부터 분리시켜 내부에 로딩된 약물을 방출 시키는 방식이 가능함을 증명하였다. 한편, Rajendra, K. et al.은 산화 그래핀을 고분자의 다층박막적층법(layer-by-layer)으로 캡슐화를 이루는 캐리어를 보고하였다(그림 4d)[18]. 이 방법은 단순 적층을 통해 약물전달체를 쉽게 제작할 수 있다는 장점을 가진다.
그림 4. 광열전환효과를 이용하여 약물 전달이 가능한 금속 나노캐리어 및 탄소기반 물질에 대한 예시. (a) 금 나노입자가 표면에 코팅된 실리카 나노캐리어[12]. (b) 근적외선에 감응하는 금 나노막대 입자[13]. (c) 실리카 나노캐리어 표면에 코팅된 산화 그래핀[17]. (d) 산화 그래핀이 접합된 고분자 다층박막적층법으로 손쉽게 제조된 캡슐[18].
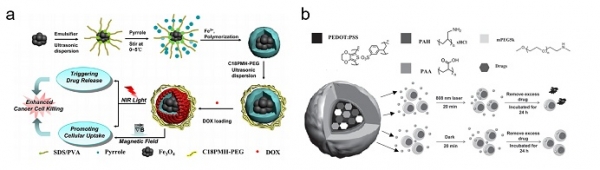
한편, 광열전환효과를 갖는 대표적인 물질인 금속 나노입자나 탄소기반 물질은 생분해성이 떨어지며 체내에 적용될 경우 머무름 시간(retention time)이 길다는 단점을 가지고 있다[19,20]. 그러므로 유기화합물을 기반으로 하고, 빛(특히 근적외선)에 감응하여 광열전환효과를 나타낼 수 있는 고분자 구조체에 대한 연구가 최근 활발히 수행되어지고 있다[21]. 이러한 유기화합물을 이용한 약물전달시스템은 근적외선 영역의 빛을 잘 흡수한다고 알려져 있는 폴리피롤(polypyrrole)이나 폴리아닐린(polyaniline), 폴리(3,4-에틸렌디옥시티오펜)-폴리스티렌술포네이트(PEDOT:PSS)와 같은 전도성 고분자 구조체가 대표적으로 사용된다[22,23,24]. 더 나아가 수용성을 높이기 위해 계면활성제 등을 도입하여 약물전달시스템에 적용되고 있다. Chao, W. et al.은 폴리피롤을 자성나노입자와 core-shell형 태로 제조하여 근적외선에 감응하는 약물전달시스템을 제안하였다(그림 5a)[25]. 이 때, 폴리피롤의 구조에 빛이 가해짐에 따라 국소적인 열이 발생하고, 이로 인해 느슨해진 구조로 부터 약물의 방출이 가능함을 제시하였다. 또한, Hua, G. et al.은 PEDOT:PSS이 포함된 나노캐리어를 제작하여 빛이 조사되었을 때 더욱 향상된 약물 전달 효율을 보일 수 있음을 보고하였다(그림 5b)[26]. 상기에 서술한 빛에 감응하여 광열전환효과를 나타내는 나노캐리어를 이용한 약물전달시스템은 약물 전달을 촉진시킬 뿐만 아니라 국소적인 열 발생으로 인한 열치료의 시너지 효과를 동시에 유도할 수 있기 때문에 최근에 많은 연구가 이루어지고 있다.
그림 5. 광열전환 특성이 있는 고분자 나노구조체를 적용한 약물 전달의 예시. (a) 폴리피롤을 이용하여 제조된 적외선 감응 나노캐리어[25]. (b) PEDOT:PSS가 포함되어 제조된 나노캐리어의 제조 및 약물 전달 매커니즘[26].
5. 결론 및 전망
빛에 감응하는 구조체를 이용한 약물전달시스템에 대한 연구는 다양한 접근 방법을 통해 발전되어 왔다. 특히, 빛이 가지는 높은 공간적, 시간적 분해능을 이용하여 더욱 정교하게 조절될 수 있는 약물 전달을 보여주는 연구들이 활발하게 진행되고 있다. 또한, 빛에 의해 발생하는 국소적인 열(광열전환효과)을 이용한 약물전달은 빛 감응성 구조의 단독 사용뿐만 아니라 열 감응성과 같은 다른 기능성을 갖는 소재와 접합하여 다중기능성을 갖는 약물전달체로 발전 가능하다. 이를 통해 복합 자극에 감응할 수 있는 구조체 및 더욱 광범위한 분야에 적용될 수 있는 소재 개발로의 확장을 기대할 수 있다. 최근에는 약물전달시스템뿐만 아니라, 화장품, 미용 산업 분야에도 빛을 이용한 기기들의 활용이 활기를 띠고 있어, 빛에 감응할 수 있는 소재에 대한 연구의 필요성이 증가하고 있다. 가까운 미래에 빛 또는 열에 감응하는 다양한 소재가 약물전달시스템 및 관련 분야의 제품 개발에 중요한 기술이 될 것으로 기대한다.
참고 문헌
[1] Jia, S.; Fong, W. K.; Graham, B.; Boyd, B. J., Photoswitchable molecules in long-wavelength light-responsive drug delivery: From molecular design to applications. Chem. Mater. 2018, 30, 2873-2887.
[2] Wang, K.; Yin, L.; Miu, T.; Zhao, Y.; Chen. Y.; Zhou, N.; Zhang, W; Zhu, X., Design and synthesis of a novel azobenzene-containing polymer both in the main-and side-chain toward unique photocontrolled isomerization properties. Mater. Chem. Front. 2018, 2, 1112-1118.
[3] Yan, H.; Teh, C.; Sreejith, S.; Zhu, L.; Kwok, A.; Fang, W.; Ma, X.; Nguyen, K. T.; Korzh, V.; Zhao, Y. Functional mesoporous silica nanoparticles for photothermal-controlled drug delivery in vivo. Angew. Chem. Inter. Ed. 2012, 51, 8373-8377.
[4] Kortekaas, L.; Browne, W. R. The evolution of spiropyran: fundamentals and progress of an extraordinarily versatile photochrome. Chem. Soc. Rev. 2019, 12, 3406-3424.
[5] Tong, R.; Chiang, H. H.; Kohane, D. S. Photoswitchable nanoparticles for in vivo cancer chemotherapy. Proc. Natl. Acad. Sci. U.S.A. 2013, 110, 19048-19053.
[6] Klán, P.; Solomek, T.; Bochet, C. G.; Blanc, A.; Givens, R.; Rubina, M.; Popik, V.; Kostikov, A.; Wirz, J. Photoremovable protecting groups in chemistry and biology: reaction mechanisms and efficacy. Chem. Rev. 2012, 113, 119-191.
[7] Zhao, H.; Sterner, E. S.; Coughlin, E. B.; Theato, P. o-Nitrobenzyl alcohol derivatives: opportunities in polymer and materials science. Macromolecules 2012, 45, 1723-1736.
[8] Yang, L.; Sun, H.; Liu, Y.; Hou, W.; Yang, Y.; Cai, R.; Cui, C.; Zhang, P.; Pan, X.; Li, X.; Li, L.; Sumerlin, B. S.; Tan, W. Selfassembled aptamer-grafted hyperbranched polymer nanocarrier for targeted and photoresponsive drug delivery. Angew. Chem. Inter. Ed. 2018, 57, 17048-17052.
[9] Chen, L.; Wang, W.; Su, B.; Wen, Y.; Li, C.; Zhou, Y.; Li, M.; Shi, X.; Du, H.; Song, Y.; Jiang, L. A light-responsive release platform by controlling the wetting behavior of hydrophobic surface ACS Nano 2014, 8, 744-751.
[10] Wu, S.; Butt, H. J. Near-infrared-sensitive materials based on upconverting nanoparticles. Adv. Mater. 2016, 28, 1208-1226.
[11] Wang, W.; Liu, Q.; Zhan, C.; Barhoumi, A.; Yang, T.; Wylie, R. G.; Armstrong, P. A.; Kohane, D. S. Efficient triplet–triplet annihilation-based upconversion for nanoparticle phototargeting. Nano Lett. 2015, 15, 6332-6338.
[12] Huschka, R.; Barhoumi, A.; Liu, Q.; Roth, J. A.; Ji, L.; Halas, N. J. Gene silencing by gold nanoshell-mediated delivery and lasertriggered release of antisense oligonucleotide and siRNA. ACS Nano 2012, 6, 7681-7691.
[13] Lee, S. E.; Liu, G. L.; Kim, F.; Lee, L. P. Remote optical switch for localized and selective control of gene interference. Nano Lett. 2009, 9, 562-570.
[14] Wang, J.; Zhang, G.; Zhang, P. Graphene-assisted photothermal effect on promoting catalytic activity of layered MnO2 for gaseous formaldehyde oxidation. Appl. Catal. B-Environ. 2018, 239, 77-85.
[15] Yang, K.; Feng, L.; Liu, Z. Stimuli responsive drug delivery systems based on nano-graphene for cancer therapy. Adv. Drug Deliv. Rev. 2016, 105, 228-241.
[16] He, Q.; Kiesewetter, D. O.; Qu, Y.; Fu, X.; Fan, J.; Huang, P.; Liu, Y.; Zhu, G.; Liu, Y.; Qian, Z.; Chen, X. NIR-responsive ondemand release of CO from metal carbonyl-caged graphene oxide nanomedicine. Adv. Mater. 2015, 27, 6741-6746.
[17] Tang, Y.; Hu, H.; Zhang, M. G.; Song, J.; Nie, L.; Wang, S.; Niu, G.; Huang, P.; Lu, G.; Chen, X. An aptamer-targeting photoresponsive drug delivery system using “off–on” graphene oxide wrapped mesoporous silica nanoparticles. Nanoscale 2015, 7, 6304-6310.
[18] Kurapati, R.; Raichur, A. M. Near-infrared light-responsive graphene oxide composite multilayer capsules: a novel route for remote controlled drug delivery. Chem. Commun. 2013, 49, 734-736.
[19] Khlebtsov, N.; Dykman, L. Biodistribution and toxicity of engineered gold nanoparticles: a review of in vitro and in vivo studies. Chem. Soc. Rev. 2011, 40, 1647-1671.
[20] Chen, Y. S.; Hun, Y. C.; Liau, I.; Huang, G. S. Assessment of the in vivo toxicity of gold nanoparticles. Nanoscale Res. Lett. 2009, 4, 858-864.
[21] Bertrand, O.; Gohy, J. F. Photo-responsive polymers: synthesis and applications. Polym. Chem. 2017, 8, 52-73.
[22] Chen, M.; Fang, X.; Tang, S.; Zheng, N. Polypyrrole nanoparticles for high-performance in vivo near-infrared photothermal cancer therapy. Chem. Commun. 2012, 48, 8934-8936.
[23] Yang, J.; Choi, J.; Bang, D.; Kim, E.; Lim, E. K.; Park, H.; Suh, J. S.; Lee, K.; Yoo, K. H.; K, E. K.; Huh, Y. M. Convertible organic nanoparticles for near-infrared photothermal ablation of cancer cells. Angew. Chem. Inter. Ed. 2011, 50, 441-444.
[24] Cheng, L.; Yang, K.; Chen, Q.; Liu, Z. Organic stealth nanoparticles for highly effective in vivo near-infrared photothermal therapy of cancer. ACS Nano 2012, 6, 5605-5613.
[25] Wang, C.; Xu, H.; Liang, C.; Liu, Y.; Li, Z.; Yang, G.; Cheng, L.; Li, Y.; Liu, Z. Iron oxide@ polypyrrole nanoparticles as a multifunctional drug carrier for remotely controlled cancer therapy with synergistic antitumor effect. ACS Nano 2013, 7, 6782-6795.
[26] Gong, H.; Cheng, L.; Xiang, J.; Xu, H.; Feng, L.; Shi, X.; Liu, Z. Near-infrared absorbing polymeric nanoparticles as a versatile drug carrier for cancer combination therapy. Adv. Funct. Mater. 2013, 23, 6059-6067.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update