| 고효율 면역 항암치료를 위한 생체재료의 활용 | |
|---|---|
| Date 2019-10-05 17:56:36 |
|

교수
차의과학대학교 의생명과학과
wrpark@cha.ac.kr
1. 서론
암은 심혈관 질환과 더불어 전 세계적으로 높은 사망률을 보이는 질환이다 [1]. 통계청 조사에 따르면 한국인의 사망률 1위는 암이다. 기존에는 외과적 수술, 방사선 치료, 화학 치료법을 통해 암을 치료하였다. 하지만 기존의 치료법들은 부작용이 심하고 재발과 전이와 같은 임상적 한계점이 있었다. 최근 면역 항암치료가 전 세계적으로 큰 관심을 받고 있다. 면역 항암치료는 우리 몸에 면역세포를 활성화해 암세포만을 공격하여 치료하는 최신 치료법이다 [2]. 면역 항암치료는 기존의 항암 치료법과는 달리 면역세포가 암세포만을 인지 시켜 치료하므로 부작용이 덜하고 암의 재발과 전이를 예방할 수 있다는 장점이 있다. 따라서 최근 임상에서 면역 항암치료를 표준 치료법으로 정해 난치성 암을 치료하는 데 활발히 활용하고 있다 [3]. 특히 최근 식약처(FDA) 승인된 면역관문억제제(immune check point inhibitors)는 흑색종, 비소 세포 폐암, 신장암, 호지킨 림프종, 방광암, 두경부암 치료에 사용되고 있어 큰 주목을 받고 있다. 하지만 면역 항암치료는 모든 암 환자에서 동일한 치료 효과를 얻기 힘들고 자가 면역질환을 유발할 수 있다는 문제점이 있다. 또한 면역 항암치료는 혈액암에서는 높은 효능을 보이지만 고형암에서는 치료 효과가 제한된다고 알려져 있다 [4].
생체재료는 의학적 목적으로 생체와 상호작용하는 재료들을 뜻한다. 지난 몇십 년간 생체고분자부터 금속까지 다양한 재질과 형태의 물질들이 생체재료로 개발됐으며 약물전달 및 조직 공학을 위해 사용되어왔다 [5, 6]. 최근 면역치료에서 기존의 한계점들을 개선하기 위하여 생체재료를 활용하려는 시도가 늘어나고 있다 [7, 8]. 본 서지에서는 최근 국내외에서 활발히 연구되고 있는 고효율 면역 항암치료를 위한 생체재료들의 활용에 관한 최신 연구 동향을 살펴보고자 한다.
2. 본론
2.1. 면역 항암치료 기본 메커니즘
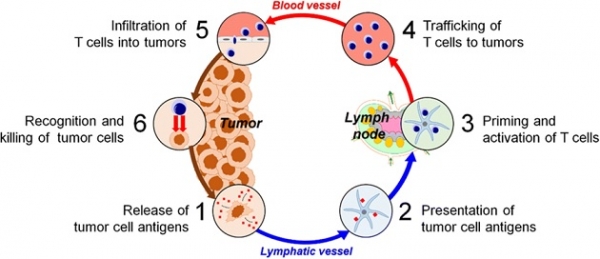
면역 항암치료를 위한 생체재료의 활용을 언급하기에 앞서 항암면역치료의 기본 메커니즘을 이해할 필요가 있다. 우리 몸에는 하루평균 300여 개 정도씩 암세포가 생겨나고 사라진다고 한다. 이는 우리 몸에 면역세포들이 암세포를 인지하고 사멸시키는 방어기전을 가지고 있음을 의미한다. 그 방어기전을 활성화해 암을 치료하는 것이 면역 항암치료의 기본원리이다. 암세포가 아포토시스(apoptosis) 또는 괴사(necrosis) 과정을 통해 사멸하면 종양에서 뿜어져 나온 종양 항원은 수지상 세포와 같은 항원 제시 세포에 의해 포획되어 주요 조직 적합성 복합체(MHC)에 제시된다(그림 1). 종양 항원을 세포 표면에 표지한 수지상 세포는 림프절로 이동하여 미성숙 T세포들을 활성화한다. 이렇게 활성화된 종양 특이적 세포독성 T림프구는 종양 부위로 침투하여 암을 인지하여 사멸시킨다. 이렇게 면역세포에 의해 사멸된 암세포는 더 많은 암 항원을 내놓게 되어 효과적인 항암 면역 반응을 유도하는 데 중요한 역할을 한다.
그림 1. 면역 항암치료 기본 메커니즘. 종양 세포로부터 방출된 종양 항원은 항원 제시 세포(APC)에 의해 인식된다. 성숙한 APC는 림프절로 이동하여 T세포의 활성화 및 증식을 유도한다. APC에 의해 활성화된 T세포는 종양 조직으로 이동하여 종양 세포를 사멸한다. 다시 사멸된 암세포의 종양 항원은 또 다른 라운드의 면역 반응을 촉발하여 암 면역 주기를 지속하게 한다. 본 그림은 참고문헌[7]에서 발췌함.
하지만 암세포가 사멸하면서 분비하는 다양한 면역 억제성 사이토카인은 면역세포의 활성화를 방해하기도 한다. 암세포에서 분비된 화학 유도물질들은 종양 내에서 단핵구들을 종양 관련 대식세포(tumor-associated macrophages, TAMs)로 분화 시켜 종양 성장을 촉진하고 면역 감시를 회피하게 한다 [9]. 골수-유래 억제 세포(myeloid-derived suppressor cells, MDSCs)의 종양 내 침윤은 항염증성 사이토카인을 분비하여 면역 억제 조절 T세포(Tregs cells)를 활성화해 수지상세포의 성숙을 방해한다 [10]. 설상가상으로 종양세포는 PD-L1 또는 PD-L2과 같은 면역 억제 분자를 발현하여 세포독성 T세포를 무력화시킨다 [11]. 이러한 현상들은 종양 미세환경에서 일어나는 특이적인 생물학적 현상들이며 이 문제들을 극복하기 위해 최근 다양한 생체재료들이 활발히 개발되고 있다.
2.2. 생체재료기반 나노입자를 통한 면역 항암치료
앞에서 언급한 것처럼 효과적으로 항암 면역반응을 유도하기 위해서는 종양 항원이 항원 제시 세포로 안전하게 전달되어야 한다. 천연 종양 항원은 체내 효소에 의해 쉽게 분해되며, 면역 세포로 전달되는 효율이 낮기 때문에 면역원성이 제한된다. 이와 관련하여 전통적으로 약물전달 분야에서 사용되었던 생체재료기반 나노입자를 종양 항원의 전달체로 사용하려는 시도가 활발하다. 나노입자는 두 가지 주목할만한 장점이 있다. 첫째 나노입자는 생체 내 분해효소로부터 종양 항원을 보호할 수 있다. 둘째 나노입자는 항원을 선택적으로 림프절로 전달할 수 있다. 항원을 림프절로 효과적으로 전달할 수 있는 나노입자를 설계하기 위해서는 입자의 크기, 표면 전하, 형태 및 소수성 정도를 적절히 조절할 필요가 있다. 최근 연구에 따르면 약 20~45 nm 크기의 나노입자가 림프관에 효과적으로 전달되는 것이 확인되었다[12, 13]. 일반적으로 입자크기가 너무 작으면(<5 nm) 체외로 빠르게 배출되고 너무 크면(>100 nm) 세포외기질(ECM)에 갇힐 수 있어 전달 효율이 감소한다. 입자 표면 전하 또한 입자의 면역세포 내 전달에 큰 영향을 미칠 수 있다. 일반적으로 양전하로 하전된 나노입자가 음전하를 띄는 세포막과 잘 결합하여 효과적으로 세포 내로 전달될 수 있기 때문에 높은 면역반응을 기대할 수 있다. 하지만 양이온성 나노입자는 적혈구 용혈 및 혈소판 응집을 유발할 수 있기 때문에 부작용을 일으킬 수 있다. 입자 형태는 나노입자의 림프절 배출에 영향을 미치는 또 다른 중요한 요소이다. 막대 형태를 보이는 나노입자는 구 형태보다 전신 혈액 내 순환 시간이 길고, 종양 내로 침투 효율이 높다고 알려져 있다 [14,15]. 끝으로 PLGA와 같은 소수성 도메인을 포함하는 고분자 나노입자는 그 자체로 면역 애쥬번트 역할을 할 수 있다고 알려져 있다 [16, 17]. 따라서 다양한 크기, 전하, 형태, 소수성을 갖는 생체재료기반 나노입자를 면역 항암치료에 적용하려는 시도가 활발한 실정이다 [18].
2.2. 생체재료기반 지지체(scaffolds)를 통한 면역 항암치료
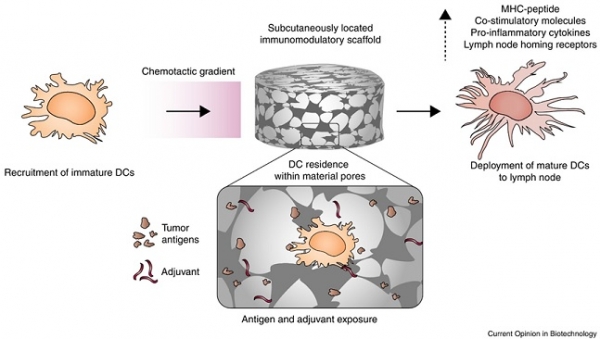
기존 조직공학에서 세포의 성장과 분화를 위해 사용되던 생체재료기반 지지체가 최근에는 면역 항암치료에서도 활용되고 있다. 최근 생체 내 이식되어 수지상 세포 기반 항암 백신 기능을 할 수 있는 면역 조절인자들을 포함한 고분자 지지체가 개발되었다(그림 2) [19, 20]. 다공성 생체재료 지지체는 암 항원, 과립구 대식세포 콜로니 자극인자(GM-CSF) 및 면역 애쥬번트(CPG)를 포함하고 있으며 기존의 조직공학에서 사용되던 지지체와 유사한 형태를 띠고 있다. 콜로니 자극인자를 통해 다수의 수지상세포를 지지체 내부로 유입을 유도하고 암 항원과 면역 애쥬번트에 노출해 수지상세포를 성숙시킬 수 있다. 생체재료 면역 지지체의 종양 치료 효능을 평가하기 위한 비 임상 동물실험으로 면역원성이 낮아 치료가 어렵다고 알려진 B16-F16 흑색종 생쥐 모델이 이용되었다. 면역 활성 지지체를 2회 접종하였을 때 세포독성 T세포를 활성화해 종양 모델의 생존율을 50% 향상했다. 현재 이 기술은 미국에서 진행한 임상시험(NCT01753089)에서 환자에 적용 가능한 안전한 기술로 평가받고 있다. 하지만 기존 지지체는 외과적 수술을 통해 림프절 주변에 이식해야 되는 큰 불편함이 있었다. 따라서 최근에는 주사기로 주입 가능한 면역 활성 지지체가 개발되고 있다. 높은 표면적을 갖는 다공성 실리카 나노막대는 종양 항원과 애쥬번트를 봉입할 수 있으며 주입과정에서 자가조립되어 항원 제시 세포들이 유입될 수 있는 공간을 제공할 수 있다 [21]. 이러한 기술은 환자가 외과적 수술 없이도 주입이 가능하기 때문에 환자들의 편의성을 크게 높일 수 있다는 장점이 있다. 현재 전 세계적으로 보다 효과적인 항암면역 활성을 유도하기 위해 현재 다양한 항원 또는 면역 애주번트가 이러한 생체재료기반의 지지체 기술에 도입되어 시험 되고 있다 [22-24].
그림 2. 항암 면역치료를 위한 생체재료기반 다공성 지지체. 피하로 이식된 다공성 생체재료 지지체는 화학 유인 물질을 방출하여 공극 내부로 미성숙 수지상 세포를 모집한다. 지지체 내부에 들어온 수지상세포는 종양 항원 및 면역 애쥬번트에 노출되어, 주요 조직 적합성 복합체(MHC-펩타이드)를 발현하고 성숙한다. 성숙한 수지상 세포는 지지체로부터 림프절로 이동하여 항종양 면역반응을 자극한다. 본 그림은 참고문헌[8]에서 발췌함.
2.3. 생체재료를 통한 면역세포 엔지니어링
생체재료는 면역세포치료제의 개발에도 활용될 수 있다. 입양면역치료(adaptive immunotherapy, AIT)는 환자의 면역세포를 꺼내 활성화, 증식 또는 유전자 조작하여 환자의 몸에 다시 주입하여 암을 치료하는 원리이다. 최근 키메라 항원 수용체(chimeric antigen receptor, CAR) 발현 T세포 치료제는 ‘살아있는 약물’이라고 불리며 악성 혈액암에서 탁월한 효과를 보인다. 하지만 유방암, 폐암과 같은 고형암에서 면역세포 치료제는 종양 조직이 분비하는 면역 활성 억제 인자들을 포함하는 종양 미세환경(tumor microenvironment, TME)으로 인해 면역세포치료제의 치료 효율이 제한적이다. 최근 생체재료 지지체를 이용하여 CAR T세포를 종양이 절제된 부위에 이식하여 우수한 치료 효과를 보였다[25]. 다공성 알긴산 지지체는 세포의 접착을 증진하기 위해 인테그린 리간드가 부착되었으며 면역 자극성 항체들(anti-CD3, CD28, 및 CD137)이 수식된 미립자와 T-세포의 증식을 유도하는 수용성 자극인자인(IL-5 superagonist)를 포함하였다. 기능성 지지체를 통한 T세포의 이식은 대조군보다 100배 이상 T세포의 증식을 향상했다. 결과적으로 유방암 및 난소암 비 임상 모델에서 암 치료 능을 크게 향상할 수 있었다. 체외 배양한 면역세포가 암세포를 효과적으로 공격할 수 있도록 유전적으로 엔지니어링하는 기술 또한 매우 중요하다. 우리 몸에 존재하는 자연살해(NK) 세포는 외부 병원균에 감염된 세포나 암세포를 선택적으로 인식하여 파괴하는 선천면역을 담당하는 세포이다. T세포와 달리 면역거부반응이 적고 건강한 사람의 세포를 환자에게 이용할 수 있다는 이점이 있다. 이러한 자연살해 세포에 암세포를 표적화 할 수 있는 키메라 항원 수용체를 도입하여 암세포에 대한 공격력을 향상하려는 연구가 활발하다. 하지만 자연살해세포의 자체 방어기전 때문에 외부 유전자를 도입하는 것은 어렵다. 또한 기존 바이러스를 이용해 면역세포에 유전자를 전달하는 방식은 바이러스의 유전자가 삽입될 수 있어 안전성 측면에서 문제가 될 수 있다. 따라서 최근 생체 재료기반 기능성 나노입자를 이용하여 자연살해 세포를 엔지니어링 할 수 있는 기술이 개발되었다 (그림 3) [26]. 기능성 나노입자는 효과적으로 유전자를 면역세포에 전달하여 면역세포의 항암 활성을 크게 증진 시킬 뿐만 아니라 표지자 역할을 할 수 있어 형광 또는 자기공명영상(MRI)을 통해 엔지니어링된 면역세포를 생체 내에서 추적할 수 있게 하였다. 실제 유방암 생쥐모델에서 종양 성장 억제 능을 살펴본 결과 종양 크기가 대조군보다 약4배 감소하는 것이 확인되었다. 본 기능성 나노입자가 면역세포에서 우수한 유전자 전달 능의 물리 화학적 원리를 파악하기 위해 현재 연구 진행 중이다.
3. 결론 및 전망
최근 면역항암제의 안전성과 효과를 극대화 하기 위해 다양한 생체재료가 활용되고 있다. 생체재료는 종양 항원, 면역 애쥬번트 또는 면역세포를 효과적으로 생체 내로 전달하여 항암 면역기전을 활성화할 수 있다. 결과적으로 생체재료를 통한 면역 항암치료는 기존의 면역치료와 비교하여 암세포 특이적인 면역반응을 강화해 암 치료 효과를 크게 개선하고 부작용은 감소시킬 수 있다는 이점이 있다. 생체재료에 기반한 면역항암제를 최적화하기 위해서는 생체재료의 물리 화학적 성질과 항암 면역 반응 간의 상호 연관성에 대한 보다 많은 연구가 필요할 것으로 보인다. 따라서 혁신적인 차세대 면역 항암치료제를 개발하기 위해서는 의공학자, 면역학자, 임상의 간 협업의 중요성이 날로 커지고 있다.
참고문헌
[1] R.L. Siegel, K.D. Miller, A. Jemal, Cancer statistics, 2019, CA: a cancer journal for clinicians 69(1) (2019) 7-34.
[2] J. Banchereau, K. Palucka, Immunotherapy: Cancer vaccines on the move, Nature reviews Clinical oncology 15(1) (2018) 9.
[3] M.A. Postow, M.K. Callahan, J.D. Wolchok, Immune checkpoint blockade in cancer therapy, Journal of clinical oncology 33(17)(2015) 1974.
[4] I. Melero, A. Rouzaut, G.T. Motz, G. Coukos, T-cell and NK-cell infiltration into solid tumors: a key limiting factor for efficacious cancer immunotherapy, Cancer discovery 4(5) (2014) 522-526.
[5] O.S. Fenton, K.N. Olafson, P.S. Pillai, M.J. Mitchell, R. Langer, Advances in biomaterials for drug delivery, Advanced Materials 30(29) (2018) 1705328.
[6] E.S. Place, N.D. Evans, M.M. Stevens, Complexity in biomaterials for tissue engineering, Nature materials 8(6) (2009) 457.
[7] W. Park, Y.-J. Heo, D.K. Han, New opportunities for nanoparticles in cancer immunotherapy, Biomaterials research 22(1) (2018) 24.
[8] S.T. Koshy, D.J. Mooney, Biomaterials for enhancing anti-cancer immunity, Current opinion in biotechnology 40 (2016) 1-8.
[9] M. Santoni, S. Cascinu, C.D. Mills, Altering macrophage polarization in the tumor environment: the role of response gene to complement 32, Cellular & molecular immunology 12(6) (2015) 783.
[10] D. Lindau, P. Gielen, M. Kroesen, P. Wesseling, G.J. Adema, The immunosuppressive tumour network: myeloid‐derived suppressor cells, regulatory T cells and natural killer T cells, Immunology 138(2) (2013) 105-115.
[11] S. Ostrand-Rosenberg, Tolerance and immune suppression in the tumor microenvironment, Cellular immunology 299 (2016) 23-29.
[12] S.T. Reddy, A. Rehor, H.G. Schmoekel, J.A. Hubbell, M.A. Swartz, In vivo targeting of dendritic cells in lymph nodes with poly (propylene sulfide) nanoparticles, Journal of Controlled Release 112(1) (2006) 26-34.
[13] S.T. Reddy, A.J. Van Der Vlies, E. Simeoni, V. Angeli, G.J. Randolph, C.P. O'Neil, L.K. Lee, M.A. Swartz, J.A. Hubbell, Exploiting lymphatic transport and complement activation in nanoparticle vaccines, Nature biotechnology 25(10) (2007) 1159.
[14] E. Carboni, K. Tschudi, J. Nam, X. Lu, A.W. Ma, Particle margination and its implications on intravenous anticancer drug delivery, Aaps Pharmscitech 15(3) (2014) 762-771.
[15] F. Gentile, C. Chiappini, D. Fine, R. Bhavane, M. Peluccio, M.M.-C. Cheng, X. Liu, M. Ferrari, P. Decuzzi, The effect of shape on the margination dynamics of non-neutrally buoyant particles in two-dimensional shear flows, Journal of biomechanics 41(10) (2008) 2312-2318.
[16] J. Park, J.E. Babensee, Differential functional effects of biomaterials on dendritic cell maturation, Acta biomaterialia 8(10) (2012) 3606-3617.
[17] Y. Min, K.C. Roche, S. Tian, M.J. Eblan, K.P. McKinnon, J.M. Caster, S. Chai, L.E. Herring, L. Zhang, T. Zhang, Antigen-capturing nanoparticles improve the abscopal effect and cancer immunotherapy, Nature nanotechnology 12(9) (2017) 877.
[18] H.Y. Yoon, S.T. Selvan, Y. Yang, M.J. Kim, D.K. Yi, I.C. Kwon, K. Kim, Engineering nanoparticle strategies for effective cancer immunotherapy, Biomaterials 178 (2018) 597-607.
[19] O.A. Ali, N. Huebsch, L. Cao, G. Dranoff, D.J. Mooney, Infection-mimicking materials to program dendritic cells in situ, Nature materials 8(2) (2009) 151.
[20] O.A. Ali, D. Emerich, G. Dranoff, D.J. Mooney, In situ regulation of DC subsets and T cells mediates tumor regression in mice, Science translational medicine 1(8) (2009) 8ra19-8ra19.
[21] J. Kim, W.A. Li, Y. Choi, S.A. Lewin, C.S. Verbeke, G. Dranoff, D.J. Mooney, Injectable, spontaneously assembling, inorganic scaffolds modulate immune cells in vivo and increase vaccine efficacy, Nature biotechnology 33(1) (2015) 64.
[22] O.A. Ali, C. Verbeke, C. Johnson, R.W. Sands, S.A. Lewin, D. White, E. Doherty, G. Dranoff, D.J. Mooney, Identification of immune factors regulating antitumor immunity using polymeric vaccines with multiple adjuvants, Cancer research 74(6) (2014) 1670-1681.
[23] H. Phuengkham, L. Ren, I.W. Shin, Y.T. Lim, Nanoengineered Immune Niches for Reprogramming the Immunosuppressive Tumor Microenvironment and Enhancing Cancer Immunotherapy, Advanced Materials (2019) 1803322.
[24] H. Phuengkham, C. Song, S.H. Um, Y.T. Lim, Implantable Synthetic Immune Niche for Spatiotemporal Modulation of Tumor‐Derived Immunosuppression and Systemic Antitumor Immunity: Postoperative Immunotherapy, Advanced Materials 30(18)(2018) 1706719.
[25] S.B. Stephan, A.M. Taber, I. Jileaeva, E.P. Pegues, C.L. Sentman, M.T. Stephan, Biopolymer implants enhance the efficacy of adoptive T-cell therapy, Nature biotechnology 33(1) (2015) 97.
[26] K.-S. Kim, J.-H. Han, J.-H. Park, H.-K. Kim, S.H. Choi, G.R. Kim, H. Song, H.J. An, D.K. Han, W. Park, Multifunctional nanoparticles for genetic engineering and bioimaging of natural killer (NK) cell therapeutics, Biomaterials (2019) 119418.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update