| 페이퍼 기반 바이오센서 기술개발 동향 | |
|---|---|
| Date 2017-03-29 15:27:41 |
|

교수
광주과학기술원 화학과
mkim@gist.ac.kr
1. 서론
바이오센서는 바이오리셉터와 신호변환기술이 결합되어 특정 물질을 분자 수준에서 선택적으로 측정하고 분석할 수 있도록 구성된 분석소자이다[1]. 항체, 효소, 압타머, 세포 등 바이오리셉터는 분석하고자 하는 물질을 선택적으로 인식하는 역할을하고, 신호변환기술은 바이오리셉터가 검지하고자 하는 표적물질과 반응하거나 결합시에 발생하는 변화와 그 정도를 감지하여 사람이 인식할 수 있는 신호로 변환한다.
바이오센서는 의료, 식품, 환경, 군사 등 매우 다양한 분야에서 활용되고 있으며, 이 중 특히 병원에서의 질병과 감염 진단, 가정에서의 혈당 자가진단에 가장 많이 활용되고 있다.
최근 바이오센서를 개발하는 연구자라면 중요하게 고려해야 할 키워드 중 하나가 바로 현장진단(Point-of-care testing)과 자가진단(Self-diagnostic or Homediagnostics)일 것이다. 현장진단과 자가진단 제품은 세계 바이오센서 시장 매출의 60% 이상을 차지하고, 12% 이상의 지속적인 연평균 성장률을 보이고 있다[2]. 기존의 바이오센서는 고가의 분석 장비와 전문 지식을 갖춘 인력을 필요로 하여 신속한 진단을 위한 물리적 접근성이 상대적으로 제한적이었다. 그러나 현장진단 또는 자가진단 바이오센서 기술은 환자나 사용자가 있는 장소에서 신속한 진단을 목표로 하여, 미량의 샘플을 이용한 간단한 방법으로 검사가 진행되고 육안이나 휴대용 분석 기기로 신속한 결과판독이 가능하다.
페이퍼 기반 바이오센서는 종이 또는 이와 유사한 물질 위에 진단 반응 시스템을 구현하는 기술로서 원재료인 종이의 특성상 저렴하고, 간편하고, 대량생산에 용이하다.
무엇보다 종이 재질은 수용액이 모세관 현상에 의해 자연적으로 흐르는 특징이 있어서 분석에 매우 유리한 장점을 가진다. 이러한 점에서, 페이퍼 기반 바이오센서는 현장진단기술의 필요조건을 이상적으로 충족시키는 매력적인 기술이다. 전통적인 페이퍼 기반 바이오센서는 대표적으로 면역크로마토그래피 스트립(예, 임신 진단키트, 말라리아 진단키트)과 Dip stick(예, 요검사 시험지) 등이 있고, 1970년대 중반 이후로 상용화되어 사용되고 있다.
2007년 미국 하버드 대학의 G.M. Whitesides 그룹에 의해 미세유체페이퍼기반 분석소자기술(microfluidic-paper based analytical devices, μPADs)로 구체화되어 연구가 시작되었고[3], 최근에는 단일 페이퍼 소자 내에서의 다중진단과 고감도 진단을 위한 기술 개발이 세계적으로 활발하게 이루어지고 있다. 페이퍼 기반 바이오센서는 페이퍼 내 유체 흐름을 제어하고 기능을 부여하기 위한 패터닝(Patterning) 기술과 단일 페이퍼 소자 내에서 면역반응이나 효소 발색반응 등을 측정하는 센싱(Sensing) 기술이라는 두 개의 큰 축으로 나눌 수 있다. 본고에서는 현재까지 보고된 주요 다중진단을 위한 페이퍼 패터닝 기술과 고감도 검출을 위한 페이퍼 기반 바이오센싱 기술에 대해 정리하고 앞으로의 페이퍼 기반 바이오센서의 개발 방향에 대해 논의하고자 한다.
2. 페이퍼 기반 바이오센서 기술개발 동향
2.1 다중진단을 위한 페이퍼 패터닝 기술
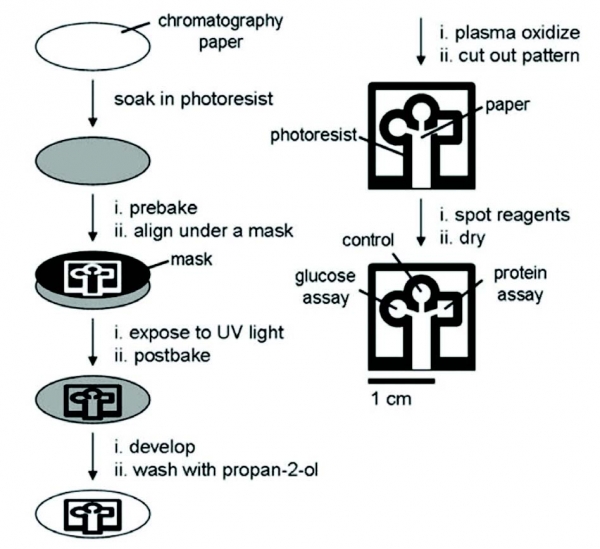
패터닝을 이용한 페이퍼기반 바이오센서 연구는 2007년 미국 하버드 대학의 G. M. Whitesides 그룹에서 페이퍼 기반의 센서 플랫폼을 사용하여 바이오물질을 최초로 검출한 것으로부터 시작되었다(그림 1). 이 연구진은 감광성 고분자를 종이에 얇게 코팅하여 포토마스크로 종이 표면을 가린 다음, 자외선을 조사하여 원하는 모양으로 종이를 패터닝 하였다. 이를 통해 유체가 흐를 수 있는 친수성 부분과 그 부분을 둘러싼 소수성 부분으로 이루어진 초기의 페이퍼 칩을 디자인하고 글루코오스와 BSA 단백질을 동시 검출하였다.

그림 1. 포토리소그래피 공정을 이용한 페이퍼 패터닝 방법과 패터닝된 페이퍼 칩에서의 바이오물질 검출[3]
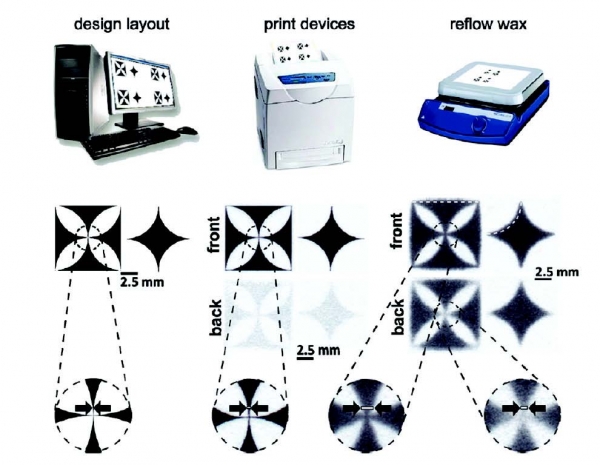
이후, Whitesides 그룹은 페이퍼 칩 플랫폼을 바이오센서로 사용하기 위하여, 왁스 프린터를 사용하여 페이퍼 칩 제작 공정을 간소화 하였으며 보다 간편하면서도 저비용의 방법으로 페이퍼 칩을 패터닝하였다(그림 2).
그림 2. 왁스프린터를 이용한 패터닝 방법과 이를 통해 구현된 페이퍼 센서[4]
위 논문이 보고된 이후, 왁스프린터를 사용한 패터닝 방법이 페이퍼 칩 개발에서 현재 가장 많이 이용되고 있다. 그러나, 왁스 프린팅 시, 종이 및 멤브레인에 가해지는 압력과 열로 인해 패터닝 이후 페이퍼의 구조가 변하여 원재료 고유의 특성이 변하는 문제가 발생하였고, 최근 이러한 한계점을 극복하기 위해 새로운 패터닝 방법을 개발하거나 페이퍼 기반의 새로운 센싱 플랫폼을 만드는 방향으로 연구가 진행되고 있다.
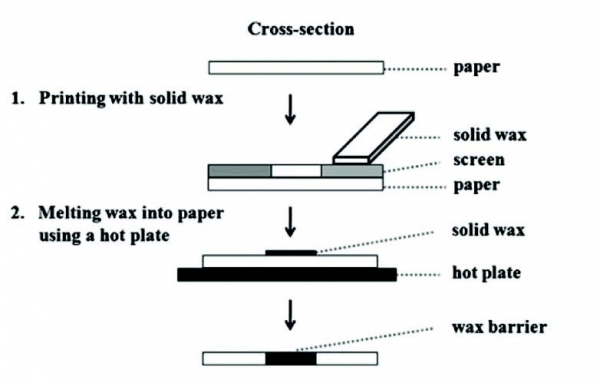
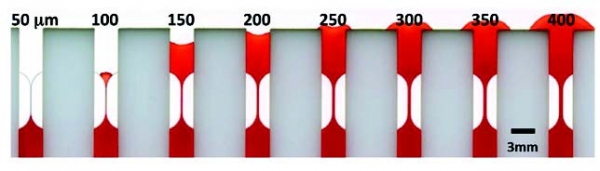
태국 출랄롱코른 대학 연구팀은 스크린프린팅 기법을 이용하여 고체 왁스를 종이 필터 위에 코팅한 후 고온에서 왁스를 녹여냄으로써, 친수성 구간과 왁스가 녹아 형성된 소수성 구간을 만들어 종이에서 유체의 흐름을 유도 및 제어할 수 있는 채널을 생성하였다(그림 3-a). 호주 Monash 대학의 Wei Shen 그룹은 종이의 주 구성물질인 셀룰로오스의 구조를 Alkyl and alkenyl ketene dimers(AKD)로 변형시킴으로써, 페이퍼 센서 내에서 원하는 패턴 모양에 따라 친수성 구간과 소수성 구간을 구획하는 기술을 개발하였다(그림 3-b). 한편, 미국 워싱턴 대학의 E Fu 그룹은 이산화탄소 레이저를 사용하여, 원하는 모양의 페이퍼 구조를 제작하는 기술을 발표하기도 하였다. (그림 3-c).
(a)
(b)
그림 3. 새로 제시된 다양한 패터닝 방법. (a) 왁스 스크린프린팅 기법을 이용한 페이퍼 칩 제작방법[5], (b) AKD와 마스크를 이용한 6-채널의 멤브레인 패터닝[6], (c) CO2 레이저로 패터닝 된 종이에서 볼륨 대비 유체흐름 관찰[7]
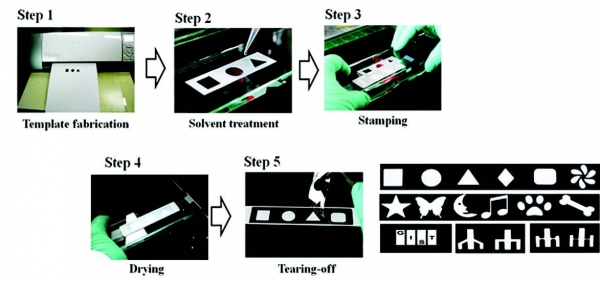
2015년 본 연구팀에서는 패터닝 과정에서 페이퍼 멤브레인 원재료의 손상을 최소화할 수 있는 tear-off 멤브레인 패터닝 기술을 개발하였다(그림 4).
Tear-off patterning 방법은 craft cutter를 이용하여 A4 페이퍼 틀을 가공하고 유기용매에 적신 후, 멤브레인에 접촉하여 건조 후 떼어내는 공정을 통해 센서 제작 시 사용되는 멤브레인 영역의 손상을 최소화 한다. 또한 이 기술은 다양한 모양으로 멤브레인 패터닝이 가능하여 대량생산 전 실험실 단계에서의 설계와 사전 테스트에 유용하다.
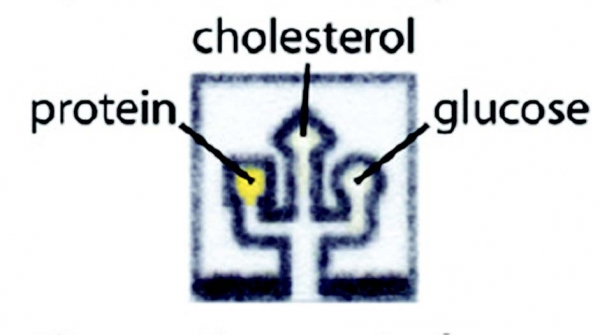
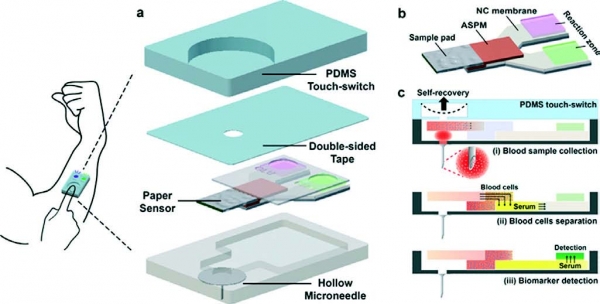
이 기술은 연세대학교 정형일 교수팀이 개발한 마이크로 니들 챔버와 결합되어, 혈액을 이용한 다중 진단 페이퍼 센서로 개발되었다(그림 5). 마이크로 니들을 통하여 주입된 혈액의 흡수, 분리, 이송이 단일 페이퍼 센서에서 순차적으로 이루어지고, tear-off 패터닝을 통해 두 구간으로 구획된 페이퍼 멤브레인 상에서 글루코오스와 콜레스테롤이 동시에 측정되었다.
그림 5. 마이크로 니들과 결합한 페이퍼 센서의 구조 및 작동원리 개념도[9]
2.2 고감도 검출을 위한 페이퍼 기반 바이오센서 기술
상용화된 대표적인 페이퍼 기반 바이오센서인 면역크로마토그래피 센서는 값싸고, 빠르고, 편리하지만 낮은 감도로 인해 고감도 검출이 필요한 표적물질을 적용하는데 어려움을 겪어왔다. 이에 면역반응 후 추가 반응을 통해 센서의 신호를 증폭하여 감도를 향상시키는 방법들이 대안기술로 제시되었으나, 전통적인 면역 크로마토그래피 센서의 구조만으로는 면역반응 후 신호증폭반응이 자동으로 유도되도록 하는데 어려움이 있었다. 이를 극복하기 위해 최근 국내외 연구진들은 페이퍼 패터닝 기술이나 기능성고분자를 도입하여 페이퍼 센서 내에서 혼합, 유속조절, 밸브, 전처리, 물질분리 등이 가능하도록 하였고, 이를 단일 페이퍼 기반 바이오센서 내에서 신호증폭을 위한 단계반응을 자동화하는 기술에 응용하고 있다.
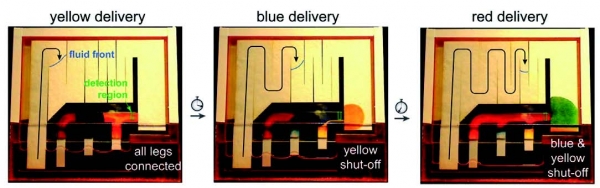
미국 워싱턴 대학의 Paul Yager 연구팀은 페이퍼 패터닝 기술을 사용해 시간에 따라 유체의 흐름을 제어하는 연구를 진행하여, 순차적인 반응을 단일 페이퍼 칩 상에서 구현하였다(그림 6).
그림 6. 페이퍼 페터닝에 의한 페이퍼 칩 내에서의 유체의 순차적 흐름 제어[10]
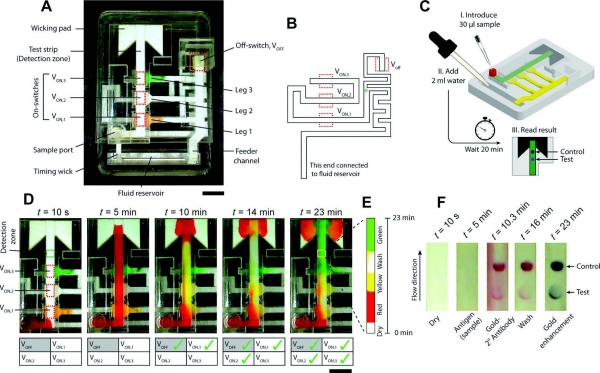
또한, Yager 그룹은 멤브레인 간의 연결과 단절을 스폰지로 조절하거나 멤브레인의 길이 조절을 통하여 면역 반응 이후에 자동으로 감도 향상을 위한 시료처리가 가능한 센서를 개발하고 이를 이용하여 말라리아를 검출하였다(그림 7.)
그림 7. 멤브레인 연결 및 단절을 이용한 센서의 모식도 및 말라리아 검출[11]
한국기초과학지원연구원 권요셉 연구팀에서는 왁스프린팅한 멤브레인들을 3차원으로 적층하여 면역 반응이 진행된 후 권요셉 연구팀에서는 왁스프린팅한 멤브레인들을 3차원으로 적층하여 면역 반응이 진행된 후 감도 향상을 위한 금 이온 환원 증폭 반응의 시료들이 방출되는 스트립 센서를 개발하였다 (그림 8).
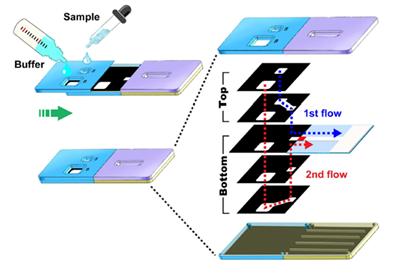
그림 8. 적층 형태의 페이퍼 기반 바이오센서 모식도[12]
본 연구팀에서는 물에 닿으면 팽창하는 성질을 가진 수 팽창성 테이프를 기존 면역크로마토그래피 구조에 응용하여, 유체 흐름에 따라 다양한 화학 반응이 자동으로 일어날 수 있는 시스템을 개발하였다 (그림 9). 이 센서는 단 한번의 시료 주입만으로도 센서의 감도를 향상 시킬 수 있어 편리하고, 제작비용 또한 저렴하다는 장점을 가진다.
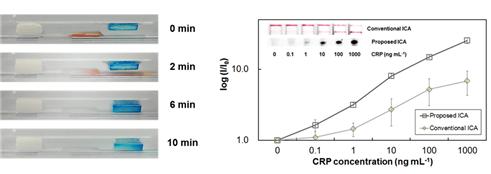
그림 9. 수 팽창성 테이프를 이용한 자동 순차반응이 가능한 면역 크로마토그래피 센서의 작동 사진 및 CRP 검출 그래프[18]
결론
페이퍼 기반 바이오센서는 바이오리셉터의 고정화, 자연 유체이동, 고체물질의 여과, 대량생산성 등 여러 면에서 바이오센서로서 장점을 가지고 있다. 여기에 다양한 멤브레인, 패드를 패터닝하고, 적층하여 랩온어칩과 유사한 랩온페이퍼 기술로 발전하고 있다. 건강에 대한 관심의 증가, 인구의 고령화 등의 이유로 바이오센서 시장의 규모가 점점 증가하고 있고, 이에 따라 저렴하면서 사용하기 쉬운 현장진단, 자가진단용 바이오센서에 대한 요구 또한 늘어나고 있다. 특히 현재의 현장진단용 바이오센서가 사물인터넷(Internet of Things, IoT)과 결합한 새로운 개념의 스마트 바이오센서의 필요성과 요구는 더욱 증가할 것으로 보인다. 이와 같은 스마트 바이오센서 기술에서 요구하는 소형화, 측정의 간편화 등을 만족하기 위하여 페이퍼 기반의 바이오센서의 연구가 중요할 것이다. 보다 정밀한 고성능의 페이퍼 기반의 바이오센서가 실제 현장에서 사용되고 상용화가 가능하기 위해서는 바이오리셉터 설계, 비특이 결합이 없는 센서 표면기술, 고안성/고선택성 바이오리셉터 고정화 기술, 재현성이 높은 나노소재 기반 센서소자의 결합, 대량생산공정 개발 등의 융복합 연구가 중요할 것으로 사료된다.
[1] Turner A, Karube I and Wilson GS (Eds.), Biosensors: Fundamentals and Applications (1ed.). Oxford, New York: Oxford University Press, 1987
[2] Frost & Sullivan, Analysis of the Global Biosensors Market, 2015
[3] Martinez AW, Phillips ST, Butte MJ and Whitesides GM. Angew. Chem. Int. Ed., 2007, 46, 1318-1320
[4] Carrilho E, Martinez AW and Whitesides GM, Anal. Chem., 2009, 81, 7091–7095
[5] Dungchai W, Chailapakul O and Henry CS, Analyst, 2011, 136, 77-82
[6] Li X, Tian J and Shen W, Cellulose, 2010, 17, 649–659
[7] Spicar-Mihalic1 P, Toley B, Houghtaling J, Liang T, Yager P and Fu E, J. Micromech. Microeng., 2013, 23, 067003
[8] Song M-B, Joung H-A Oh YK, Jung K, Ahn YD and Kim M-G, Lab Chip, 2015, 15, 3006-3012
[9] Li CG, Joung H-A, Noh H, Song M-B, Kim M-G and Jung H, Lab Chip, 2015, 15, 3286-3292
[10] Lutz BR, Trinh P, Ball C, Fu E and Yager P, Lab Chip, 2011, 11, 4274-4278.
[11] Toley BJ, Wang JA, Gupta M, Buser JR, Lafleur LK, Lutz BR, Fu E and Yager P, Lab Chip, 2015, 15, 1432-1444
[12] Han KN, Choi J-S and Kwon J, Sci. Rep., 2016, 6, 25710
[13] Kim K, Joung H-A, Han G-R and Kim M-G, Biosens. Bioelectron., 2016, 85, 422-428
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update