| 코로나 바이러스의 예방과 치료 | |
|---|---|
| Date 2020-10-21 01:21:56 |
|

교수
서울대학교 의과대학 약리학 교실
chlee-antibody@snu.ac.kr
CORONA VIRUS
현재 전세계에서 대유행 중인 COVID-19는 중증 급성 호흡기 증후군 코로나 바이러스 2 (SARS-CoV-2) 에 의해 발생한다. SARS-CoV-2 는 경미한 발열, 기침 및 호흡 곤란을 포함한 다양한 임상 증상으로 시작된다. 심한 경우는 호흡 곤란, 저산소증, 그리고 호흡 지원에 대한 집중적인 치료가 필요한 50 % 이상의 폐 손상을 보였고, 심각한 경우는 호흡기 및 다기관 부전으로 특징 지어졌다. SARS-CoV-2 는 또한 환자에서 급성 호흡 곤란 증후군 (ARDS)의 일반적인 합병증을 유발하는 것으로 알려져 있으므로 인공 호흡기가 필요하다 [1]. SARS-CoV-2는 2002 년에 SARS 발병을 일으켰던 SARS-CoV (~ 80 % 서열 동일성)와 밀접한 관련이 있는 베타 코로나 바이러스로, 중동 호흡기 증후군 코로나 바이러스 (MERS-CoV; ~ 54 % 서열 동일성)와도 높은 유사성을 가지고 있다. 또한 SARS-CoV-2는 경미한 감염을 유발하는 다른 인간 코로나 바이러스 (HCoV-HKU1 (~ 52 % 서열 동일성), HCoV-OC43 (~ 51 %), HCoV-NL63 (~ 49 %) 및 HCoV- 229E (~ 48 %))와 유전적으로 관련이 있다 [2,3].
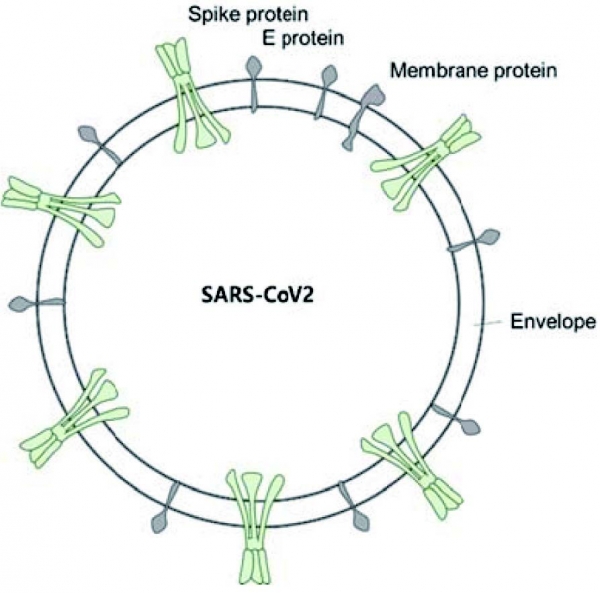
그림 1. 중증 급성 호흡기 증후군 코로나 바이러스 2 (SARS-CoV-2)
SARS-CoV-2 비리온 (virion)은 50-200 nm의 직경을 가지고 있으며, Spike protein, Envelop protein, Membrane protein, Nucleocapsid protein의 4개의 구조 단백질을 가지고 있다 (그림 1) [4,5]. 이 중 Spike protein은 숙주세포 표면에 발현된 ACE2 (angiotensin converting enzyme 2)에 결합해 숙주세포에 침투하는 기능을 수행한다. Spike protein은 2 개의 기능적 소단위를 가지고 있다. S1 소단위는 세포 부착을 매개하고 S2 소단위는 바이러스와 세포막의 융합에 관여한다 [6]. Spike protein은 동종 삼량체로서 존재하며, SARS-COV-2의 Spike protein은 원래의 SARS 바이러스 균주보다 인간 ACE2에 대해 더 높은 친화도를 가지며, transmembrane protease, serine 2 (TMPRSS2)에 의한 초기 Spike protein 프라이밍은 SARS-CoV-2의 진입에 필수적이다 [7]. SARS-CoV-2 비리온이 표적 세포에 부착된 후, 세포의 TMPRSS2는 바이러스의 Spike protein을 절단하여 S2 서브 유닛의 융합 펩타이드를 ACE2에 노출시킨다 [7]. 이 후 비리온 주변에 엔도좀이 형성되어 나머지 숙주 세포와 분리되어 세포 내에 존재하게 된다. 비리온은 엔도좀의 pH가 떨어지거나 cathepsin (host cysteine protease)가 비리온을 절단할 때 탈출한다. 그런 다음 비리온은 RNA를 세포로 방출해 세포가 바이러스를 생산하고 전파하도록 하여 더 많은 세포를 감염시키도록 한다 [3,7].
COVID-19
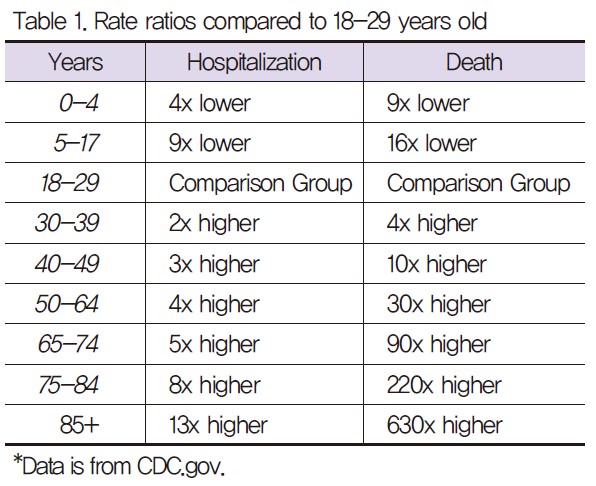
COVID‑19는 상기도 (부비동, 코, 인후)와 하기도 (기관 및 폐)에 영향을 미칠 수 있으며, 중증도에 따라 4 가지 유형으로 구별할 수 있다 [8,9]. 첫째, 경미한 폐렴 (minor pneumonia)은 경미한 장액성 삼출과 섬유소 삼출의 증상을 가지고 있으며, 경증 폐렴 (mild pneumonia)은 폐부종, 폐 세포 증식, 대형 비정형 폐렴구, 림프구 침윤을 동반한 간질성 염증 및 다핵 거대 세포 형성의 증상을 보여준다. 심각한 폐렴 (severe pneumonia)은 심각한 저산소 혈증 혹은 급성호흡곤란 증후군을 일으킬 수 있는 미만성 폐포 손상 (diffuse alveolar damage, DAD)을 보여준다. 회복기 폐렴 (healing pneumonia)은 폐포 및 폐 간질 섬유에서 조직의 분비물이 존재한다. 이러한 COVID-19는 나이에 따라 중증도가 심각하게 나타나며, 특히 85세 이상의 경우, 18-29세 보다 약 13배 높은 입원율과 630배 높은 사망률을 보여준다 (Table 1). 이러한 COVID-19는 2020년 9월 현재 전세계에 2850만 명의 감염자와 91만 6천명의 사망 피해를 가져왔다. 이를 극복하기 위해서는 빠른 COVID-19 백신 및 치료제의 개발이 필요하다. 현재, 항 바이러스 및 항 염증 치료를 병행하는 방법이 연구되고 있으며, 많은 연구에서 glucocorticoids의 기능을 조사하여 염증 매개 폐 손상을 조절하여 호흡 부전과 사망률을 완화시키려는 시도가 지속되고 있다 [10].
COVID-19 백신
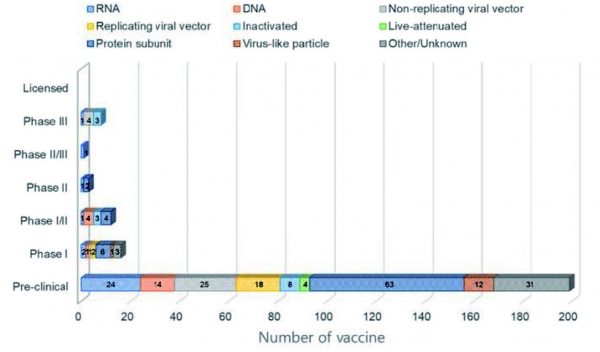
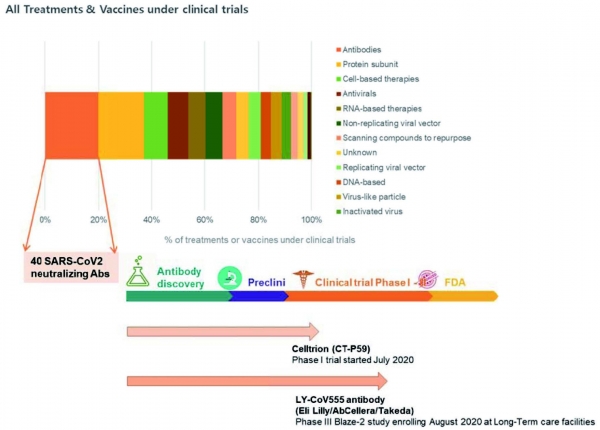
백신 (vaccine) 이란 병원체를 약화시킨 후 인체에 주입해 병원체에 대한 항체를 형성하도록 해 그 질병에 저항하는 후천 면역이 생기도록 하는 의약품을 말한다. 백신은 병원체의 상태에 따라 완전히 병원체를 죽여서 만드는 사백신과, 약독화시켜 만드는 생백신으로 구별이 가능하며, 최근엔 병원체의 주요 항원을 재조합 단백질로 만들어 사용하는 경우와, 주요 항원의 mRNA 를 이용한 백신도 개발되어 시도되고 있다. 현재 COVID-19에 대한 백신 후보들은 약 239 개로, 9월 현재 약 40 개의 백신 후보가 임상 과정에 있으며, 16개가 임상 1상, 12개가 임상 1/2상, 3개가 임상 2상, 1개가 임상 2/3 상, 8개가 임상 3상에 있다 (그림 2) [11].
현재 COVID-19에 대한 효과적인 백신을 만들기 위해 9 개의 서로 다른 기술 플랫폼을 기반으로 연구 및 개발 중이며 (그림 2), 9 월 현재 임상 시험에 있는 백신 후보 플랫폼의 대부분은 코로나 바이러스 스파이크 단백질과 그 변종에 초점을 맞추고 있다. 일반적으로 COVID-19 용으로 개발중인 백신 기술은 인플루엔자를 예방하기 위해 이미 사용 중인 백신이 아니라 COVID-19 감염 메커니즘의 정확성을 위해 “차세대”전략을 사용하는 동시에 궁극적으로 감염을 예방하기 위해서 새로운 백신 기술 플랫폼을 개발해 사용하고 있다. 이들은 노인, 어린이, 임산부 및 기존 면역 체계가 약화된 사람들과 같은 특정 인구 하위 그룹에서 COVID-19에 대한 감염 감수성 메커니즘을 해결하도록 설계되었다 [12,13]. 가장 앞선 백신 후보 물질에 대한 초기 데이터가 등장하고 있으며, 사용되는 여러 플랫폼을 기반으로 한 백신에 대해 고무적인 항체 및 T 세포 반응이 보고되었지만 상대적 잠재력을 평가하기에는 너무 이르다. 옥스포드 대학교와 AstraZeneca는 변형된 침팬지 아데노바이러스 벡터를 기반으로 백신 (AZD1222)을 개발했으며, 가장 먼저 임상 3상에 진입한 백신 중 하나이지만 현재 신경 독성으로 인해 2020년 9월 현재 임상 시험이 잠시 중단 후 재개 되었다. CoronaVac 은 비활성화된 SARS-CoV-2 를 기반으로 개발되었으며 (Sinovac, Instituto Butantan) 현재 임상 3상 중에 있다.
그림 2. 임상 진행 중인 COVID-19 백신 현황 (Data is from WHO, Milken Institu te, and clinicaltrials.gov).
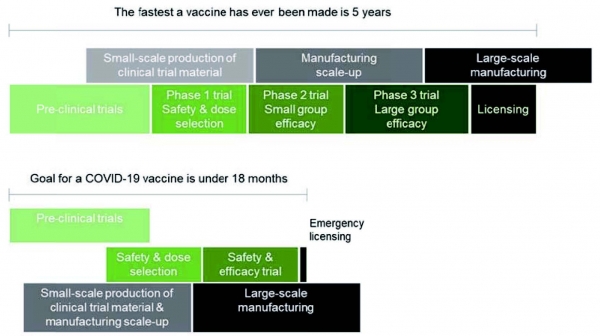
그림 3. 단축된 COVID-19 백신의 임상 과정 [17]
mRNA를 기반으로 만들어진 백신에는 BNT162 (BioNTech, Fosun Pharma, Pfizer) 과 mRNA-1273 (Moderna, NIAID, BARDA) 등이 있으며 모두 임상 3상 중에 있다 [11].
다른 치료제들과 달리 백신은 전 세계의 정상인을 대상으로 투여되는 것이기 때문에 부작용에 훨씬 더 민감하게 받아들여야 하고 이러한 이유로 인해 백신의 임상과정은 매우 철저히 심사해야 하고, 백신의 허용 가능한 독성 수준 (안전 성), 취약한 집단을 대상으로 하는 백신 효능 평가, 백신 접종 보호 기간, 용량 요법, 안정성 및 저장 특성 등을 고려해야 만 한다. 하지만 현재 심각한 전세계적 피해 때문에 이러한 COVID-19 백신들은 모두 fast track 으로 임상과정을 진행하 고 있다. 따라서 COVID-19 백신을 최대한 빠른 시한에 제공하기 위해서 총력을 기울이고 있는 것이 현실이기 때문에 현재의 임상과정은 이전과 달리 백신 개발 프로세스 중 중요한 심사과정이 생략될 위험이 높다 [14,15].
미국 CDC (Centers for Disease Control and Prevention)에 따르면 현재 사용되고 있는 독감 백신의 경우, 약 40-60% 의 효능을 가지고 있다. 하지만 시뮬레이션 결과에 따르면, 현재 전세계적으로 유행 중인 COVID-19를 진압하고 다른 조치 (예 : 사회적 거리두기 )의 필요성을 없애기 위해 백신은 75 % 백신 적용 범위에서 최소 80 %의 효능을 가져야 한다 [16]. 일반적으로 효능이 40 % ~ 70 % 인 백신이 전염병을 예방할 수 있고 60 ~ 80 %가 진행중인 전염병을 진압할 수 있지만, 이것은 모든 인구에 대해서 적용된 것이 아니기 때문에 백신만으로 모든 것이 즉시 정상으로 돌아가는 것은 어려울 것이다 [16].
COVID-19 중화 항체
중화 항체 (neutralizing antibody)란 바이러스에 결합해 바이러스가 숙주세포로 진입할 수 없도록 막는 항체를 말한다. 앞서 언급한 바와 같이 SARS-CoV-2 가 인간 숙주세포에 감염되기 위해서는 SARS-CoV-2 의 spike protein이 인간 세포의 ACE2에 결합해야 한다.
SARS-CoV-2 의 spike protein는 서브 유닛 S1과 S2로 나눠지며 S1에는 수용체 결합 도메인 (receptor binding domain, RBD)이 존재하며, 이 RBD가 ACE2의 결합 자리이다. 따라서, 일반적으로 SARS-CoV-2 중화 항체는 spike protein의 RBD에 결합해 (보고된 중화항체 중 일부는 spike protein의 RBD가 아닌 부위에 결합해 바이러 스의 숙주세포 감염을 막는 예가 있음) 바이러스가 숙주 세포의 ACE2에 결합하지 못하도록 막아 바이러스의 침입을 막을 수 있다.
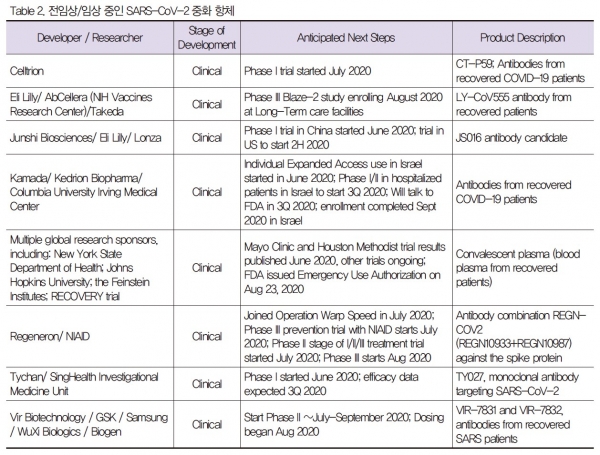
현재 중증 급성 호흡기 증후군 코로나 바이러스에 대한 중화항체 중 임상 시험에 진입한 것은 8 가지이며 (Table 2), 현재 임상에 진입한 항체 중 가장 선두에 있는 것은 Eli Lilly/AbCeller/Takada 의 세 개 제약회사가 진행 중인 LY-CoV555 항체로서, 현재 임상 3상을 진행 중에 있다 (그림 4). 또한 국내 제약 기업 셀트리온에서 개발한 CT-P59 항 체 또한 2020년 7월에 임상 1상을 시작하였다 (Table 2 & 그림 4).
회복기 COVID-19 환자의 memory B cell은 SARS-CoV-2 에 대한 고친화성 중화 항체를 얻는 데 가장 많이 사용되고 있는 source이다. 또한 백신을 접종할 경우, 고친화도 중화항체를 만들 수 있으므로 이를 활용할 수 있다. 따라서, 회복기 COVID-19 환자 혹은 백신을 접종한 자원자의 memory B cell 에서 Spike protein 을 활용해 스크리닝하는 방법을 가장 많이 사용하고 있다.
그림 4. 현재 COVID-19에 대해서 개발 중인 치료제 및 백신
항체 기반 약물 요법 또는 백신을 시행하기 전에 해결해야 할 중요 사항은 바이러스 감염의 항체 의존성 강화 (antibody dependent enhancement, ADE) 이다. 바이러스 특이 항체는 바이러스 항체를 교차 결합하여 면역 세포로의 바이러스 진입을 촉진할 수 있다. 또한, 세포 표면에 발현된 Fc 수용체 또는 보체 수용체에 바이러스 -항체 (혹은 보체 ) 복합체가 결합해, 바이러스의 감염을 촉진할 수 있다. 이러한 ADE 작용은 다른 코로나 바이러스의 경우 이미 보고된 바 있으며, SARS-CoV-1 의 ADE는 바이러스의 숙주세포 감염경로와는 다른 추가 진입 경로를 제공하기 때문에 바이러스의 병원성을 증진시킨다 [18,19]. 앞서 설명한 ACE2에 의한 감염 경로가 아니라, SARS-CoV-1 의 ADE에서 anti-Spike protein 항체는 바이러스 -항체 복합체를 FcγRII에 결합시킨 후 pH 및 cysteine protease-독립 경로를 통해 내재화함으로써 면역 세포로의 바이러스 진입을 매개한다. 이러한 ADE는 낮은 농도의 중화 항체가 투여되었을 때 그 위험성이 더 높아질 수 있다는 가설이 제시되었다 [20-22]. 이와 같은 SARS-CoV-2 의 ADE 위험을 없애기 위해 FcγR에 대한 친화성이 제거된 LALA 돌연변이가 도입시켰을 경우, 히말라야 원숭이에서 SARS-CoV-2 감염과 관련된 바이러스 부하 및 감염 관련 폐 손상을 효과적으로 감소시킬 수 있다는 결과가 보고되었다 [23]. 하지만 현재 임상과정에 있는 항체들은 SARS-CoV-2 의 감염을 막을 수 있는 중화효능은 가지고 있지만 ADE를 유발할 수 있는 IgG의 형태를 가지고 있기 때문에 ADE에 대한 위험성을 가지고 있다.
결론
COVID-19를 대상으로 현재 개발 중인 백신과 중화항체는 현재의 COVID-19 비상상태를 종식시키기 위한 필수요건 으로 여겨지고 있으며, 이들을 얻기 위해 수 많은 제약회사와 전 세계인들이 노력하고 있다. 하지만 백신과 중화 항체 모두 항체를 기반으로 바이러스에 대한 치료효과를 얻는 것이기 때문에 우리는 다음의 부작용에 대해 조심해야 한다.
항체 기반 백신 및 치료제의 잠재적인 위험 중 하나는 항체 의존성 향상 (antibody dependent enhancement, ADE) 을 통해 COVID-19 중증도를 악화시킬 위험이다. 우리는 호흡기 세포 융합 바이러스 (respiratory syncytial virus, RSV) 및 홍역 바이러스 (measles)와 같은 다른 호흡기 바이러스에서 ADE에 의해 바이러스 감염이 악화된 예를 찾아볼 수 있다 [24,25].
호흡기 감염의 ADE는 강화된 호흡기 질환 (enhanced respiratory disease, ERD)이라는 더 광범위한 범주에 포함되며, 여기에는 사이토 카인 캐스케이드 및 세포 매개 면역 병리학과 같은 비항체 기반 메커니즘도 포함된다. 또한 ADE 및 ERD는 SARS-CoV 및 MERS-CoV에 대해서도 보고되었기 때문에 [26], 현재 개발 중인 COVID-19 백신이나 SARS-CoV-2 중화항체의 사용에 있어 더욱더 조심스러운 접근이 필요할 수 있다.
참고문헌
1. Wölfel, R., Corman, V. M., Guggemos, W., Seilmaier, M., Zange, S., Müller, M. A., Niemeyer, D., Jones, T. C., Vollmar, P., Rothe, C., Hoelscher, M., Bleicker, T., Brünink, S., Schneider, J., Ehmann, R., Zwirglmaier, K., Drosten, C., and Wendtner, C. (2020) Virological assessment of hospitalized patients with COVID-2019. Nature. 581, 465–469
2. Gorbalenya, A. E., Baker, S. C., Baric, R. S., de Groot, R. J., Drosten, C., Gulyaeva, A. A., Haagmans, B. L., Lauber, C., Leontovich, A. M., Neuman, B. W., Penzar, D., Perlman, S., Poon, L. L. M., Samborskiy, D. V., Sidorov, I. A., Sola, I., and Ziebuhr, J. (2020) The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat. Microbiol. 5, 536–544
3. Rabi, F. A., Al Zoubi, M. S., Kasasbeh, G. A., Salameh, D. M., and Al-Nasser, A. D. (2020) SARS-CoV-2 and Coronavirus Disease 2019: What We Know So Far. Pathogens. 9, 231
4. Wu, C., Liu, Y., Yang, Y., Zhang, P., Zhong, W., Wang, Y., Wang, Q., Xu, Y., Li, M., Li, X., Zheng, M., Chen, L., and Li, H. (2020) Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharm. Sin. B. 10, 766–788
5. Wrapp, D., Wang, N., Corbett, K. S., Goldsmith, J. A., Hsieh, C.-L., Abiona, O., Graham, B. S., and McLellan, J. S. (2020) Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science (80-. ). 367, 1260–1263
6. Wang, C., Li, W., Drabek, D., Okba, N. M. A., van Haperen, R., Osterhaus, A. D. M. E., van Kuppeveld, F. J. M., Haagmans, B. L., Grosveld, F., and Bosch, B. J. (2020) A human monoclonal antibody blocking SARS-CoV-2 infection. Nat. Commun. 10.1038/s41467-020-16256-y
7. Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., Schiergens, T. S., Herrler, G., Wu, N. H., Nitsche, A., Müller, M. A., Drosten, C., and Pöhlmann, S. (2020) SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 181, 271-280.e8
8. Merad, M., and Martin, J. C. (2020) Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat. Rev. Immunol. 20, 355–362
9. Xu, Z., Shi, L., Wang, Y., Zhang, J., Huang, L., Zhang, C., Liu, S., Zhao, P., Liu, H., Zhu, L., Tai, Y., Bai, C., Gao, T., Song, J., Xia, P., Dong, J., Zhao, J., and Wang, F. S. (2020) Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 8, 420–422
10. Dexamethasone in Hospitalized Patients with Covid-19 — Preliminary Report (2020) N. Engl. J. Med. 10.1056/nejmoa2021436
11. COVID-19 vaccine tracker [online] https://vac-lshtm.shinyapps.io/ncov_vaccine_landscape/ (Accessed September 14, 2020)
12. Thanh Le, T., Andreadakis, Z., Kumar, A., Gómez Román, R., Tollefsen, S., Saville, M., and Mayhew, S. (2020) The COVID-19 vaccine development landscape. Nat. Rev. Drug Discov. 19, 305–306
13. Le, T. T., Cramer, J. P., Chen, R., and Mayhew, S. (2020) Evolution of the COVID-19 vaccine development landscape. Nat. Rev. Drug Discov. 10.1038/d41573-020-00151-8
14. Lurie, N., Saville, M., Hatchett, R., and Halton, J. (2020) Developing Covid-19 Vaccines at Pandemic Speed. N. Engl. J. Med. 382, 1969–1973
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update