| 감염병 대유행에 대비한 백신 신속 개발/생산 전략 | |
|---|---|
| Date 2021-04-21 13:45:19 |
|

교수
건국대학교
khong@konkuk.ac.kr
감염병의 대유행 (pandemic) 대응을 위한 요소
COVID-19의 장기간 대유행으로 인해 우리나라 뿐 아니라 전 세계가 감염병의 대규모 전파력의 위험성에 대해 다시 한 번 위험성을 절감하게 되었다. 이전에도 급성 감염병 병원체에 의한 대유행의 경험이 없던 것은 아니어서 최근 20년 동안에도 2003년 SARS, 2009년 신종플루, 2014년 서아프리카 지역의 에볼라, 그리고 우리나라를 반년 넘게 뒤흔들었던 2015년의 MERS 등이 몇 년 정도의 주기를 두고 반복적으로 발생해서 감염병에 의한 개인 및 사회적 위험성에 대한 경각심을 상기시켜 왔으나 [1], 해당 감염병의 대유행이 대개는 1년 이내에 종결되고 소규모 또는 국지적으로 완화되고 나면 새로운 감염병에 대한 사전 대비나 발생 시의 신속한 대응은 또다시 다음 번 감염병의 도래까지 감염병을 연구하고 대응기술을 개발하는 사람들만 관심을 갖는 “그들만의 리그”처럼 되돌아가곤 했었다. 그럼에도 불구하고 주기적으로 반복되는 감염병의 대유행으로 인해 광범위한 세균, 바이러스에 대한 진단기술의 기반 구축, 대유행 발생 시 역학적 모니터링과 환자 추적 등을 위한 보건안보 (Health Security)의 기초기술들은 그나마 꾸준히 연구개발이 진행되어서 COVID-19가 유행한 2019년 겨울에는 적어도 우리나라를 비롯한 몇몇 나라의 상황에서는 방역에 크게 기여할 수 있는 정도까지 발전을 보이게 되었다.
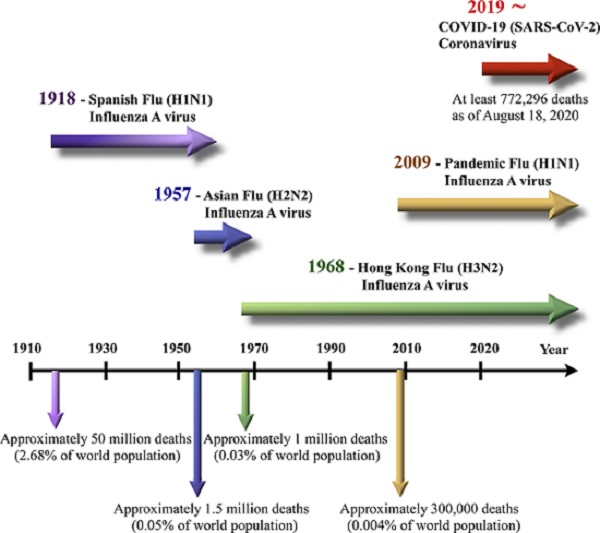
그림 1. 1900년 이후의 대유행(pandemic)의 역사. 1918년 스페인독감에서부터 2019년 COVID-19R까지 [1].
보통 감염병의 대유행을 대비하고 신속하게 대응하기 위한 기본적인 요소로 진단 시스템 구축, 효과적인 치료제 확보, 신속한 백신개발/생산, 정밀한 역학분석 기반 방역시스템 등이 고려되는데, 이 중 진단기술과 역학분석 기술이 이번 COVID-19에서 상당한 효과를 보인 반면, 효과적인 치료제의 확보는 아직도 요원하기만 하고 대응력의 기본 방향조차 미구축된 것처럼 보인다. 이에 비해 나머지 한 가지 요소이자 실제로 감염병의 대유행을 통제할 수 있는 가장 강력하고 근본적인 수단인 백신은 몇 차례의 반복적인 대유행을 겪으면서 완전하지는 않으나 상당한 발전을 보여서 개발과 생산의 신속성에서 COVID-19 상황에서 과거와는 많이 다른 양상을 보이고 있고, 아직 해결되지 못한 부분도 어느 정도 명확하게 보여주고 있다.
일반적으로 백신개발은 진단기술이나 치료제, 역학적 분석기술 등에 비해 전적으로 감염 이전의 정상인을 대상으로 감염이 발생할 가능성이 있거나 이미 발생한 감염병의 전파를 감염 이전에 차단하는 독특한 성격의 보건안보 확보기술이자 감염병 대유행 대응기술이다. 그럼에도 이제까지의 백신 개발과정은 생백신과 사백신을 포함하는 전체백신(whole vaccine)이나 재조합단백질항원 또는 분할된 병원체 성분을 이용하는 부분백신 (subunit vaccine)이 주요 개발 방식이었어서 개발과정에 짧게는 3년 이상, 길게는 10년 정도의 기간이 걸리는 분야였다. 이러한 장기 개발 기간의 문제는 갑작스러운 대유행의 발생 시 이미 개발되어있는 백신이 있지 않는 한 예방용 백신으로 해답을 찾기 어려운 부분이 되어 왔고 이 때문에 SARS나 MERS 모두 대유행이 지나가고 난 후에도 여전히 백신을 개발하고 있는, 당장의 현황을 타개하기 어려운 요인이 되어왔다. 그럼에도 여러 번의 감염병 대유행을 거치면서 개발과 생산의 기간을 단축시킬 수 있는 새로운 기술들이 점차적으로 속속 개발되어왔는데 작년부터 이슈가 되어 2021년 초에 드디어 모습을 드러낸 mRNA백신이나 벡터백신 (VEctor vaccine) 등 핵산 제형의 백신들이 대표적이다. 이들 핵산 제형 백신은 항원을 개발하는 과정에서 해당 유전자를 대상으로 항원을 제조하기 때문에 보다 신속하게 시험 물질을 생산해 볼 수 있고 다양한 후보물질들을 빠르게 확보할 수 있는 기술로 대두되고 있다.
대유행 대응을 위한 예방백신 신속개발과 생산, 핵산 기반 백신
위에서 언급한 것처럼 백신의 경우, 개발이나 생산에 소요되는 장기간의 시간이 대유행시 대응기술로의 사용에 가장 큰 장애요인으로 작용해 왔고, 이를 해결하기 위해서 21세기 초에 SARS 발생 이후 꾸준히 효과적인 항원을 신속하게 개발하고, 개발 후 신속 대량생산이 가능한 백신기술이 발굴되어 왔는데, mRNA나 벡터백신이 대표적이다.
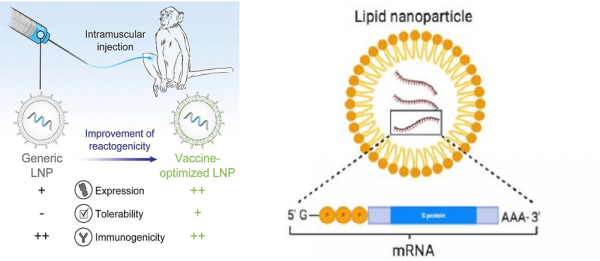
COVID-19 상황에서 세상에 효율성을 드러낸 mRNA백신의 경우, 그 동안 항원으로서의 가능성과 효능 등에 대해서는 상당히 연구가 진행되어 가능성에 관심이 모여졌었으나 제품화를 하기엔 단백질이나 DNA 등에 비해서 크게 취약한 물질의 안정성 (stability) 문제로 인해 인체 주입 후의 효능을 일정하게 유지하는 것이 쉽지 않은 장벽이었다. 이처럼 접종 및 전달과정에서의 안정성 문제를 해결하기 위한 기술로 mRNA 항원을 내재하고 전달하여 인체 안에서 작동하도록하는 “LNP (Lipid Nano Particle)” 기술이 매우 중요한 기술로 부각되었는데 [2], 온도나 생화학적 반응 등에 워낙에 취약한 RNA 성분을 항원으로 작동하는 단백질 발현까지 인체 내 환경에 의한 분해로부터 mRNA 항원을 보호하기 위한 운반체이자 보호막으로서 이러한 LNP기술이 이번 COVID-19백신 개발에 혁신적으로 사용되었다. 올 초부터 mRNA백신 제품을 상용화하여 공급하고 있는 미국의 Moderna사와 Pfizer (실제 개발 기업은 독일의 BIONTECH)사의 경우도항원만큼이나 이 LNP기술이 개발에 큰 역할을 한 것으로 알려져 있다. LNP 기술의 발전은 DNA나 RNA와 같은, 인체내에서 안정성이 그다지 높지 않은 물질을 백신으로 개발할 수 있게 해준 결정적인 요인이었고 결국 이번 COVID-19 상황에서 1년 남짓 만에 핵산 제형의 백신이 개발될 수 있게 하였던 기술의 근간이었음에도, 아직은 mRNA 백신개발을 선도하고 있는 Moderna와 BIONTECH, 그리고 COVID-19 이전에는 mRNA백신 분야에서 이들 두 회사보다도 앞서나갔던 독일의 CureVac 등이 모두 Arbutus BioPharma 사의 특허기술을 사용하고 있는 형편이어서 제한이 많은 편이다. LNP기술은 리포좀을 기반으로 하는 기술임에도 아직 안정성, 전달효율 등에서 Arbutus 외의 기술은 mRNA 백신을 패키징해서 사용하는 공정에 적용되지는 못하고 있는데, 국내에서도 질병관리청이 주도하여 mRNA 백신기술과 연계한 국산 LNP기술의 상업적 개발에 정부차원에서의 지원을 준비하고 있다.
그림 2. 백신에 최적화된 LNP 기술의 특징. 보통의 LNP보다 내재된 핵산의 발현 효율이 좀 더 우수하고 항원을 보호할 수 있는 내구성을 보유하고 있으며 여전히 일반적인 LNP처럼 면역자극 작용이 있다. LNP 안에는 naked form의 mRNA 조각이 들어 있다.
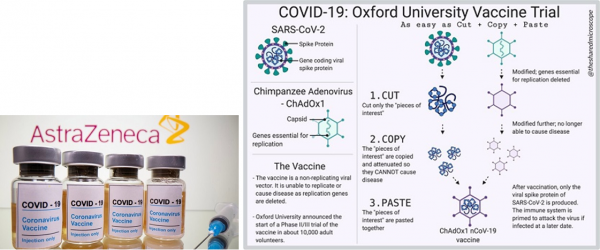
COVID-19 백신과 관련하여 또다른 기린아인 벡터백신은 Astrazeneca사와 영국 옥스퍼드대학교 제너연구소가 함께 개발한 침팬지아데노바이러스벡터 기반 백신을 필두로 하여, 존슨앤존슨이나 러시아 가말리아연구소의 스프트니크 V백신 등이 모두 아데노바이러스 벡터를 기반으로 하여 개발되었다. 벡터백신은 인체 내에서 단백질을 발현시키는 아데노바이러스 등을 변형시켜서 증식은 안 되고 단백질 발현만 하도록 만든 벡터에 원하는 항원유전자를 삽입하여 백신항원으로 사용하는 것인데, 오래 전부터 많은 연구가 있었음에도 이제까지는 상용화된 제품은 출시되지 못하던 와중에, 2014년 서아프리카 에볼라 대유행시부터 제너연구소를 비롯한 여러 기관에서 수행하던 연구 내용이 기반이 되어서 이번 COVID-19 상황에서 신속하게 새로운 백신 제형으로 개발되어 상품화되었다. mRNA백신이 작은 RNA 조각을 직접 항원으로 사용함으로써 세포성 면역반응에 관여하는 수용체에 대한 자극이 상대적으로 더 클 것으로 예상되는 반면, 벡터 백신은 원형의 벡터 안에 대상 유전자를 삽입하여 크기가 크고 구조도 반응성이 덜한 원형이므로 세포성 면역을 과도하게 자극할 가능성은 더 낮지 않을 것으로 기대되지만 이 부분에 대한 임상적 분석 결과는 아직 보고된 바 없다.
그림 3. Astrazeneca사의 벡터백신 (왼쪽)과 벡터 개발 과정 [3].
mRNA백신과 벡터 백신 등 현재 개발된 COVID-19용 백신은 두 가지 모두 매우 신속하게 개발되어서 감염병의 대유행을 대응하기 위해 신속, 대량 생산이 필요한 백신 연구개발에 새로운 이정표를 제시하였는데, 이처럼 신속한 개발과 예상보다 빠른 제품 생산이 가능했던 것은 핵산 물질이 기본적으로 제공하게 되는 몇 가지 특성이 이유였던 것으로 생각된다. 우선 핵산을 항원물질로 사용하는 경우, 기존의 생백신, 사백신이나 재조합단백질항원을 이용한 백신 등에 비해 연구를 위한 원료물질의 합성이나 생산이 상대적으로 매우 빠르고 쉬워진다는 점이다. 바이러스나 세균을 키우고 병원성이 낮아지는 균주를 찾아내는 기간이 몇 년 정도를 요구하는 장기개발과정이며, 재조합단백실의 발현 또한 한번 만들어진 후보물질을 바꾸려면 상당한 시간이 필요한 데 비해서 mRNA나 벡터백신처럼 핵산을 원료로 사용할 경우에는 원하는 유전자 정보를 훨씬 간단하게 바꿔서 다양한 테스트를 보다 쉽고 빠르게 수행할 수 있으므로 적합한 항원을 찾거나 변경하는 것이 훨씬 수월하고 빨라질 수 있다.
또한 핵산을 이용한 백신의 경우 mRNA 항원이나 벡터가 자체적으로 생체 내 면역수용체 (대체로 Toll-like receptor들)에 영향을 줘서 면역증강효과를 보이게 되는데 이러한 부수적 효과는 사백신이나 재조합백신의 개발과정에서 필요한 추가적인 면역증강제와의 조합을 찾는 제형 분석 단계를 거치지 않을 수 있어서 역시 신속한 개발과 대량생산에 유리한 면으로 작용한다. 물론 면역증강효과 때문에 개인에 따라서는 과도한 사이토카인 분비를 수반하는 면역반응이 발생하여서 기존의 백신보다 정도가 심한 부작용을 일으킬 수도 있으나 아직 이런 부분에 대한 위험성이나 임상적 해석이 과학적으로 분석되어 보고된 바는 없으며, 기존의 백신 제형들에 비해서 크게 문제가 되는 정도는 아닐 것으로 예상되고 있다.
2021년 이후의 COVID-19 상황과 관련된 백신의 미래 기술 수요
현재 유럽은 mRNA백신과 벡터백신인 Pfizer사와 Astrazeneca 등의 백신이 한참 임상 현장에서 접종 중에 있고, 미국은 자국의 Moderna 사 제품을 위주로 역시 대규모 백신 접종을 진행 중에 있다. 그 외 중동이나 남미, 아시아 국가들도 위의 세 개 회사 제품들과 더불어 수요가 부족한 경우 러시아산 스프트니크 V나 존슨앤존슨의 또 다른 벡터백신, 중국 Sinovac 사 등의 중국산 아데노바이러스 벡터백신 등을 구매하여 백신 접종 수를 늘리는 데 혈안이 되어 있다. 이와 같은 상황에서는 보통 백신의 유효성을 유지하면서 생산의 속도와 양을 획기적으로 증대시킬 수 있는 공정이나 제형이 새로운 관심의 대상이 된다. 백신 생산량을 늘리기 위해서는 근본적으로 생산시설이 증설되는 것이 답일 것이나 시설이나 기기가 짧은 시간에 무작정 늘리는 것에는 한계가 있을 수 있으므로 기존의 시설을 이용해서도 생산이 가능한 전통적인 재조합항원이나 전체백신의 개발도 여전히 유효한 COVID-19 대응 방법으로 필요할 것이다. 물론 같은 백신 생산량으로도 보다 많은 접종 도스를 만들 수 있는 좋은 면역증각제 (adjuvant)의 개발도 여전히 백신의 신속대량생산을 위한 필수적인 기술 수요이다.
한편으로는 영국, 남아프리카공화국, 브라질 등에서 발생한 변이주처럼 자연적으로도 발생이 되는 변이주가 백신 접종에 의한 선택압으로 인해 보다 많은 변화를 일으킬 경우에 대비한, 변이주에도 효능이 유지되거나 새로운 변이주에 특화된 백신의 개발이 또 다른 관심사가 된다. 현재도 지속적으로 모니터링 되고 있고 브라질 변이주에 대해서는 현재 사용 중인 백신의 효능이 떨어질 수도 있다는 예측도 보고되고 있으나, 아직 임상 결과를 토대로 한 분석은 아니며, 대체로 지금 사용 중인 백신이 웬만한 변이주에 대해서는 어느 정도 방어능을 보일 것으로 기대하고 있다. 그럼에도 변이주의 특성이 어느 방향으로 변할 지는 아무도 모르는 것이어서, COVID-19이 예상하지 못한 심각한 변이를 일으켰을 때를 대비할 수 있는 다양한 백신들을 핵산 제형에서부터 재조합항원백신과 생백신, 사백신에 이르기까지 지속적으로 개발할 필요가 있다. 새로 승인받은 존슨앤존슨의 벡터백신은 기존의 제품들이 2회 접종이 필요한 것에 비해 1회 접종만으로 방어력이 우수하게 나타나는 것으로 보고되었으며, 아직 개발 중인 Novavax사의 재조합항원 백신도 조만간 임상시험을 마치고 시중에 모습을 드러낼 것으로 기대된다. 이처럼 새로운 백신의 수요는 이미 몇 가지 COVID-19 백신이 시판되고 있음에도 여전히 지속적인 요구가 존재한다.
이번에 mRNA백신 제품을 처음으로 시중에 유통시키면서 새롭게 부각된 기술 부분도 있는데, 바로 유통과정과 보관시의 온도의 문제이다. 물론 이전의 백신 제품들도 온도에 민감한 편이어서 냉장조건 등의 콜드체인 유지가 늘 이슈로 작용하곤 했지만, 이번 COVID-19용 백신으로 개발된 mRNA백신이나 벡터백신은 이전의 온도조건보다 훨씬 운송 및 보관 조건이 까다로운 편이어서 이에 대한 기술개선도 향후 중요한 이슈로 대두될 것 같다. 특히 Pfizer의 mRNA백신인 코미나티주의 경우 영하 70도에서 보관, 유통을 기본조건으로 하고 이를 위한 특수용기도 이미 제작되어서 제공되고 있는데, 이러한 조건은 유지도 힘들지만 유통비용이나 시설도 다른 제품보다 훨씬 부담이 크다. Moderna사의 제품은 상대적으로 덜한 영하 20도에서 보관, 유통한다고 하지만 이 또한 일반적인 저온 냉장 조건은 아니어서 여전히 유지보관이 쉬운 편은 아니다. Astrazeneca의 벡터백신이나 존슨앤존슨이 최근 긴급승인을 받은 벡터백신 역시 –20도에서 장기 보관하는 것은 같지만, 2-8도의 저온 냉장조건에서도 한 달가량 보관이 가능하므로 [4] 상대적으로 콜드체인에 대해서는 유리한 백신이라고 할 수 있다. 물론 이전의 인플루엔자나 홍역 백신 등 대부분의 백신이 저온 또는 냉장조건에서 유통이 기본이어서 아주 새로운 이슈라고 하기는 어렵지만, 영하 70도 보관이 필수적인 Pfizer 백신 등 mRNA백신의 관점에서 보면 다른 어떤 백신보다도 온도의 이슈가 미래 수요에 대한 백신관련 기반기술로 대두될 가능성이 있다.
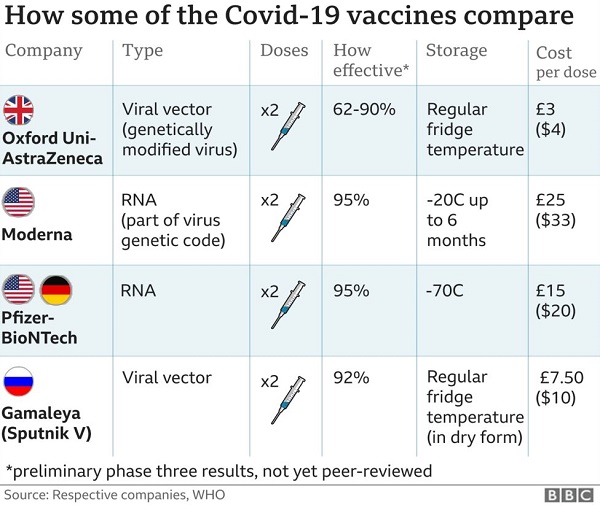
그림 4. 현재 상용화된 백신의 비교. 접종도스는 모두 2회로 제안하고 있으며 가격은 벡터백신 (Astrazeneca와 Gamaleya)이 mRNA백신(Modena와 Pfizer)보다 저렴하다. 보관온도에서도 벡터백신이 상대적으로 덜 제한적이다.
결론
COVID-19 대유행으로 인해 사회 전반이 경제적, 보건의료적 뿐만 아니라 다양한 방면에서 고난과 역경의 시간 속에 장시간을 보내고 있는 상황에서 백신은 진단기술이나 치료제, 역학조사 기술 등과 더불어 방역의 기본 축을 이루는 요소임과 동시에 이 네 가지 요소 중에서도 가장 근본적으로 감염병의 대유행을 근절시킬 수 있는 기술일 것이다. 그럼에도 백신의 개발에 필요했던 시간이나 비용이 이제까지의 방식으로는 너무 오래 걸리고 너무 대규모의 투자를 요구하는터라서 갑작스런 감염병의 대유행 상황에 대응하기 위한 수개월에서 1년 남짓의 기간 안에 이루어질 수 있는 신속한 백신의 개발과 대량 생산을 쉽사리 기대하기 어려웠는데, 2019-2020년의 1년 좀 넘는 COVID-19 대유행으로 인해, 이제껏 우리가 보지 못했던 새로운 방식의 개발과 새로운 제형의 신속 대규모 생산 등의 가능성과 효용성을 갑작스레 검증하게 되었다. 아직은 충분한 임상적 분석이 있었다고 안심하기도 이르고, 여러 가지 요소기술들이 완전에 가깝게 충분히 개발되었다고 보기도 어렵지만, 그래도 이전의 기술들에 비해 비약적으로 빠르게 대처할 수 있는 여러 가지 신기술과 생산역량을 처음으로 만나보게 되었으며 이를 통해 이후로는 대유행을 초래하는 병원체가 무엇이건 신속하게 대응하여 백신을 준비할 수 있는 플랫폼들이 속속 구축되고 이를 기반으로 감염병의 대유행 위험에서 지구촌이 안전을 담보할 수 있는 “보건안보”의 이슈가 충분히 해소될 수 있기를 기대한다.
더불어 mRNA백신이나 벡터백신 등 2021년 겨울에 우리를 놀라게 하며 등장한 새로운 기술 외에도 이제껏 전 세계의 대유행 대응을 위해 오랫동안 최상의 보험이자 대비였던 기존의 전체백신이나 재조합항원백신도 여전히 신기술의 Gap을 메울 수 있는 유효한 대상으로 중요하다는 점을 간과하지 않고 백신의 다양한 플랫폼을 균형 있게 구축해 감으로써 미래의 “Disease X” 도래가 유발할 어떤 새로운 병원체도 대유행을 유발하지는 못하는 안전한 보건의료체계의 구축을 기대해 본다.
참고문헌
1. Liu YC, Kuo RL, Shih SR. COVID-19: The first documented coronavirus pandemic in history, Biomed J. 2020. PMID: 32387617
2. Hassett KJ, Benenato KE, Jacquinet E, Lee A, Woods A, Yuzhakov O, Himansu S, Deterling J, Geilich BM, Ketova T, Mihai C, Lynn
A, McFadyen I, Moore MJ, Senn JJ, Stanton MG, Almarsson Ö, Ciaramella G, Brito LA. Optimization of Lipid Nanoparticles for
Intramuscular Administration of mRNA Vaccines, Mol Ther Nucleic Acids. 2019 Apr 15;15:1-11.
3. Fancy Comma, LLC. How Does the Oxford University/AstraZeneca Vaccine for COVID-19 Work? https://fancycomma.
com/2020/07/02/ all-about-the-oxford-astrazeneca-covid19-vaccine/
4. World Health Organization, COVID-19 Vaccination: Supply and logistics guidance, 2021 Feb. 12.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update