| 광기반 고속분자진단 플랫폼을 이용한 감염병 진단 | |
|---|---|
| Date 2021-04-22 09:46:42 |
|

교수
한밭대학교 화학생명공학과
sanghunlee@hanbat.ac.kr
1. 서론
최근 발생한 코로나바이러스 (severe acute respiratory syndrome 2, SARS-CoV-2) 감염증 및 과거 메르스 (middle east respiratory syndrome coronavirus, MERS-CoV), 사스 (severe acute respiratory syndrome coronavirus, SARS) 등의 유행은 존재하지 않았던 신종 병원균의 출현을 야기하였으며, 심각한 증상과 병원성을 나타내며 유행병성(pandemic)으로 큰 사회적 이슈와 삶의 패턴을 변화시키고 있다 [1]. 이에 향후 인수공통감염, 신종, 변종 바이러스 유행에 대한 다방면의 대비 노력이 요구되고 있다. 이러한 감염병은 체외진단 (in vitro diagnostics, IVD) 기법을 통해 생물학적 검체에 대한 진단검사를 수행할 수 있으며, 체외진단에는 면역화학적 진단, 자가혈당 측정, 분자진단, 현장진단 (point-of-care testing, POCT), 조직진단, 혈액진단 등의 다양한 세부분야가 존재한다 [2]. 현재 많은 진단분야에서 사용되고 있는 신속항원검사의 경우, 바이러스 항원을 인식하는 항체를 종이 위에 코팅하여 검체와 반응시켜 감염여부를 판정하며, 15 ~ 30분 내외로 양성여부의 판별이 가능하지만 위양성 (거짓 양성) 비율이 높아정확도가 떨어진다.
최근 감염병 진단에서 표준진단법 (gold standard method)으로 주목받고 있는 분자진단 (molecular diagnosis)은 병원체 및 세포의 유전자 (deoxyribonucleic acid, DNA; ribonucleic acid, RNA)를 증폭하여 분석하는 방법으로, 혈액, 소변, 조직, 척수액 등의 인체의 여러 체액 (body fluid)에서 표적유전자 (target biomarker)의 검출이 가능하다[3]. 이에 표적유전자만을 민감하게 검출하고자 중합 효소 연쇄 반응 (polymerase chain reaction, PCR)과 등온 증폭 (isothermal amplification) 방법이 분자진단 분야에서 다양하게 연구되고 있다. 특히 PCR 분석법은 반복적인 가열 및 냉각 사이클 (thermocycling, denaturation-annealing-extension cycles)을 통해 질병특이 서열을 포함하는 프라이머 및 핵산 중합효(polymerase)를 이용하여 표적유전자를 증폭 검출하므로, 검체 내 표적유전자 농도가 매우 낮은 경우에도 효과적으로 진단가능하며 매우 높은 민감도 (sensitivity)와 특이도(specificity)를 나타낸다. 반면 고가의 장비를 갖춘 병원 진단센터 (central lab.) 등으로 검체 운송 후 진단검사가 가능한 상황이며, 분석을 위한 전문가 및 검체확보에서 진단까지 수시간이 소요 (유전자추출 및 증폭 포함)되는 단점 또한 존재한다. 이로 인해 현장에서 실시간 대응이 어려운 문제가 상존하며, 현장진단 (point-of-care testing, POCT) 플랫폼의 경우 빠른 검사결과가 필요한 검사항목들에 대해 숙련된 인력이 아닌 검사 본인의 수행 시에도 오류가 없도록 기술을 개발해야 하는 높은 수준의 완성도 및 고도화가 필요하다. 이에 분자진단의 핵심기술인 PCR 기술은 플랫폼의 고도화와 더불어, 현장진단 및 고속분자진단 (fast PCR)으로 그 트렌드가 변화하고 있다 [4]. 또한 분자진단 시장에선 로슈(Roche), 쉐피드 (Cepheid), 에보트 (Abbott laboratories), 비오메리우 (BioMerieux), 다나허 (Danaher) 등의 기업들이 변화하는 트렌드에 맞춰 다양한 형태의 PCR 플랫폼의 연구개발 및 상용화를 진행하고 있다. 본 기고문에서는 국내외 분자진단관련 연구에서, 광기반 고속분자진단 연구들에 대한 사례를 소개함으로써, 현장진단 및 고속분자진단에 대한 최신 연구동향을 살펴보고자 한다.
2. 본론
2.1. 광기반 비접촉식 가열을 이용한 표적유전자 고속증폭
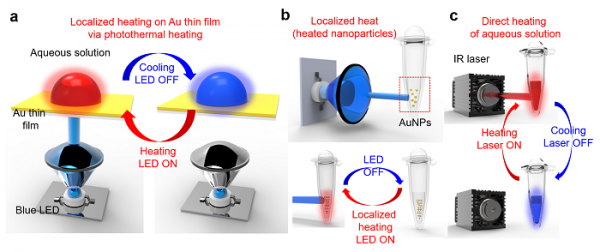
현재 상용화되어 있는 PCR 플랫폼 (thermocycler)의 경우, 주로 열전소자 (Peltier) 또는 박막히터를 이용한 저항가열방식을 이용하였다 [5]. 반면 광기반 가열의 경우 그림1과 같이 세가지 방법에 의해 수행이 가능하다. 현재 금박막 (Authin film) 표면 (그림1a), 금나노입자 (Au nanoparticle, AuNP; 그림1b), 또는 물에 직접 (그림1c) 가시광선 (visible light) 또는 적외선 (infrared ray) 영역의 빛을 조사하여 가열하는 방법이 고속분자진단에 사용되고 있다. 이러한 방법들은 광원으로 레이저다이오드 (laser diode) 또는 발광다이오드 (light emitting diode, LED)를 사용한다.
그림 1. 광-열 변환효과 (photothermal heating) 를 이용한 가열 의 예. (a) 금박막 표면에 의한 흡광을 이용한 가열, (b) 금나노입자에 의한 흡광 및 이를 이용한 가열, (c) 적외선의 복사열을 이용한 가열 [6].
2.2. 금박막을 이용한 광기반 고속PCR
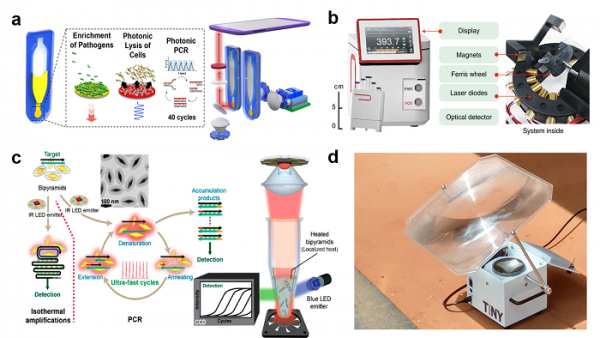
캘리포니아 버클리대학의 Luke Lee 교수 연구팀은 금박막을 이용하여 고속 photonic PCR 플랫폼을 구현하였다 [7]. 광원으로 사용된 청색 LED (λmax: 450 nm)의 빛이 금박막에 조사되었을 때, 금박막은 450 nm의 빛에 대한 강한 광 흡수율을 나타내었으며, 금박막에 흡수된 빛은 광자 (photon) – 전자 (electron) – 포논 (phonon) 커플링에 의해 플라즈몬 광-열 변환(photothermal heating)으로 열을 발생시킨다. 이 열은 주변 용액 (bulk liquid)에 전달되어 빠른 속도로 가열 및 냉각이 가능하다. 이러한 빠른 열전환 속도, 저전력소비 및 소형화에 유리한 특성을 이용하여 photonic PCR 플랫폼을 구축하였으며, 30 사이클의 PCR 증폭과정 (가열속도: 약 12.7°C/sec; 냉각속도: 약 6.6°C/sec)을 약 5분 내에 완료하였으며, 표적유전자의 성공적인 증폭 및 검출이 가능하였다. 또한 고속 photonic PCR 시스템은 소변 내의 병원균의 검출에 응용되었다 [8]. 금박막이 증착된 다공성막 (porous membrane)을 이용하여, 중력기반 유체흐름 (gravity flow)을 이용한 병원균의 농축 (enrichment), 세포 파쇄 (photonic lysis), 및 병원균 표적유전자의 고속 photonic PCR을 수행하였다. 모델 병원균으로 사용된 대장균은 1 μm의 pore size를 갖는 다공성막 표면에 수 분 내에 농축이 가능하였으며, LED로부터 금박막에 조사된 빛은 플라즈몬 광-열 변환 기작에 의해 세포파쇄 온도까지 급속히 가열이 가능하여, 세포 파쇄 및 고속 photonic PCR 기반 유전자 증폭이 가능하였다. 일련의 과정은 일체형 플랫폼에서 single-step으로 20분 내에 수행되었다. 또한 KAIST의 정기훈 교수 연구팀은 Au nanoisland를 포함하는 nanoplasmonic pillar 어레이와 백색 LED를 이용하여 30 PCR 사이클을 4분 미만에 수행하고 이를 MERS 유전자 검출에 활용하였다 [9].
그림 2. 광기반 고속 PCR 플랫폼. (a) 금박막 기반 병원균 분석을 위한 photonic PCR 시스템 [8], (b) 금나노입자 (magneto-plasmonicnanoparticles) 기반 고속 nanoPCR 시스템 [10], (c) 금나노입자 (Au bipyramid) 를 이용한 고속 PCR 시스템 [11], (d) 태양광을 이용한 유전자 증폭 시스템 [13].
2.3. 금나노입자을 이용한 광기반 고속PCR
연세대학교 천진우 교수 및 하버드대학교 이학호 교수 연구팀은 마그네토 플라스모닉 나노입자 (magneto-plasmonicnanoparticles, MPN)를 이용한 현장진단용 고속 PCR 플랫폼를 개발하였다 [10]. 마그네토 플라스모닉 나노입자는 16nm의 magnetic core 와 12 nm 두께의 plasmonic gold shell 구조로 구성되었으며, gold shell의 경우 535 nm 파장의 빛을 흡광가능하다. 빛을 열로 변환시키는 플라즈몬 광-열 변환 효과를 이용하여 11분 내의 고속 PCR 플랫폼을 구현하였으며, 패리스휠 (ferris wheel) 플랫폼 구조를 개발하여 샘플 처리량을 향상시켰다. 본 플랫폼을 이용하여 코로나바이러스 검체 테스트를 진행하였으며, 검체당 17분의 분석시간이 소요되었고, 150여 명의 검체에서 양성군과 음성군을 정확히 구분함으로써 감염여부를 판정하였다. 시카고대학의 Yossi Weizmann 교수 연구팀은 금나노입자 (gold bypyramidnanoparticle, AuBP)를 이용하여 고속 PCR 시스템을 구축하였다 [11]. AuBP의 resonant peak은 846 nm로 근적외선 (near infrared, NIR)영역의 LED를 사용하여 플라즈몬 광-열 변환을 유발하였다. 또한 AuBP 표면은 DNA의 비특이결합을 방지하기 위해 실리카코팅 (PEG-Si-AuBPs)을 진행하였다. 플랫폼 최적화를 통해 7.5 분 (가열속도: 약 16.6°C/sec; 냉각속도: 약 6.6°C/sec, AuBP 농도 OD=18.3)에 40 사이클이 완료 가능하였으며, 표적유전자를 1 pg/μl 농도까지 측정하였다.
그 외에도 적외선 레이저와 태양빛 (sun light)을 사용하여, 고속 PCR의 구현이 가능하다. 적외선기반 가열 방법은 1,000 nm 이상의 적외선파장 (Infrared ray)에서 물의 강한 흡광도를 이용하여 고속 PCR (가열속도: 약 10°C/sec; 냉각속도: 약 20°C/sec)의 진행이 가능하다 [12]. 또한 코넬대학교의 David Erickson 교수 연구팀은 전력의 사용이 용이하지 않은 지역 (resource-limited environments)에서의 분자진단을 위해, 태양광을 집광하여 표적유전자를 증폭하는 플랫폼을 개발하였다 [13].
3. 결론 및 전망
앞으로의 감염병 진단에서 중요한 화두는 고속진단 및 현장진단일 것이다. 현재의 코로나바이러스와 같은 신규 감염병의 감염 전파 차단을 위해, 현장에서 고속분자진단의 필요성은 절대적이다. 이러한 현장진단용 고속분자진단 기술의 발전은 신규 감염병을 정확하고 빠르게 진단하며, 감염확산을 통제하여 신규 감염병의 공포로부터 벗어나는 데 유용히 활용될 것이라 기대된다.
참고문헌
1. K. Stadler, V. Masignani, M. Eickmann, S. Becker, S. Abrignani, H. -D. Klenk, R. Rappuoli, SARS-Beginning to Understand a
New Virus, Nat. Rev. Microbiol., 1, 209-218, 2003.
2. V. Gubala, L. F. Harris, A. J. Ricco, M. X. Tan, D. E. William, Point of Care Diagnostics: Status and Future, Anal. Chem., 84, 487-
515, 2012.
3. B. D. Kevadiya, J. Machhi, J. Herskovitz, M. D. Oleynikov , W. R. Blomberg, N. Bajwa, D. Soni, S. Das, M. Hasan, M. Patel, A. M.
Senan, S. Gorantla, J. McMillan, B. Edagwa , R. Eisenberg, C. B. Gurumurthy , P. M. Reid, C. Punyadeera , L. Chang , H. E.
Gendelman., Diagnostics for SARS-CoV-2 infections, Nat. Mater., 2021. doi.org/10.1038/s41563-020-00906-z
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update