| 항암 활성 펩타이드 연구로 암 정복 가능성을 발견하다! 수산생물 유래 암세포 억제 항균 펩타이드 개발 | |
|---|---|
| Date 2022-04-08 21:48:26 |
|

해양수산연구사
국립수산과학원 생명공학과
combikola@korea.kr
암(癌)! 국내 사망률 1위
최근 의학기술과 진단기술의 발전으로 암을 정복하기 위한 다양한 항암물질과 치료법이 개발되었다. 암은 초기발견 후 치료를 통한 재발 및 전이를 방지함으로써 완치가 가능한 질병으로 인식되고 있었다. 하지만 2019년 통계청의 발표에 의하면 국내 사망률 1위는 암(악성신생물, 27.5%)으로, 2위인 심장질환(10.5%)과 3위인 폐렴(7.9%)보다 훨씬 높은 사망원인으로 집계 되었으며, 암으로 인한 사망자는 지속적으로 증가하는 추세이다. 전 세계적으로는 심장 질환 다음으로 높은 사망원인으로 2030년에는 약 1천 3백만 명에 이를 것으로 추산된다 [1]. 암 치료방법에는 외과적 수술, 방사선 치료 및 화학물질을 이용한 약물치료로 나누어지나 고가의 치료비용과 치료과정에서의 감염 및 치료과정의 부작용(정상세포 사멸, 약물내성 등)으로 완치가 쉽지 않은 실정이다 [2]. 따라서 여전히 항암치료의 문제점을 해결하기 위한 효과적인 치료물질과 치료 방법에 대한 연구가 진행되고 있다.
새로운 항암물질로 주목받는 저분자 단백질(펩타이드)
저분자 단백질성 물질인 펩타이드는 미생물에서부터 사람에 이르는 지구상의 모든 생물이 만들어내는 물질로 생체 내 대사과정과 생리활성 조절, 면역학적 기능 및 세포 재생 등 생명유지에 관여한다. 또한 외부에서 침입하는 병원성 미생물과 체내에서 생성되는 종양세포(암)와 같은 위험요소로부터 생체를 보호하는 선천적 면역 시스템의 최전방에서 작용하여 자가 방어 역할을 한다. 최근 이러한 저분자 펩타이드 중 10-50개의 아미노산으로 이루어진 항균 활성을 가지는 펩타이드가 항생제 대체소재로 주목받고 있으며, 항균 활성 외 상처치유, 항기생충, 항곰팡이, 항종양, 항바이러스 활성이 밝혀져 항생제 대체소제 외 다양한 약물로도 활용 가능성이 크다 [3,4] (그림1). 또한, 항균 펩타이드의 다양한 기능 중 낮은 세포독성, 높은 표적 선택적 활성, 면역반응 활성화, 그리고 항암활성이 부각되면서 새로운 항암 후보 물질로 주목받고 있다 [3]. 즉, 정상세포에는 낮은 세포독성을 가지면서 종양세포에는 높은 특이성을 가져 암세포에만 선택적으로 작용하여 성장을 억제하거나 사멸시킨다. 따라서, 항균활성과 면역 활성화로 수술과 치료과정 중 발생할 수 있는 미생물 감염을 예방하고, 치료과정에서 손상된 세포의 재생효과를 기대할 수 있어 새로운 개념의 항암물질로 주목받고 있다 [5,6] (표1). 게다가, 항균 펩타이드는 아미노산으로 이루어져 있어 합성이 쉽고, 다양한 화학적 개량을 통한 구조변화로 기능개선이 용이하며, 리포솜이나 나노 파티클을 이용한 캡슐화로 체내 안정성을 증가시키는 것도 가능하여 부작용에서 자유로운 항암제 후보 물질 개발 가능성이 높다 [3] (그림2). 이러한 이유로 사람뿐만 아니라 다양한 동식물 유래의 저분자 단백질인 항균 펩타이드를 이용한 암 치료 물질 개발 연구가 활발히 진행되고 있다.
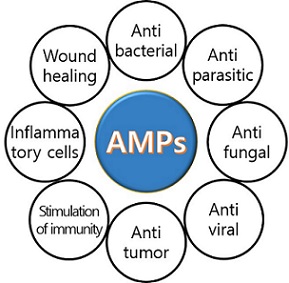
그림 1. 항균 펩타이드의 다기능성.
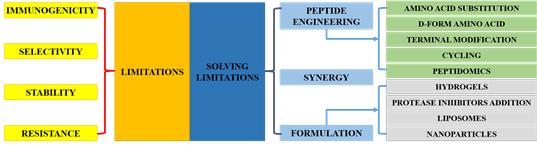
그림 2. 항균, 항암 활성 펩타이드의 개발 한계와 해결방안 [3].
구조적 특징으로 인한 항균 활성과 항암 활성을 동시에 가지는 펩타이드
항균 펩타이드가 항균활성과 항암활성을 가지는 이유와 작용 메카니즘은 구조적인 특징에 있다. 항균·항암 활성을 가지는 항균 펩타이드들은 공통적으로 양전하(positive charge)를 띠는 아미노산인 아르기닌(Arg) 또는 라이신(Lys)을 많이 포함하고 있어 전체적으로 양전하(+2~9)를 띠고 있으며, 극성(polar)과 비극성(non-polar)을 동시에 가지는 양친매성 특징을 가진다 [3]. 따라서 인지질(phospholipid)로 인해 음전하를 띠고 있는 미생물의 세포막에 부착하여 α-나선구조(α-helix) 또는 β-병풍구조(β-sheet)를 형성하고 carpet-like 모델, barrel-stave 모델, 또는 toroidal-pore 모델 기작을 통해 세포막을 파괴하거나 교란하며 미생물 세포내로 들어가 DNA, RNA 및 단백질 합성을 저해하여 미생물을 사멸시키기 때문에 내성을 가지는 미생물의 발생 우려가 적다 [4]. 또한 이러한 구조적 특징과 작용 메카니즘을 가지는 저분자 단백질은 돌연변이 암세포가 가지는 세포막 구조와 세포막에 존재하는 성분(대표적으로 phosphatidylserine (POPS) 등으로 음전하를 띠는 인지질이며 암세포에 더욱 높은 비율로 분포함)에 특이적으로 작용함으로써 암세포만의 선택적 구별 후 세포막을 교란시키거나, 세포막을 통과한 후 암세포 내에서 단백질 합성을 방해, 또는 미토콘드리아막에 파괴하여 암세포를 죽이거나 성장을 억제하는 것으로 밝혀졌다 [3,5,7] (그림 3). 이러한 항균·항암 활성을 동시에 가지는 저분자 단백질은 활용 가능 분야가 다양할 것으로 평가되고 있으며 특히 항암제와 같은 의약품 산업에는 파급효과가 클 것으로 기대한다.
표 1. 항암 활성을 가지는 대표적인 항균 펩타이드 [3,5]
돌돔 유래 저분자 단백질, 대장암 세포 억제력 뛰어나
국립수산과학원은 항균활성과 항암활성을 동시에 가지는 저분자 단백질 개발을 위해 어·패류와 갑각류 등과 같은 수산물 및 수산 부산물에서 항균 펩타이드를 연구하였다 [8-10]. 기존의 항균 펩타이드 연구방법인 항균활성 기반의 크로마토그래피 분석으로 항균 펩타이드를 정제하고 질량분석과 말단아미노산 서열분석으로 동정하는 방법과 함께 최근에는 수산생물의 유전체 정보를 분석하여 활성물질을 예측하고 효능을 검증하는 정보기반의 연구방법을 구축하였다. 또한, 이렇게 개발한 다양한 후보 항균 펩타이드의 양친매성 증가, 아미노산 잔기 치환, 이성질체 치환, 항균 펩타이드의 말단변이, 펩티도미메틱(peptidomimetics) 기술을 활용한 펩토이드(peptoid) 연구 등의 개량연구를 통하여 항균 활성 (activity)과 안정성(stability)은 증가하고 세포독성(cytotoxicity)은 감소한 다양한 유도체들을 개발하여 산업적 활용 가능성을 평가하였다. 현재 돌돔 유전체 정보를 활용하여 항균 펩타이드를 확보하였으며, 개량연구를 통하여 세포독성이 감소하고 항암효과를 가지는 유도체를 개발하였다. 또한 세포실험(in vivo)을 통해 대장암 성장 억제 효능을 확인하였으며, 실험쥐를 이용한 동물실험에서 안전성을 확인하였다. 특히 실험쥐에 사람의 대장암 세포를 이식한 후(xenograft 모델) 개발한 항균·항암 펩타이드를 처리하였을 때 처리 하지 않은 대조구에 비해 암세포 성장이 약 80% 이상 억제되는 것이 확인되어 항암 후보 물질로 개발 가능성을 제시하였다. 게다가 돌돔 유래 항균·항암 활성 펩타이드는 기존의 병원성 미생물과 함께 다양한 항생제 내성균주에도 강한 항균 활성을 가지고 있어 항암 및 항균 활성을 동시에 가지는 다기능성 치료물질 개발이 가능할 것으로 판단된다.
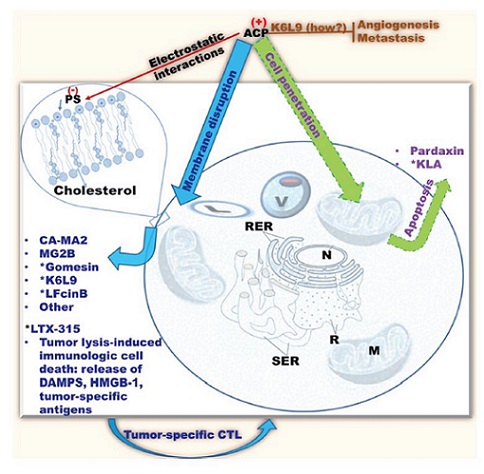
그림 3. 항균 펩타이드의 항암 활성 작용 기작 [5].
다기능성 펩타이드 연구를 통한 산업적 활용
최근 연구를 통해 항균 펩타이드의 더욱 다양한 기능성이 밝혀져 항균·항암 활성 외 항기생충, 항곰팡이 활성 및 항염증 활성 등을 가지는 펩타이드 소재 개발을 위해 국립수산과학원에서는 돌돔, 굴, 참담치 등의 수산양식 어패류를 대상으로 다기능성 펩타이드 개발연구를 수행하고 있다. 확보한 다기능성 펩타이드들은 특허와 논문 및 국가연구개발 우수성과에 선정되는 등 기술적 독창성과 우수성을 인정받은 바 있다. 향후 항암 효과를 나타내는 주요 표적과 관련 항암작용 기작 연구를 통해 항균 펩타이드를 활용한 항암 후보 물질 개발 연구를 수행 중이며, 동시에 산업적 다각화를 통한 의약용, 식품 첨가용 및 화장품 소재의 개발 등 항균 펩타이드의 다양한 활용이 기대된다.
참고문헌
1. Boopathi, V., Subramaniyam, S., Malik, A., Lee, G., Manavalan, B. and Yang, D.C. MACPpred. (2019) A support vactor machinebased meta-predictor for identification of anticancer peptides. Int. J. Mol. Sci. 20, 1964.
2. Kakde, D., Jain, D., Shrivastava, V., Kakde, D. and Patil, A.T. (2011) Cancer therapeutics-Opportunities, challenges and advance in drug delivery. J. Appl. Pharm. Sci. 1, 1-10.
3. Yamil, L., Jose, O.G. and Jean, P. D. (2020) Peptides with dual antimicrobial-anticancer activity: Strategie to overcome peptide limitations and rational design of anticancer peptides. Molecules. 25, 4245.
4. Pasupuleti, M., Schmidtchen, A. and Malmsten, M. (2012) Antimicrobial peptides: key components of the innate immune systems. Critical Reviews in Biotechnol. 32, 143-171.
5. Deslouches, B. and Di Y.P. (2017) Antimicrobial peptides with selective antitumor mechanisms: prospect for anticancer applications. Oncotarget. 8, 46635-46651.
6. Tornesello, A.L., Borrelli, A., Buonaguro, L., Buonaguro, F.M. and Tornesello, M.L. (2020) Antimicrobial peptides as anticancer agents: Functional properties and biological activities. Molecules. 25, 2850.
7. Gaspar, D., Veiga, A.S. and Castanho, M.A.R.B. (2013) From antimicrobial to anticancer peptides. Front. Microbiol. 4, 294.
8. Seo, J.K., Kim, D.G., Lee, J.E., Park, K.S., Lee, I.A., Lee, K.Y., Kim Y.O. and Nam, B.H. (2021) Antimicrobial activity and action mechanisms of Arg-rich short analog peptides designed from the C-terminal loop region of American Oyster Defensin(AOD). Mar. Drugs. 19, 451.
9. Oh, R., Lee, M.J., Kim Y.O., Nam B.H., Kong, H.J., Kim, J.W., park J.Y., Seo, J.K. and Kim D.G. (2020) Myticusin-beta, antimicrobial peptide from the marine bivalve, Mytilus coruscus. Fish Shellfish Immunol. 99, 342-352.
10. Nam, B.H., Park, E.H., Shin, E.H.,Kim, Y.O., Kim, D.G., Kong, H.J., Park, J.Y. and Seo, J.K. (2019) Development of novel antimicrobial peptides derived from antiipopolysaccharide factor of the swimming crab, Prtunus trituberculatus. Fish Shellfish Immunol. 84, 664-672.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 

