| 메르스 체외진단용 의료기기의 개발 동향 | |
|---|---|
| Date 2017-04-01 15:49:53 |
|

교수
연세대학교 생명공학과
yr36@yonsei.ac.kr
지난 2015년 대한민국을 공포에 휩싸이게 한 메르스 사태와 같은 고위험성 신·변종 바이러스 감염병으로 인해 전 세계적으로 수많은 사망자가 양산되었으며, 국내 역시 바이러스의 안전지대가 아님이 증명되었다. 이처럼 해외 신·변종 바이러스의 국내 유입 사례가 늘고 확산 가능성이 대두함에 따라 감염병의 효율적인 대응을 위해 정확하며 안전한 체외진단용 의료기기의 사용이 필요하게 되었다. 본 기획특집에서는 국내·외 메르스 발생 현황과 메르스 체외진단용 의료기기의 연구개발 동향을 소개하고자 한다.
메르스 발생 현황
신종 호흡기 감염병인 메르스(MERS)는 중동호흡기증후군(Middle East Respiratory Syndrome)의 줄임말로 베타코로나바이러스(Betacoronavirus)의 한 종인 메르스 코로나바이러스(MERS-CoV)에 의해 발생한다. 원래 박쥐에 숙주로 존재하던 MERS-CoV는 낙타로 옮겨진 뒤 낙타를 통해 사람에게 전염된 것으로 추정된다. 감염경로는 아직 불확실하지만 사람 간 밀접 접촉 시 비말(기침, 콧물 등 호흡기분비물)에 의해 바이러스가 전파되는 것으로 알려져 있다. 증상은 감염 시 기침, 고열이 나타나며 호흡곤란이 일어나기도 하고, 만성질환자 혹은 면역저하자의 경우에는 다발성 장기 부전으로 사망에 이르기도 한다.
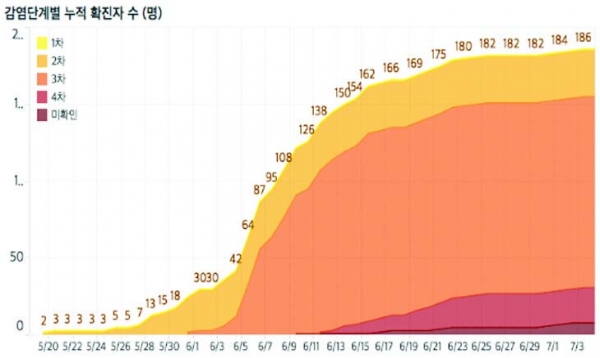
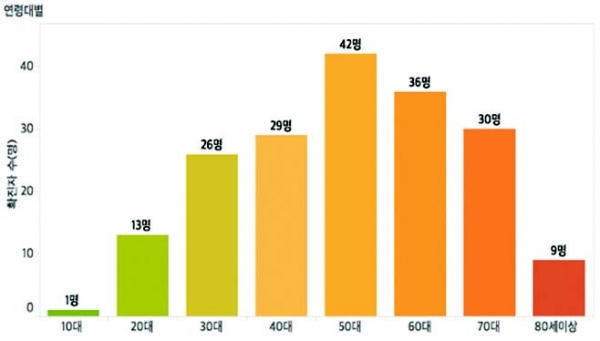
그림 1. 감염단계별(좌) 및 연령대별(우) 국내 메르스 확진자 수 (출처: KBS)
국가별 메르스 발생 현황의 경우, 국내 공식 감염자 수는 현재 세계 2위로 비중동 국가 중에서는 1위이다. 2015년 5월 국내 최초의 메르스 확진 환자 발생 이후 감염 단계별 국내 누적 확진자 수는 186명이며, 이 중 38명이 숨지고(치사율: 20.4%) 1만 6천여 명이 격리되었다. 메르스 확진 감염자는 대부분 면역저하자인 고연령층과 만성질환자였으며, 실제 메르스로 인한 사망자의 대부분을 차지하였다(그림 1). 국내 메르스 사태 당시, 정확하고 신속한 진단 및 치료에 대한 긴급한 대책이 요구되었으나 메르스 체외진단용 의료기기에 대한 국내 허가·심사 평가 기준이 불명확한 상황이었다. 이에 질병관리본부는 세계보건기구(WHO)가 제안한 MERS-CoV 체외진단 기준에 따라 메르스 감염 여부를 판단하였고 ‘긴급사용승인’이라는 식품의약품안전처 허가 범위를 초과한 명목으로 체외진단용 의료기기를 사용하였다.
메르스 체외진단용 의료기기 시장 현황
국내 의료기기 시장의 규모는 약 5.3조 원(2015년 기준)이며, 이 중 체외진단용 의료기기가 차지하는 비중은 약 8.7%다. 국내 인구의 고령화로 인하여 건강 증진에 대한 관심이 확대됨에 따라 최근 의료기기 산업의 규모가 증가하는 추세를 보인다. 특히, 2015년 메르스 사태 발생 이후, 고위험성 감염체의 체외진단용 의료기기 생산·수출액이 약 36.0% 증가하였다. 이러한 추세는 효과적인 체외진단 기술 연구를 통한 정확한 체외진단용 의료기기 개발의 중요성이 대두하였음을 시사하고 있다. 메르스 체외진단용 의료기기의 경우, 현재까지 개발된 제품 중 허가 및 긴급사용승인된 제품은 극소수로 미승인 제품이 대다수이며, 체외진단 기술은 대부분 유전자 검출 기반이다.
유전자 검출 기반 메르스 체외진단 기술 개발 동향 유전자 검출 기반의 분자적 체외진단 기술은 환자로부터 추출된 MERS-CoV RNA의 특이유전자 부위를 실시간 역전사 중합효소연쇄반응(Real-time RT-PCR; rRT-PCR)을 통해 증폭시켜 감염 여부를 확인할 수 있게 하는 핵산증폭검사(Nucleic Acid Amplification Test; NAAT)에 의한 기술이다.
유전자 검출 기반 메르스 체외진단 기준
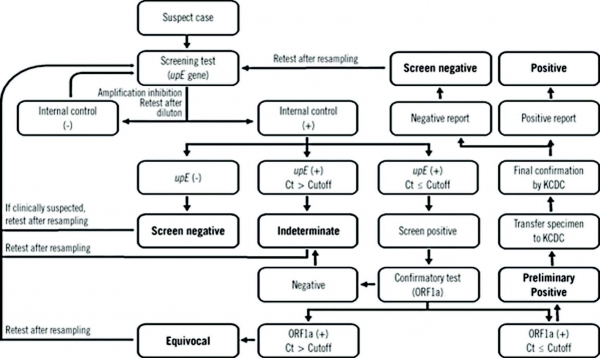
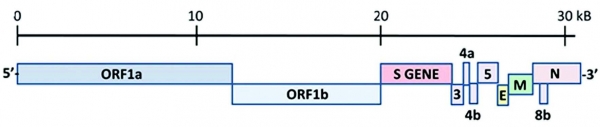
질병관리본부에서는 세계보건기구에서 공시한 메르스 체외진단 지침에 따라 rRT-PCR을 통하여 메르스 감염여부를 판단한다(그림 2). MERS-CoV의 유전체는 단일 가닥(single-stranded) RNA로 이루어져 있으며 약 30,100개의 염기를 가지는데, 이 중 특정한 유전자 부위의 검출을 통한 두 가지의 기준에 의하여 메르스 감염을 진단한다(그림 3). MERS-CoV의 특이유전자 upE(upstream of E gene), ORF1a(Open Reading Frame 1a), ORF1b, N(Nucleocapsid) 중 upE 유전자를 포함한 두 가지 이상의 유전자를 rRT-PCR로 정량분석하여 두 가지 모두 양성으로 확인될 시 감염을 확진한다. 또는 upE 양성결과와 RdRp(RNA-dependent RNA Polymerase)나 N의 염기서열 확보 시 감염을 확진한다.
그림 2. 질병관리본부의 MERS-CoV 체외진단 알고리즘 (출처: 참고문헌)
그림 3. MERS-CoV의 유전체 모식도 (출처: 참고문헌)
유전자 검출 기반의 메르스 체외진단용 의료기기
유전자 검출 기반의 메르스 체외진단용 의료기기는 환자의 호흡기 검체로부터 추출된 MERS-CoV의 유전물질을 사용하여 메르스 감염 여부를 확인할 수 있는 검사시약이다. MERS-CoV의 RNA를 rRT-PCR을 통해 cDNA(Complementary DNA)로 변환시킨 후, 검출하고자 하는 메르스 특이유전자에 프라이머(Primer)와 DNA중합효소를 적용하여 표적 유전자를 증폭시킨다. 유전자 증폭과 동시에 상보적인 형광 프로브(Probe)를 결합시켜 프로브의 형광신호도 함께 증가하도록 하여 형광신호의 세기가 기기의 검출한계에 도달했을 때의 PCR Cycle 수(Ct값)를 측정하여 민감도를 분석한다. 검체 내 메르스 특이유전자의 초기 농도에 따라 Ct 값이 비례하므로 표적 유전자의 유무와 양에 대한 분석이 가능하다.
현재까지 개발되어 시판되고 있는 유전자 검출 기반의 메르스 체외진단용 의료기기의 경우에는 메르스의 특이유전자인 upE, ORF1a 또는 ORF1b를 동시 또는 분리 검출하도록 설계된 것이 가장 일반적이다. 제품화된 메르스 체외진단용 의료기기는 제조사마다 rRT-PCR 방법의 차이(일반적인 PCR 전용 튜브, 랩온어칩), 표적 유전자의 차이(upE,ORF1a, ORF1b), 유전자 검출방법의 차이(동시 또는 분리 검출), 측정 방법의 차이(형광의 종류), 분석 장비의 차이(자사 개발 장비, 일반 공용 장비)에 따른 진단 기술력이 다르며, 민감도 및 진단 소요시간 또한 다르다.
현재 국내의 경우 메르스 체외진단용 의료기기(PowerChek™ 메르스 진단키트, ㈜코젠바이오텍) 1개가 식품의약품안전처로부터 정식 허가를 받은 상태이다. 해당 의료기기는 메르스 사태 당시 국내에서 최초로 ‘긴급사용승인’을 받은 제품으로, 당시 정식 허가를 받은 메르스 진단 제품이 국내에 존재하지 않았기 때문에 질병관리본부와 공동 연구에 의해 개발되었던 해당 제품이 메르스 검진에 사용되었다. 세계보건기구에서 권유된 특이유전자 부위(upE와 ORF1a)를 동시에 검출하도록 설계되었으며, 한 개의 유전자씩 분리된 검출 시약을 사용할 때와 동일한 성능을 유지하며 진단시간을 약 2시간으로 단축한 것이 특징이다. 국내에서 임상시험을 완료하여 성능에 대한 안전성과 유효성 또한 검증되었다. 이외에도 환자의 검체에서 MERS-CoV RNA 추출부터 검사까지 별도의 피펫 작업 없이 자동수행으로 이루어져 사용자 편리성과 검사 재현성이 뛰어난 검사 시약(AccuPowerⓇ 메르스 진단키트, ㈜바이오니아)과 메르스 포함 총 16종 호흡기바이러스에 대해 동시 검출이 가능한 검사 시약(DiaPlexQ™ RV16 진단키트, ㈜솔젠트), 랩온어칩 기반의 기술을 적용하여 소량의 시료만을 사용하며 진단시간을 40분까지 획기적으로 단축한 검사 시약(UltraFastⓇ LabChip 메르스 진단키트, ㈜나노바이오시스) 등의 메르스 체외진단용 의료기기가 현재 허가·심사 단계에 있다.
메르스의 조기 확산을 방지하기 위해서는 신속하고 정확한 체외진단 기술이 요구된다. 그러나 유전자 검출 기반 기술의 경우 정확성이 높지만, 확진을 위해 걸리는 시간이 길어 신속성 측면에서 개선이 필요하다. 또한, 전염의 확산 가능성을 낮추면서도 간단하고 다양한 플랫폼 유전자 검출 기반의 진단 기술이 필요하다. 유전자 검출 기반 체외진단 기술은 한정된 국가지정연구기관에서 이루어지기 때문에 환자 검체의 이동과정에서 많은 시간이 소요되므로 이를 최소화하는 방안도 요구된다.
항원·항체 기반의 메르스 체외진단 개발 동향
항원·항체 기반의 면역적 진단 기술은 형광물질, 효소 등으로 표지된 항체 또는 재조합된 항원을 이용하여 바이러스를 직접 또는 간접적으로 검출하는 원리이며, 효소결합면역흡착법(ELISA), 바이러스중화법, 면역형광법 및 면역크로마토그래피법 등을 이용한 혈청검사를 통하여 진단하는 기술이다.
항원·항체 기반의 메르스 체외진단 기준
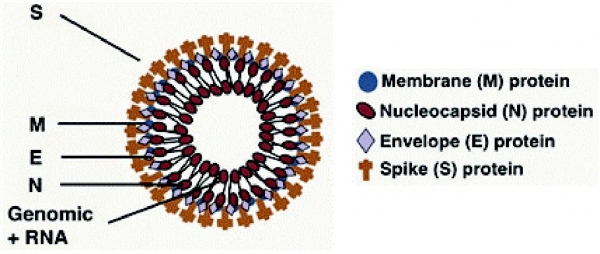
항원·항체 기반의 메르스 체외진단의 경우, 세계보건기구가 권고한 기준에 따라 두 가지 진단 기준을 통하여 메르스 감염 여부를 판단한다. 첫 번째 방법은 한 가지 이상의 혈청검사를 통하여 환자의 혈청 내 MERS-CoV의 구조 내특이적인 단백질 S(Spike) 또는 N(Nucleocapsid) 등의 항원 또는 항체가 검출될 경우, 최소 2주 간격으로 채취된 1개이상의 검체에서 바이러스중화법에 의해 동일하게 2차에서도 확인이 되면 메르스 감염을 확진하는 것이다(그림 4). 두번째 방법은 오직 1개의 검체에서 바이러스중화법에 의한 양성검출이 이루어질 경우, 추가로 rRT-PCR을 통한 유전자검출 기반의 분자적 진단의 양성결과가 확보되면 감염을 확진하는 것이다.
그림 4. MERS-CoV의 단백질(항원) 구조 (출처: 참고문헌)
항원·항체 기반의 메르스 체외진단용 의료기기
항원·항체 기반의 메르스 체외진단 의료기기의 경우, 샌드위치 ELISA 기법을 이용하고 MERS-CoV의 현장진단이 가능한 면역크로마토그래피법 기반의 제품 및 재조합된 MERS-CoV의 N 단백질 항원을 사용하여 간접 ELISA 기법을 통해 MERS-CoV 항체를 검출할 수 있는 제품이 개발되었다. 또한, 면역형광법 기반 및 단백질 마이크로어레이(Microarray) 기반의 MERS-CoV 항체 검출을 통한 메르스 진단 기술에 대한 수많은 연구결과가 보고되었다. 현재 국내에는 항원·항체 기반의 바이러스 진단 기술을 이용하여 개발된 인체 용도의 메르스 체외진단용 의료기기는 개발 및 제품화 단계에 있으나, 아직 상용화된 제품은 없다.
항원·항체 기반의 진단 기술에 의한 메르스 체외진단용 의료기기는 유전자 검출 기반보다 진단 소요시간이 매우 짧고 특이도가 더욱 우수한 장점이 있지만, 민감도가 낮은 문제가 있어 이에 대한 개선이 필요하다. 메르스의 신속한 현장진단기술이 절실히 필요한 실정이므로 면역크로마토그래피법을 사용하는 임신 테스트기처럼 간편한 스트립(Strip)형의 메르스 체외진단용 의료기기의 개발 및 상용화가 요구된다. 이를 이용하여 메르스 감염에 대한 즉각적인 현장진단을 먼저 내린 후, 추가적인 유전자 검출 기반의 체외진단을 통하여 정확한 확진을 내리는 것이 가능할 것으로 보인다. 또한 민감도를 증가시키기 위하여 새로운 기술 및 소재와의 융합적 시도와 연구가 필요해 보인다.
차세대 바이러스 체외진단 기술
기존의 유전자 기반, 항원·항체 검출 기반의 메르스 체외진단 기술 이외에 다양한 바이러스 체외진단 기술에 대한 연구개발이 활발히 진행되고 있다. 대표적으로 최근 주목받고 있는 신소재(핵산 앱타머, 무기 나노소재) 기반 및 신기술(Lab-on-a-chip, SERS) 기반의 차세대 바이러스 체외진단 기술이 있다.
신소재 기반 기술 중 핵산 앱타머 기반의 바이러스 진단 기술은 핵산 앱타머를 사용함으로써 표적 물질을 특이적으로 인식할 수 있으므로 향후 항체를 대체하는 진단 소재가 될 것으로 전망된다. 무기 나노소재 기반의 바이러스 진단기술은 무기 나노소재의 작은 크기와 높은 전자이동도로 인해 신호검출 감도가 우수하다. ELISA 기법과 비슷하지만, 발색 효소 대신 금속나노물질이 붙은 항체를 사용한다. 금속나노물질이 부착된 항체와 시료를 반응시킨 후 질량분석기를 통과하게 되면 플라스마(Plasma) 상태가 되어 이때 생성되는 이온화 양을 측정할 수 있다. 기존의 ELISA 기법은 한 개의 항원만 검출 가능하였지만, 금속나노물질의 종류에 따라 다양한 항원을 한 번에 검출할 수 있어 메르스를 포함한 다중 바이러스를 검출할 수 있을 것으로 기대된다.
신기술 기반 기술 중 랩온어칩(Lab-on-a-chip) 기술이란 작은 크기의 칩에서 실험실 연구를 가능하게 만든 미세회로장치 기반의 기술이다. 극미량의 시료만으로도 진단 및 분석을 신속하게 진행할 수 있다는 장점이 있으므로 차세대진단 및 분석 장치로 주목받고 있다. 앞으로는 랩온어칩을 사용하여 병원에 가지 않고도 가정 또는 현장에서 바로 진단할 수 있는 제품이 나올 것으로 기대된다. 표면증강라만분광법(Surface Enhanced Raman Spectroscopy; SERS)은 광학 신호의 밴드 폭이 매우 좁은 라만 산란 신호가 수백 가지 이상의 표적 물질을 다중 검출할 수 있는 프로브로 활용되며 무기 나노입자의 표면처리를 통해 신호를 증강함으로써 높은 민감도의 측정이 가능하다. SERS 기술은 환자조직 및 인체에서 수십부터 수백 개의 표적 물질을 동시에 검출할 수 있어 다중 바이러스 검출 기반의 체외진단용 의료기기를 개발하는 데 사용될 수 있다.
메르스 체외진단용 의료기기 개발의 한계점
메르스 체외진단용 의료기기를 통한 신속하고 적절한 대응을 위하여 과학적이고 정확한 안전성·유효성 평가기술 개발 및 허가ㆍ심사를 위한 가이드라인 구축이 시급하다. 또한, 평가에 필요한 MERS-CoV 시료에 대한 확보 및 취급 방안의 미비로 인하여 메르스 체외진단용 의료기기 개발에 한계가 있으므로 이에 대한 적절한 방안이 필요해 보인다.
메르스 체외진단용 의료기기 평가 가이드라인 필요
고위험성 및 고전염성인 메르스에 대한 확산 방지와 신속한 대응을 위하여 메르스 체외진단용 의료기기 허가·심사를 위한 안전성·유효성 평가 시 국제적으로 조화된 항목들이 요구된다. 유사 호흡기 바이러스 가이드라인과 국제규격을 참조하여 볼 때, 분석적 민감도(Analytical sensitivity), 분석적 특이도(Analytical specificity), 정밀도(Precision), 정확도(Accuracy), 임상적 민감도(Clinical sensitivity), 임상적 특이도(Clinical specificity)가 안전성·유효성 평가를 위한 대표적인 평가항목으로 선정되기에 적합해 보인다. 특히, 메르스 체외진단용 의료기기의 거짓양성(false-positive) 또는 거짓음성(falsenegative) 결과는 피검사자 및 사회 전반에 매우 큰 영향을 끼칠 수 있으므로 감염 여부를 진단하면서 정확성이 보장되어야 한다. 따라서 메르스 체외진단용 의료기기의 평가에 있어서 민감도와 특이도에 대한 엄격한 규제가 필요하다고 판단된다.
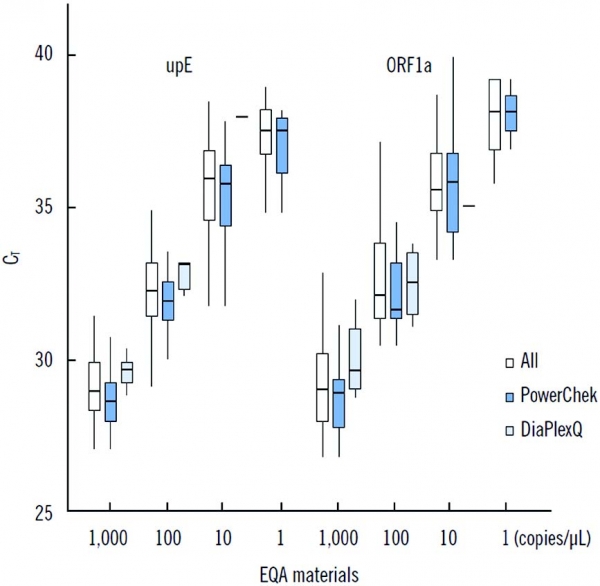
그림 5. 메르스 진단제품별 메르스 RNA 농도에 따른 민감도 (출처:참고문헌)
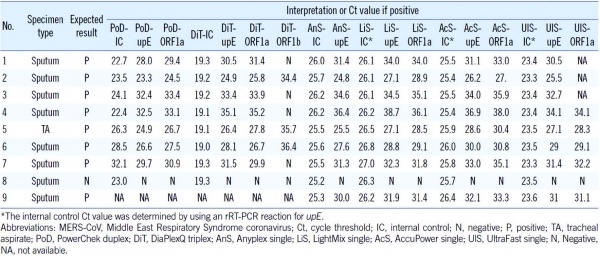
분석적 민감도는 분석 대상 물질의 양의 변화에 따른 측정값 변화에 대한 비율로 정의하는데, 제조사 별로 유전자 기반의 메르스 체외진단용 의료기기의 분석적 민감도를 측정한 결과, 표적 유전자 종류, 유전자 검출방법, 측정방법, 사용하는 분석 장비 등에 따라 진단 기술력의 차이를 확인할 수 있다(그림 5). 이와 함께, MERS-CoV의 수용체로 알려진 DPP4(Dipeptidyl peptidase 4)는 비섬모 기관지 상피세포에 발현되기 때문에 상기도 검체보다 하기도 검체인 기관지 폐포세척액, 가래(Sputum) 및 기관흡인액(Tracheal aspirate; TA)에서 가장 많은 바이러스가 검출된다고 알려져 있다. 사용된 검체의 채취 부위에 따라 존재하는 MERS-CoV의 RNA 양이 다르므로 메르스 체외진단용 의료기기의 민감도는 검체의 채취 부위에 따라 차이가 있을 수 있다(그림 6). 현재 세계적으로 메르스를 비롯한 여러 신·변종 바이러스 감염 질환의 진단을 위해 다양한 신소재 및 신기술이 적용된 차세대 기술 기반의 체외진단용 의료기기에 대한 연구개발도 활발히 진행되고 있으므로, 메르스 체외진단용 의료기기의 기술적인 차이점 및 시료 종류의 차이점 등을 적절히 고려한 메르스 체외진단용 의료기기 안전성·유효성 평가 및 허가·심사 가이드라인 구축이 필요해 보인다.
그림 6. 메르스 진단제품별 메르스 검체의 채취 부위에 따른 민감도 (출처: 참고문헌)
메르스 코로나바이러스 시료 확보방안 필요
메르스 체외진단용 의료기기에 대한 각 평가항목에 대하여 과학적이고 정확한 평가가 이루어져야 하므로 이에 필요한 메르스 표준시료 및 메르스 감염 임상검체가 충분히 확보되어야 한다. 국내에서 발병된 메르스의 경우 유병률이 매우 낮아 임상적 양성검체 확보가 극히 어려우며, 전염성이 매우 높은 고위험성으로 인해 시료확보가 제한적이라는 문제가 있다. 또한, 메르스 체외진단용 의료기기의 허가·심사에 필요한 적절한 안전시설을 갖춘 시험기관의 부재는 임상적 성능시험 결과를 도출하는데 큰 걸림돌이 되고 있다. 현재 상황에서는 기술적으로 뛰어난 체외진단용 의료기기가 개발되어도 식품의약품안전처로부터 허가를 받지 못해 제품화 및 상용화가 되지 못하는 상황이 초래될 수 있다.
메르스와 같은 감염병에 효율적인 대처하기 위해서는 국가 차원의 다양한 제도적 장치가 필요하다. 실제 고위험성, 비배양성 등과 같은 특수성을 지닌 바이러스의 체외진단용 의료기기의 경우 제품 허가 및 심사에 상당한 제약이 뒤따른다. 예를 들어 자궁경부암을 유발하여 고위험군 바이러스로 분류되는 인유두종바이러스 (Human Papillomavirus; HPV)의 경우, HPV의 특성상 배양이 불가능하므로 임상검체 확보가 제한적이어서 분석적 및 임상적 성능 평가를 수행하는데 제약이 있다. 따라서 미국 FDA에서는 HPV의 임상검체를 대체하는 시료로 재조합 등에 의한 인위적인 검체의 사용도 가능하게 한다. 이처럼 메르스 임상검체의 경우에도 국가적 차원에서의 대체 임상검체 확보를 위한 제도적 마련이 시급하다. 시설적 측면에서도 메르스 임상검체는 전염성과 치사율이 매우 높은 고위험성 감염체로 분류되기때문에 메르스 체외진단용 의료기기의 임상시험 평가를 수행할 수 있는 BSL-3 이상의 실험시설 및 장소에서 취급되어야 하지만 고가의 유지비용으로 인해 해당 시설이 매우 부족한 실정이다. 이에 국가적 차원에서 메르스 체외진단용 의료기기 평가를 위한 실험시설을 확충하여 원활한 허가·심사를 가능하게 하는 구체적인 방안도 필요하다.
결 론
우리나라의 21세기 주요 국책사업인 바이오 분야의 연구가 세계적인 성과를 도출하고 있는 상황에서, 주요 바이오산업 분야 중 하나인 체외진단용 의료기기 산업은 나날이 발전하고 있다. 국내 체외진단용 의료기기 산업의 지속적인 발전과 국제적으로 경쟁력을 확보하기 위해서는 국제 조화된 체외진단용 의료기기의 허가·심사를 위한 가이드라인 구축이 필요하다. 국가 차원의 제도적 개선과 지원을 통해 국내 바이러스 체외진단용 의료기기 산업의 발전을 기대해 본다.
감사의 글
본 내용은 2016년도 식품의약품안전처의 메르스 진단용 의료기기의 안전성·유효성 평가기술 개발 연구(16172MFDS359) 수행을 통해 도출된 내용이며 이에 감사드립니다. 또한 본 연구에 많은 도움을 주신 전문가협의체 참여위원들께 감사드립니다.
참고문헌
1. Scobey T. et al. Reverse genetics with a full-length infectious cDNA of the Middle East respiratory syndrome coronavirus. PNAS.2013;110(40):16157-16162.
2. Kim Y. J. et al. Complete genome sequence of Middle East respiratory syndrome coronavirus KOR/KNIH/002_05_2015, isolated in South Korea. Genome Announc. 2015;3(4):e00787-15.
3. Raj V. et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature. 2013;495(7440):251-254.
4. Drosten C. et al. Clinical features and virological analysis of a case of Middle East respiratory syndrome coronavirus infection. The Lancet. 2013;13(9):745-751.
5. Guery B. et al. Clinical features and viral diagnosis of two cases of infection with Middle East respiratory syndrome coronavirus: a report of nosocomial transmission. The Lancet. 2013;381(9885):2265-2272.
6. Memish Z. et al. Respiratory tract samples, viral load, and genome fraction yield in patients with Middle East respiratory syndrome. J Infect Dis. 2014;210(10):1590-1594.
7. Kapoor M. et al. Clinical and laboratory findings of the first imported case of Middle East respiratory syndrome coronavirus (MERS-CoV) into the United States. Clin Infect Dis. 2014;59(11):1511-1518.
8. Corman V. et al. Detection of a novel human coronavirus by real-time reverse-transcription polymerase chain reaction. Eurosurveillance. 2012;17(39):20285-20291.
9. Corman V. et al. Assays for laboratory confirmation of novel human coronavirus (hCoV-EMC) infections. Eurosurveillance. 2012;17(49):20334-20343.
10. Laboratory testing for Middle East respiratory syndrome coronavirus (MERS-CoV): Interim guidance, World Health Organization. 2015.
11. Ki C. S. et al. Korean Society for Laboratory Medicine Practice Guidelines for the Molecular Diagnosis of Middle East Respiratory Syndrome During an Outbreak in Korea in 2015. Ann Lab Med. 2016;36(3):203-208.
12. Kim M. N. et al. Analytical and Clinical Validation of Six Commercial Middle East Respiratory Syndrome Coronavirus RNA Detection Kits Based on Real-Time Reverse-Transcription PCR. Ann Lab Med. 2016;36(5):450-456.
13. Seong M. W. et al. External Quality Assessment of MERS-CoV Molecular Diagnostics During the 2015 Korean Outbreak. Ann Lab Med. 2016;36(3):230-234.
14. 2015년 의료기기 생산, 수출입 실적 통계 자료, 식품의약품안전처 2016.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update