| 효소-기질 특이성 개량을 통한 셀룰로오스 기반 바이오매스 유도체의 신규 생물학적 전환시스템 개발 | |
|---|---|
| Date 2017-04-01 17:28:28 |
|

교수
강릉원주대학교 생명화학공학과
yjyeon@gwnu.ac.kr
1. 서론
2010년 3월, 서울대학교 화학생명공학부에서 박사학위 과정을 시작하면서 지도교수님(유영제 교수님)과 연구주제를 정하기 위해 상의를 하고 있었다. 나는 2002년도에 동 대학원 연구실에서 석사학위를 마친 후 LG화학, 제일모직 등의 산업체 연구소에서 근무를 하다가 2010년에 퇴직을 하고 34살의 나이에 다시 학교로 돌아와 박사학위를 시작한 상태였다. 개인적으로는 다른 학생들과 비교해서 늦은 나이에 새로운 도전을 하는 상황이었기 때문에 걱정과 기대감을 함께 갖고 있던 시기였다. 당시 우리 연구실의 주된 연구 방향은 단백질공학을 적용하여 효소의 산업적 적용 가치를 높이는 것이었다. 또한 나는 산업체 연구소에서 주로 고분자/플라스틱 관련 화학공정 개발 연구를 해왔었기 때문에 이러한 회사생활에서의 경험을 박사과정 연구에 도입할 수 있으면 좋겠다고 생각하였다. 따라서, 생물공학적 반응공정을 이용하여 보다 환경 친화적이고 에너지 소비가 적은 공정을 개발하고, 이를 통해 부가가치를 지닌 화학물질을 생산하고자 하는 생각을 연구의 출발점으로 삼았다. 보다 구체적으로, 효소를 이용한 전환반응을 통해 새로운 산업용 고분자 및 바이오에너지의 원료를 만드는 연구를 하고자 하였으며, 기질에 해당하는 원료 물질로는 전분이나 당류보다 단가가 낮고 자연계에서 분포량이 많으며 식량으로 사용되지 않는 셀룰로오스 기반 바이오매스를 이용하여 연구를 진행하고자 하였다. 이러한 아이디어를 바탕으로 학위 과정의 최종 연구주제를 정하게 되었으며, 산화환원 효소의 기질 특이성을 개량하여 셀룰로오스로부터 얻어지는 레불린산(levulinic acid)을 환원시켜 C5 화합물에 해당하며 바이오플라스틱 및 바이오연료의 원료로 사용될 수 있는 4-hydroxyvaleric acid(4HV)를 생산하는 것에 대한 연구를 진행하게 되었다.
2. 본론
2.1 셀룰로오스 기반 바이오매스 유도체의 생물학적 전환공정의 개발의 필요성
산업바이오공학은 일반적으로 포도당이나 전분을 원료물질로 사용하여 생물학적 공정을 통해 산업적 가치를 지니는 화학물질 및 연료물질로 전환하는 방식으로 진행된다. 이러한 접근법은 석유기반 화학공정을 대체/보완하는 것을 목적으로 지구온난화, 환경오염, 에너지 절감 등의 효과를 얻을 수 있다. 그러나 원료 물질에 해당하는 포도당 및 전분의 사용은 인류의 식량문제와도 연관되어 있으며 또한 산업바이오공학의 발전으로 인해 곡물가격의 증가 문제가 대두됨에 따라 이들 원료의 가격 경쟁력 약화 또한 문제가 되고 있다. 이러한 측면에서 볼 때, 당류 물질보다 가격이 저렴하고 자연계 분포량이 많으며 식량문제로부터 자유로운 셀룰로오스 기반 바이오매스를 이용하는 접근법이 그 대안책으로 제시되고 있다. 생물학적 전환반응을 통해 셀룰로오스를 유용한 화학물질로 전환하는 연구의 일반적인 접근법은 셀룰라아제(cellulase) 효소를 이용하는 것이다. 즉, 셀룰라아제 효소로 셀룰로오스를 가수분해하여 미생물이 대사할 수 있는 저분자 형태의 포도당과 같은 당류로 만든 후, 후속 공정에서는 기존의 미생물/대사공학 및 생촉매공학적 연구 기법과 연결하여 산업적으로 유용한 생산물들을 만들어내는 방식이다. 따라서 셀룰라아제에 대한 연구는 전세계적으로 많은 관심을 받고 있으며 관련분야 연구자들이 활발히 연구를 진행하고 있다. 그러나 셀룰라아제의 적용이 실용화되기에는 아직까지는 높은 효소 생산단가 및 낮은 효소활성 등의 극복해야 할 문제들이 남아있다. 한편, 셀룰로오스 기반 바이오매스를 활용하고자 하는 노력은 생물공학 분야뿐만 아니라 화학촉매를 활용하는 분야에서도 활발히 연구를 진행하고 있다. 그 대표적인 예가 레불린산(levlunic acid)을 활용하는 것이다. 레불린산은 셀룰로오스를 황산 등의 산성 촉매를 매개로 반응시켜 비교적 쉽게 얻어질 수 있는 셀룰로오스 유도체로 그 활용도가 매우 높아 미국 DOE(Department of Energy)에서 TOP 플랫폼 화합물 중 하나로 선정된 화합물이다. 레불린산은 바이오플라스틱, 합성고무, 바이오연료, 의약품, 농약, 식품첨가물, 공업용 용매 등 다양한 분야에 걸쳐 유용한 형태의 화합물로 전환하여 사용될 수 있다. 레불린산을 셀룰로오스로부터 얻는 것은 셀룰라아제 효소처리를 통해 셀룰로오스를 활용하는 방식보다 공정이 간단하고 가격 경쟁력 측면에서 유리하기 때문에 실용화 단계에 보다 가까이 있다고 할 수 있다. 그러나 레불린산을 보다 유용한 형태의 물질로 전환하는 ‘생물학적 공정’에 대한 연구는 거의 이루어져 있지 않으며, 거의 대부분의 전환공정은 화학촉매반응을 통해 이루어지고 있다. 또한, 기존의 화학촉매공정은 대체로 고온/고압 및 유독한 산/염기 등의 용매를 사용하기 때문에 환경 문제 및 에너지 효율 측면에서 볼 때 바람직하지 않다. 이러한 기존 화학전환 방식의 단점을 극복하기 위해서는 레불린산의 생물학적 전환공정의 개발이 필요하며, 본 연구에서는 효소 및 단백질공학적 접근을 통한 레불린산 전환에 대한 연구를 진행하였다.
2.2 레불린산 활용을 위한 효소전환 시스템 선정
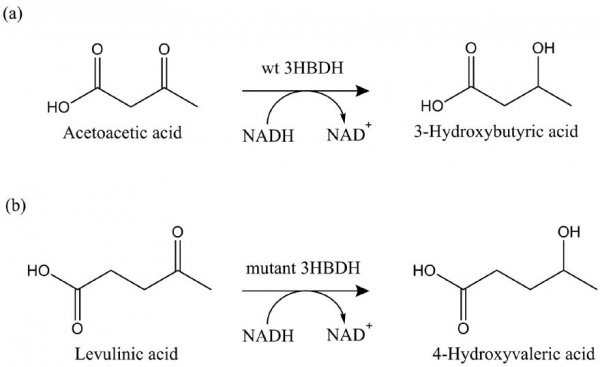
레불린산을 활용할 수 있는 생물전환 시스템을 구축하기 위해서는 레불린산의 화학구조를 살펴볼 필요가 있다. 레불린산은 5개의 탄소를 지닌 C5 화합물로 알파탄소 부위에 카르복시기를, 감마탄소 부위에 케톤기를 가지고 있다. 케톤기를 히드록시기로 환원시키면 레불린산이 4-hydroxyvaleric acid(4HV)로 전환되며, 이 전환된 물질은 카르복시기와 히드록시기를 동시에 지닌 C5 화합물로서 바이오 플라스틱의 단량체로 활용될 수 있다. 또한 카르복시기와 히드록시기를 축합반응을 통해 4HV를 락톤화 하면 차세대 바이오연료의 전구체인 gamma-valerolactone(GVL)로 전환될 수 있다. 이러한 아이디어를 바탕으로 본 연구에서는 효소반응을 통해 레불린산을 4HV로 전환하고자 하였다. 그러나 자연계에는 해당 반응을 촉매하는 효소는 알려진 바가 없었다. 따라서, 목표로 삼은 레불린산 전환반응을 위해서는 자연계의 효소를 개량하여 적용해야 했다. 이를 위해 목표 반응과 유사한 효소반응을 하는 자연계의 효소 중 산화환원 효소에 해당하는 3-hydroxybutyrate dehydrogenase(3HBDH)를 개량의 대상 효소로 선정하였으며, 이 효소의 기질특이성을 개량하여 레불린산을 4HV로 전환하는 연구를 진행하게 되었다(그림 1).
그림 1. 3HBDH 효소 개량을 통한 레불린산 (levulinic acid)의 4-hydroxyvaleric acid로의 전환 개요
2.3. 구조기반 효소-기질 특이성 개량
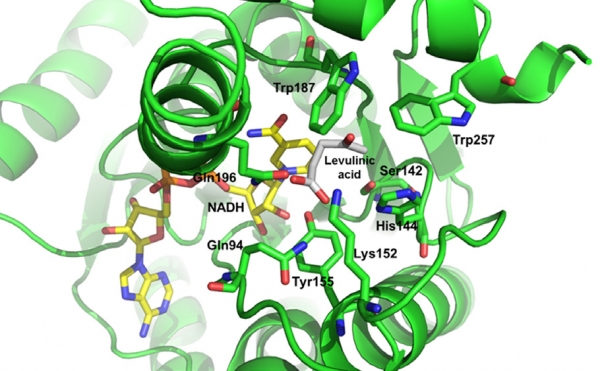
3HBDH 효소의 개량을 위해 구조분석을 통한 분자모델링을 진행하였다. 3HBDH의 3차원 구조(pdb: 3VDR)와 레불린산 구조의 분자도킹(molecular docking) 시뮬레이션을 통해 wild-type 3HBDH의 기질결합 부위에 레불린산이 결합한 형태를 구현하였으며(그림 2), intermolecular contact analysis 기법을 적용하여 효소의 기질결합 부위에 해당하는 아미노산 잔기들의 특성을 분석하였다.
그림 2. Molecular docking 시뮬레이션을 통해 구현된 3HBDH-levulinic acid 결합 구조
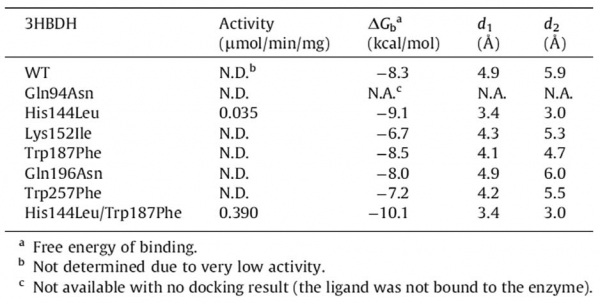
레불린산을 환원시키기에 보다 적합한 구조로 아미노산을 치환하기 위해 rational design 기법을 통해 치환될 아미노산을 선정하였으며, 결과적으로 Gln94Asn, His144Leu, Lys152Ile,Trp187Phe, Gln196Asn, Trp257Phe의 6개 mutant가 선정되었다 (표 1).
표 1. 3HBDH 기질결합 부위의 아미노산 치환 선정을 위한 rational design 전략
2.4 개량된 3HBDH의 레불린산에 대한 활성측정
Alcalegenes faecalis 유래의 3HBDH(EC1.1.1.30) 합성 유전자를 E. coli recombinant 시스템에서 발현하여 효소를 준비하였다. Site-directed mutagenesis 실험을 통해 6개의single mutant 효소들을 얻었으며, 레불린산에 대한 활성 테스트를 시행한 결과 His144Leu mutant만이 실질적인 활성을 나타내었다. His144Leu에 추가하여 나머지 5개mutation을 조합한 double mutant들을 만들어 동일한 테스트를 한 결과 His144Leu/Trp187Phemutant가 single mutant 대비 약 11배 향상된 specific activity를 보임을 확인하였으며, 최종 best mutant로 선정되었다(표 2).
표 2. 레불린산 환원반응을 위한 3HBDH 활성 테스트 및 docking구조 분석 결과
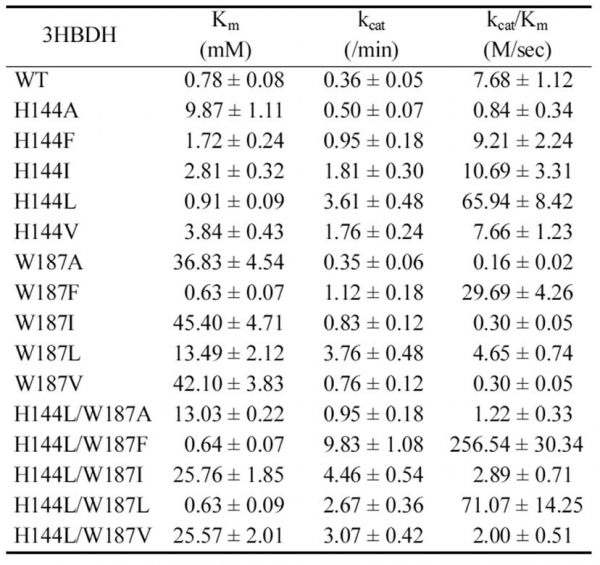
또한 His144와 W187부위에 추가적인 mutation을 도입하여 wild-type을 포함한 총 16개의 variant들에 대해 레불린산을 기질로 kinetic parameter를 분석하였다. 그 결과 앞서 테스트한 specific activity 결과와 마찬가지로 His144Leu/Trp187Phe mutant가 가장 높은 활성을 나타냄을 확인하였으며, wild-type 대비 33배 증가한 catalytic efficiency를 보이는 것을 확인할 수 있었다(표 3).
표 3. 레불린산 환원반응에 대한 3HBDH variant들의 kinetic parameters
2.5 개량효소를 이용한 레불린산의 4HV로의 전환
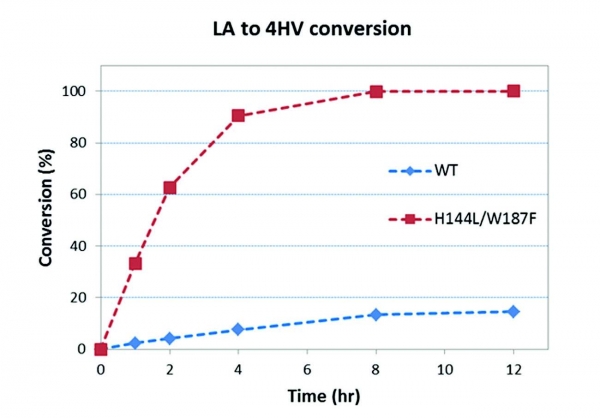
3HBDH mutant 중 가장 높은 활성을 보인 His144 Leu/Trp187Phe mutant 효소를 이용하여 레불린산의 4HV로의 효소전환반응을 수행하였다. 3HBDH는 레불린산의 환원에 조효소인 NADH를 필요로 하기 때문에 전환율의 한계를 확인하기 위해 formate dehydrogenase 효소를 이용한 조효소 재생 시스템을 구축하여 반응을 진행하였다. 30°C, pH 6.0의 조건에서 50 mM의 레불린산 전환반응을 수행한 결과, 99% 이상의 수율로 레불린산이 4HV로 전환됨을 확인할 수 있었다(그림 3).
그림 3. 개량된 3HBDH 효소를 이용한 레불린산 전환 결과
2.6 개량효소의 구조적 특성 분석
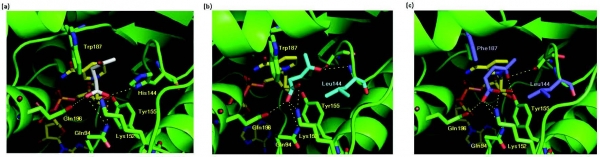
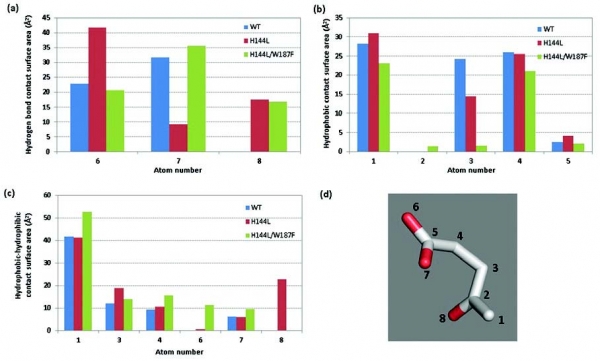
개량된 3HBDH mutant들의 효소-기질 특이성 변화와 관련된 원인을 해석하기 위해 개량효소의 구조적 특성을 분석하였다(그림 4). Wild-type과 H144L mutant, 그리고 H144L/W187F mutant 효소에 대한 intermolecular contact analysis를 수행하였으며, 그 결과 효소-기질의 수소 결합 네트워크의 변화와 소수성 상호 작용의 재배치가 기질특이성 변화의 주요 원인으로 작용했음을 알 수 있었다(그림 5). 또한, intermolecular contact analysis 를 통해 효소의 기질 특이성에 대한 분자간 상호작용과 관련된 특성을 보다 정량적으로 분석할 수 있었다.
그림 4. Molecular docking 시뮬레이션을 통한 개량 3HBDH 효소의 구조적 특성 분석 (a) wild-type, (b) His144Leu, (c) His144Leu/Trp187Phe
그림 5. Interatomic contact analysis를 적용한 개량 3HBDH 효소의 구조적 특성 분석
3. 결론
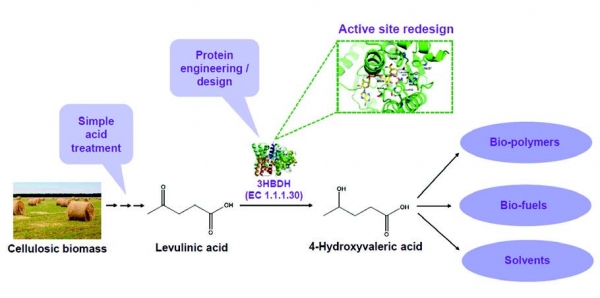
Alcaligenes faecalis 유래의 3-hydroxybutyrate dehydrogenase(3HBDH) 효소의 기질 특이성을 개량하여 셀룰로오스 유도체의 한 종류인 레불린산을 바이오플라스틱 및 차세대 바이오연료의 전구체로 사용될 수 있는 4-hydroxyvaleric acid(4HV)로 99% 이상의 전환률로 전환시킬 수 있었다. 구조기반의 rational design 기법을 도입하여 효소개량을 수행하였으며, best mutant로 선정된 His144Leu/Trp187Phe mutant는 wild-type 효소 대비 약 33배 향상된 catalytic efficiency를 나타내었다. 본 연구를 통해 셀룰로오스 기반 바이오매스 유도체의 신규 생물학적 전환시스템을 개발할 수 있었다(그림 6).
그림 6. 셀룰로오스 기반 바이오매스 유도체의 신규 생물학적 전환시스템
참고문헌
1. Yeon, Y. J., Park, H. Y., Park, K., Yoo, Y. J., 2016. Structural Basis for the Substrate Specificity of 3-hydroxybutyrate Dehydrogenase. Biotechnol. and Bioproc. Eng . 21: 364-372.
2. Yeon, Y. J., Park, H. Y., Yoo, Y. J., 2015. Engineering substrate specificity of succinic semialdehyde reductase (AKR7A5) for efficient conversion of levulinic acid to 4-hydroxyvaleric acid. J. Biotechnol. 210: 38-43
3. Yeon, Y. J., Park,H. J., Park, H. Y., Yoo, Y. J., 2014. Effect of His-tag location on the catalytic activity of 3-hydroxybutyrate dehydrogenase. Biotechnol. and Bioproc. Eng. 19: 798-802.
4. Yeon, Y. J., Park, H. Y., Yoo, Y. J., 2013. Enzymatic reduction of levulinic acid by engineering the substrate specificity of 3-hydroxybutyrate dehydrogenase. Bioresour. Technol. 134: 377-380.
5. Bond, J.Q., Alonso, D.M., Wang, D., West, R.M., Dumesic, J.A., 2010. Integrated catalytic conversion of γ-valerolactone to liquid alkenes for transportation fuels. Science 327, 1110-1114.
6. Bozell, J.J., Moens, L., Elliott, D.C., Wang, Y., Neuenscwander, G.G., Fitzpatrick, S.W., Bilski, R.J., Jarnefeld, J.L., 2000. Production of levulinic acid and use as a platform chemical for derived products. Resour. Conserv. Recycl. 28, 227-239.
7. Bozell, J.J., Petersen, G.R., 2010. Technology development for the production of biobased products from biorefinery carbohydrates- The US Department of Energy's "top 10" revisited. Green Chem. 12, 539-554.
8. Chen, H., Yu, B., Jin, S., 2011. Production of levulinic acid from steam exploded rice straw via solid superacid, S 2O 8 2-/ZrO 2-SiO 2-Sm 2O 3. Bioresour. Technol. 102, 3568-3570.
9. Corma Canos, A., Iborra, S., Velty, A., 2007. Chemical routes for the transformation of biomass into chemicals. Chem. Rev. 107,2411-2502.
10. Deng, L., Li, J., Lai, D.M., Fu, Y., Guo, Q.X., 2009. Catalytic conversion of biomass-derived carbohydrates into γ-valerolactone without using an external h 2 supply. Pyrethrum Post 48, 6529-6532.
11. Efremov, A.A., Pervyshina, G.G., Kuznetsov, B.N., 1998. Production of levulinic acid from wood raw material in the presence of sulfuric acid and its salts. Chem. Nat. Compd. 34, 182-185.
12. Girisuta, B., Danon, B., Manurung, R., Janssen, L.P.B.M., Heeres, H.J., 2008. Experimental and kinetic modelling studies on the acid-catalysed hydrolysis of the water hyacinth plant to levulinic acid. Bioresour. Technol. 99, 8367-8375.
13. Gorenflo, V., Schmack, G., Vogel, R., Steinbüchel, A., 2001. Development of a process for the biotechnological large-scale production of 4-hydroxyvalerate-containing polyesters and characterization of their physical and mechanical properties. Biomacromolecules 2, 45-57.
14. Hazer, B., Steinbüchel, A., 2007. Increased diversification of polyhydroxyalkanoates by modification reactions for industrial and medical applications. Appl. Microbiol. Biotechnol. 74, 1-12.
15. Hoque, M.M., Shimizu, S., Hossain, M.T., Yamamoto, T., Imamura, S., Suzuki, K., Tsunoda, M., Amano, H., Sekiguchi, T.,Takénaka, A., 2008. The structures of Alcaligenes faecalis D-3-hydroxybutyrate dehydrogenase before and after NAD+ and acetate binding suggest a dynamical reaction mechanism as a member of the SDR family. Acta Crystallogr., Sect. D: Biol.Crystallogr. 64, 496-505.
16. Hoque, M.M., Shimizu, S., Juan, E.C.M., Sato, Y., Hossain, M.T., Yamamoto, T., Imamura, S., Suzuki, K., Amano, H., Sekiguchi, T.,Tsunoda, M., Takénaka, A., 2009. Structure of D-3-hydroxybutyrate dehydrogenase prepared in the presence of the substrate
D-3-hydroxybutyrate and NAD+. Acta Crystallogr., Sect. F: Struct. Biol. Cryst. Commun. 65, 331-335.
17. Horváth, I.T., Mehdi, H., Fábos, V., Boda, L., Mika, L.T., 2008. γ-Valerolactone-a sustainable liquid for energy and carbon-based chemicals. Green Chem. 10, 238-242.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update