| CRISPR/Cas9 기반 유전자 교정 시스템과 전달 방법 | |
|---|---|
| Date 2017-10-09 18:49:14 |
|

교수
신라대학교 바이오산업학부
songmj@silla.ac.kr
유전자 가위
유전자 가위에 기반한 새로운 유전자 교정 시스템은 기술의 단순함과 큰 파급력을 바탕으로 최근 10년간 응용 범위를 확장하면서 과학계의 핫 이슈로 부상하고 있다.[1,2] 실제 2011년 Nature지에서, 2015년 Science Magazine’s Breakthrough 기술로 선정되었다. 유전자 가위(programmable nuclease)는 1세대로는 Zinc-finger nucleases (ZFN), 2세대는 Transcription activator-like effector nucleases(TALEN), 3세대로는 CRISPR/Cas9 이 있다. 특히, Bacteria와 Archaea에 존재하는 적응면역(Adaptive immunity) 에서 유래한 CRISPR/Cas9 시스템은 새로운 질병 치료의 가능성을 보여주며 의학과 생명공학 분야에 사용되고 있고, 유전자 교정된 양배추, 갈변되지 않는 사과 등 농업, 축산업에까지 그 영향력을 확대하고 있다. [3,4] CRISPR/Cas9 발명자들은 2016년 노벨상 후보자로 선정되는 등 전반적으로 과학계에 영향력을 확대하고있어, 본 기고에서는 유전자 가위의 최신 세대인 CRISPR/Cas9 시스템을 중심으로 그 작동 기작을 살펴보고, 이를 응용하기 위한 다양한 전달 방법의 개발 상황을 고찰해보고자 한다.
CRISPR/Cas9 유전자 가위의 구조
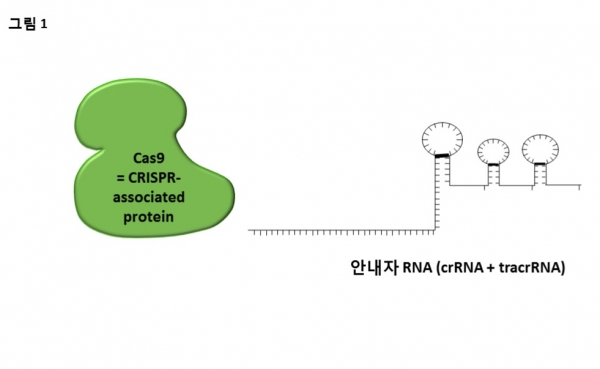
CRISPR/Cas9 유전자 교정 시스템은 2개의 RNA (crRNA와 tracrRNA)와 단백질(Cas9)로 구성되어 있다. 단백질 Cas는 "CRISPR-associated proteins에서 유래한 말이고 "CRISPR”는 "Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)”의 줄임말이다. 2개의 RNA는 사용하기 쉽게 하나의 안내자 RNA (sgRNA single guided-RNA)로 합쳐진다. (그림 1)
Cas9 단백질은 이중나선 DNA를 자르는 유전자 가위(programmable nuclease)의 역할을 하며, sgRNA는 Cas9을 잘려야 할 DNA 염기서열로 안내하는 역할을 한다. 안내자 RNA는 다음의 두 가지 조건을 만족시키면 Cas9을 특정 염기 서열로 안내할 수 있다. [5] 첫째, 타겟 염기서열과 상보적으로 결합해야 한다. 두번째, Cas9 단백질이 직접적으로 인지하는 PAM (Protospacer adjacent motif)을 포함해야 한다. PAM 염기서열은 Cas9이 분리된 세균의 종류에 따라 다르며, 일반적으로 많이 사용되는, Streptococcus pyogenes 에서 유래된 Cas9의 경우 5‘–NGG-3’가 PAM이 된다. Staphylococcus aureus 에서 유래된 Cas9 단백질은 5‘–NNGRRT-3’를 PMA 염기 서열로 가진다. 안내자 RNA는 PAM 염기서열 바로 앞에 상보적으로 결합하여 Cas9을 안내한다.
CRISPR/Cas9 유전자 가위 작동기작
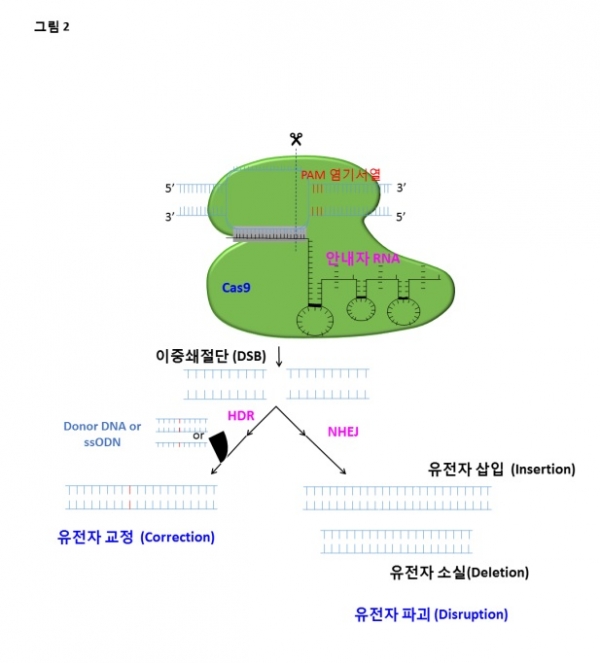
타겟 염기 서열을 바탕으로, 안내자 sgRNA을 디자인해서 Cas9과 함께 세포내로 전달되면, sgRNA가 해당염기서열을 인지하여 Cas9을 안내한다. 이에, Cas9이 PAM 염기서열을 인지하면, Cas9에 의해 DNA의 이중쇄절단(Double strand break; DSB)이 발생한다. 이후 세포는 주로 두 가지의 복구기작을 가동하게 된다. (그림 2)
첫 번째 복구기작은 유사한 염기서열을 토대로 한 HDR (homology-directed repair)이다. HDR이 일어나기 위해서는 공여 DNA(Donor DNA)나 ssODN(Single-strand oligodeoxynucleotide)이 필요하다. 공여DNA를 이용하면 point-mutation에 대한 유전자 교정(Gene correction)이 가능하다. 또 다른 복구기작은 NHEJ(Non -homologousend-joining)이다. NHEJ 기작을 통해 오류빈발수복(Error-prone repair)이 일어나 표적 염기서열에 무작위적 염기의 삽입과 결실(insertion and deletion; INDEL)이 생기며 이중쇄절단이 복구되지만, 기존의 DNA는 가진 유전정보를 정상적으로 발현하지 못하게 되어 유전자 파괴(Gene disruption)가 발생한다. HDR은 공여 DNA가 반드시 존재해야 하고, S 또는 G2 세포주기에만 발생하는 등, 자연적인 상황에서는 NHEJ가 HDR보다 발생 빈도수가 훨씬 더 많다. 하지만, 유전자 교정을 위해서 NHEJ 방해물질(Scr7), HDR 증가물질(Rad51) 등을 이용하여 HDR 기작으로 유도하려는 여러 가지 방법이 시도되고 있다.
CRISPR/Cas9유전자 가위 전달방법
유전자 가위의 효율적인 전달은 효율적인 유전자 교정과 직접적으로 영향이 있다. Cas9과 안내자 RNA는 일반적으로 DNA나 mRNA 와 같은 유전 정보를 포함한 염기서열로 전달되어 발현되거나, Cas9 단백질과 안내자 RNA 복합체로 전달되는 두 가지 방법이 있다. 또한, 전달 시스템은 바이러스의 사용 유무(viral, nonviral)로 구분할 수 있다(그림 3).
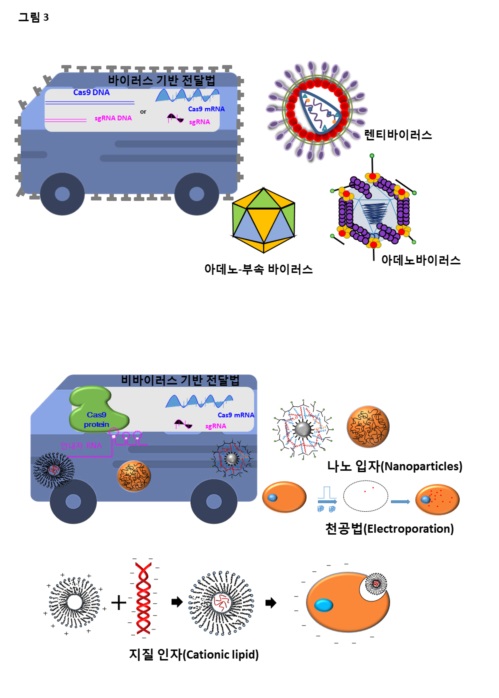
바이러스를 기반으로 한 유전자 가위 전달은 주로 DNA나 mRNA의 형태로 발생한다. 렌티바이러스, 아데노바이러스, 아데노-부속 바이러스가 CRISPR/Cas9시스템 전달에 사용되어 왔다. 바이러스기반 전달은 세포-바이러스의 결합이 상당히 강력하므로, 생체 내 적용에 효율적인 장점이 있지만, 바이러스 내에 염기서열을 결합시키기 위해서 복잡한 codon optimization,promoter selection 과정을 거쳐야 하고 면역 관련 안전성 이슈가 있다. 렌티바이러스는 상대적으로 많은 염기서열을 포함할 수 있어서 다수의 안내자 RNA를 포함할 수 있고, transfection이 어려운 세포에도 유전자 가위 성분을 효율적으로 전달할 수 있는 장점이 있다. 하지만, 암을 유발할 수 있거나 off-target effect가 생길 수 있다는 것이 단점으로 꼽힌다[6]. 아데노바이러스는 host genome에 직접적으로 integration이 일어나지 않아서 렌티바이러스보다 상대적으로 안전하다는 장점이 있지만, 면역반응에서 완전히 자유로울 수가 없고, 대량생산이 비싼 것이 단점이다. 가장 많이 사용되고 있는 것이 상대적으로 독성이 약한 아데노 부속 바이러스(Adeno-associate virus; AAV) 이다. 실제로 AAV를 이용하여 근육 유전병인 Duchenne Muscular 동물 모델에서 결핍되었던 dystrophin 이 다시 발현하는 효능을 보였다. [7,8] 하지만, AAV는 탑재시킬 수 있는 염기서열의 크기가 4.7 kb 미만으로 제한되어 있어, 4.2 kb의 크기인 Cas9을 탑재하고 나면 안내자 RNA나 공여 DNA를 한 바이러스 내에서 전달하기가 쉽지 않다.
비바이러스 기반 전달 방법으로는 천공법(electroporation), 지질 인자(lipid particle) 등이 사용되고 있다. 전류를 흘려보내 세포막에 구멍을 뚫는 방법인 천공법은 줄기세포를 이용한 연구에 많이 사용되었다. [9] 하지만, 이 방법은 생체 내(in vivo)에서 적용시키기는 다소 어려운 점이 있다. 지질(lipid) 인자 기반 전달 방법은 전통적으로 유전자 전달에 많이 사용되고 있는 방법이다. 양성을 띠는 Cas9 단백질과 강한 음이온을 띠는 안내자 RNA가 서로 결합하여 음이온을 띠는 Cas9 단백질-RNA 복합(Ribonucleoprotein: RNP)를 만든다. 이는 양성 지질 인자에 의해 둘러 싸여져서 세포내로 들어가게 된다. 이 방법으로 동물의 귀에서 약 20프로에 해당하는 유전자 교정을 할 수 있었다. [10] 이 이외에도 DNA 나노입자, iTOP (induced transduction by osmocytosis and propanebetaine), microfluidic system을 이용한 방법 [11, 12] 등 효율적이고 안전한 유전자 가위 전달을 위하여 여러 가지 방법이 시도되고 있다.
미래전망
유전자 교정과 관련된 국외 기업으로는 Sangamo Therapeutics, Editas Medicine, CRISPR Therapeutis, Caribou Biosciences (Intellia), Precision Bioscience, Cellectis등 7개의 회사가 있고 국내 기업으로는 툴젠이 있다. 그 중 HIV/AIDS (Phase 1, 2; NCT00842634, NCT01044654), 베타지중해빈혈제(Phase I, NCT02695160), Hurler Syndrome (Phase I, NCT02702115) 는 임상시험 중이며, 레베르 선천성 흑암시치료제, 겸상적혈구빈혈치료제 등은 연구 개발 중이다. 몇몇 회사들은 글로벌 제약사와의 협업을 통하여 치료제 개발 진행 중이며, 이는 향후 CRISPR/Cas9 기반 질병치료제 개발 속도를 한층 더 빠르게 할 것이다.
사용의 편리성과 높은 잠재력, 빠른 산업화로 유전자 가위 기반 질병치료제는 급속도로 발전하고 있다. 또한,CRISPR/Cas9 시스템은 질병치료제 뿐만 아니라 농업과 축산업 분야까지 응용되고 있고, 현재 미국과 유럽에서 non-GMO (Genetically Modified Organism)로 분류되어 일부 제품은 생산중이다. 파급력이 큰 기술이 급속도로 발전하고 있다는 점, 동시에 우리 일상생활에 큰 영향력을 미칠 수 있다는 점에서, 본 기술에 대한 활발한 토의, 윤리적인 논의,관련 법규의 제정이 필요하다. (본문에 사용된 그림들은 Biotechnology Progress 2017, 33(4), 1035-1045. “TheCRISPR/Cas9 system: their delivery, in vivo and ex vivo applications and clinical development by startups” 발표 논문을 편집하였다.)
참고문헌
1. Jinek M et al., Science . 2012; 337:816-821.
2. Garneau JE et al., Nature . 2010;468:67-71.
3. Svitashev S et al., Nat Commun . 2016; 7:13274.
4. Cox DB, et al., Nat Med . 2015;21:121-131.
5. Deltcheva E, et al., Nature . 2011;471:602-607.
6. Kumar M, et al., Hum Gene Ther . 2001;12:1893-1905.
7. Long C, et al., Science . 2016;351:400-403.
8. Nelson CE, et al., Science . 2016;351:403-407.
9. Chen S, et al., J Biol Chem . 2016;291:14457-14467.
10. Zuris JA, et al., Nat Biotechnol . 2015;33: 73-80.
11. Miller JB, et al., Angew Chem Int Ed Engl . 2017;56:1059-1063.
12. D’'Astolfo DS, et al., Cell . 2015;161:674-690.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update