| 무세포 단백질 합성 시스템의 응용 | |
|---|---|
| Date 2018-04-15 16:35:25 |
|

교수
포항공과대학교 화학공학과
jeongwook@postech.ac.kr
무세포 단백질 합성시스템의 응용
자연 상태에서 소량 존재하는 유용 단백질이나 상업용 효소 등을 과량 생산하기 위해서는 재조합 단백질 기술을 이용하는 것이 현재 가장 보편적인 방법이다. 이 방법은 생산하고자 하는 단백질의 종류가 바뀜에 따라 유전자도입, 최적균주 스크리닝, 세포배양, 세포수득 및 파쇄, 단백질 분리/정제 과정을 반복해야 된다는 단점이 있어서, 빠른 속도로 다양한 단백질을 생산하는 시스템으로 활용하기에는 적합하지가 않다. 또한 세포 자체의 시스템을 사용하기 때문에 독성 물질로 작용할 수 있는 생물분자를 합성하는 시스템으로 활용하는 데 제약이 따르며, 비천연 아미노산 등을 활용하여 새로운 형태와 기능의 생물분자를 합성하는 데 어려움이 있다. 이를 극복하기 위해, 화학적 방법으로 펩타이드 등을 합성하려는 시도도 있지만, 생물학적 공정에 비해 수율이 낮고, 유기용매 등의 유해한 물질을 사용한다는 등의 여러 단점 때문에 그 용도가 극히 제한적이다. 하지만 무세포 단백질 합성 시스템을 사용하면, 이러한 단점을 극복하고 원하는 목적 단백질만을 빠르고 효율적으로 합성할 수 있다[1,2].
무세포 단백질 합성 시스템
무세포 단백질 합성 시스템은 반복적인 세포배양단계 없이 원하는 단백질만을 생산하기 위해 개발되었으며, 목표 유전자서열을 포함하는 DNA, 전사/번역관련 단백질 기구, 핵산, 아미노산, 에너지원, 완충액 등으로 구성되어 있다. 원하는 단백질을 코딩하고 있는 유전자는 RNA 중합효소에 의해 mRNA로 전사되고, 이들은 리보솜, 외부에서 공급된 tRNA, 아미노산 및 에너지원에 의해 단백질로 번역되며, 이러한 세포외 전사와 번역 과정으로 단백질 합성이 진행된다. 이런 무세포 단백질 합성 시스템은 살아있는 세포를 사용하지 않기 때문에 다양한 종류의 단백질을 빠른 시간 내에 얻기에 유리하다[1]. 그리고 세포배양이 필요 없기 때문에 세포의 성장에 시간이 소요되지 않아 단시간에 원하는 단백질을 얻을 수 있다. 또한 한 가지 유전정보에 의해 한 가지의 단백질만 합성되어 원하는 단백질만 정확하게, 효율적으로, 그리고 다양한 조건에서 유연하게 합성 가능하다. 또한 자연계 내에 존재하는 아미노산뿐만 아니라 비천연 아미노산들의 도입이 상대적으로 쉬워서 새로운 구조와 기능의 단백질들을 생산할 수 있다. 게다가 세포에서 생성되는 독소나 기타감염성 물질로부터의 오염 없이 순수하고 안전한 단백질의 합성이 가능하며, 생성된 단백질의 분리/정제가 상대적으로용이하다[1].
1950년에 Winnick에 의해 처음으로 무세포 단백질 합성이라는 개념이 소개된 이래로 효율 향상에 대한 많은 연구가 진행되어왔다. 1988년에 연속적으로 반응 물질을 공급함으로써 단백질 발현 시간을 수십 시간까지 연장하는 기술이 발달하면서 반응기질과 부산물의 지속적인 교환이 이루어지는 연속교환식 반응기 등 단백질을 합성하기 위한 반응기의 최적화가 이루어졌다. 더욱 효율적인 단백질 합성을 위하여 DNA 자체를 가공하고 생명체 내부의 DNA 분해효소를 수정한 파쇄액을 이용하는 방법, 에너지원을 다양화하는 방법 등에 의해 단백질 합성 효율은 꾸준히 향상되어 왔다[2].
무세포 단백질 합성 시스템을 통한 여러 가지 생물 분자 생산
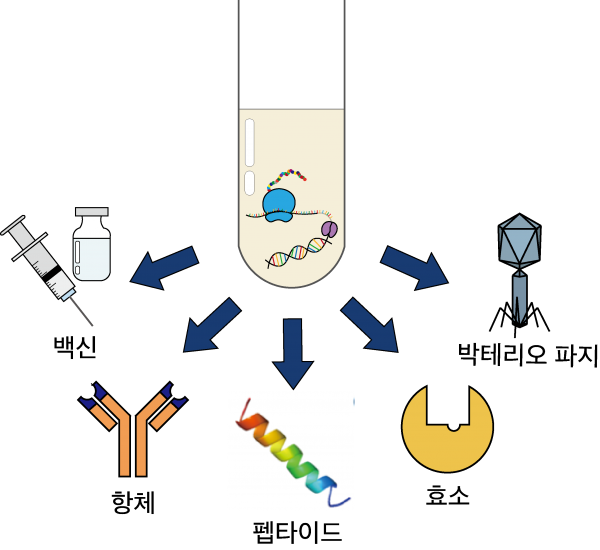
이러한 무세포 단백질 합성 시스템을 통하면, 다양한 기능의 생물분자들을 합성할 수 있다. 단백질, 즉 폴리펩타이드 자체가 기능성이 있는 백신, 항체 및 펩타이드 등으로부터, 효소의 합성을 통한 항생제/항암제를 포함한 낮은 분자량의 생물분자들, 그리고 여러 가지 구조단백질들의 합성을 통해 박테리오파지와 같은 생명체에 이르기까지 생산가능한 생물분자의 범위는 매우 다양하다(그림 1).
그림 1. 무세포 단백질 합성 시스템을 통해 생성 가능한 생물 분자
백신 백신은 동물, 특히 인간에게 질병이나 전염병에 대한 면역력을 부여하려는 목적으로 개발된 것으로서, 병원체의 감염이 있기 전 인체 내에 인위적으로 병원성이 제거되거나, 약하게 만든 병원체를 주입하여 인체의 면역체계를 미리 활성화시킬 수 있도록 만든 의약제제를 말한다. 최근에 이러한 무세포 시스템을 이용하여 보툴리늄, 탄저균, 디프테리아균등에 해당하는 백신 항원들을 휴대 생산한 예가 있으며, 특히 디프테리아 항원의 경우 이렇게 합성된 항원이 실제 백신으로 기능할 수 있음을, 즉 마우스에 주입하였을 때, 해당 항체가 정상적으로 형성됨을 확인하였다[3]. 이러한 무세포 시스템은 사용되는 코돈과 아미노산이 비정상적으로 분포되어있고, 단백질 접힘 과정이 복잡한 백신후보군 단백질들을 보다 효과적으로 생산하는데 활용되기도 하였다. 재조합 대장균을 사용하는 시스템에서 생산해내기 어려운 말라리아균, Plasmodium falciparum 의 124개의 유전자를 밀 배아의 파쇄액에서 무세포 발현 시스템으로 93개의 단백질을 합성하는 데 성공하였다. 그 중 Pfs25, PfCSP, PfAMA를 말라리아의 백신 후보군으로 선정하였고, 실제 동물 실험을 통해 그 유효성을 입증하였다[4]. 이렇듯, 무세포 단백질 합성 시스템은 재조합 미생물을 이용한 전통적인 방법으로 생산하기 어려운 단백질들을 생산 가능케 함으로써, 양질의 백신 단백질을 합성하거나 새로운 백신 단백질 후보군을 찾아낼 수 있는 등의 다양한 용도로 활용될 수 있다.
항체 외부항원과 특이적인 반응을 일으키는 항체는 여러 진단/분석법 등에 활발하게 이용되고 있으며, 다양한 항체의약품형태로도 개발되고 있다. 따라서 이러한 항체 단백질들을 쉽게 합성하고 스크리닝하는 데 대한 관심이 높으며 이들을 어떻게 쉽게 다양한 기능들과 조합할 수 있을 것인가에 대한 연구가 활발하다. 최근에는 외부항원, 암 특이적 에피톱 등의 타겟 분자에 특이적으로 친화력을 갖는 분자들을 코딩하는 DNA 서열과 α-아밀레이스 등의 효소, 형광단백질 등의 부가적인 기능들을 코딩하는 서열에 각각 단백질 커플링 시스템을 도입한 형태의 항체조합발현 시스템이 무세포 시스템에서 개발되었다. 이들은 무세포 발현 시스템에서 항체와 여러 부가기능들을 각각 먼저 합성하고, 시험관 내에서 여러 가지 형태로 조합함으로써 항체단백질들에 다양한 부가기능들을 쉽게 부여할 수 있는 형태의 시스템으로, 진단, 치료 등에 이용될 수 있다[3].
펩타이드 펩타이드의 경우 화학적 방법으로도 합성이 가능하지만, 길이가 20 mer 이상으로 길어지면, 생합성으로 생산하는 것이 더 유리하다. 특히, 항생활성을 보이는 펩타이드를 세포 내에서 생산하는 경우 호스트의 성장에 영향을 미칠 수도 있어, 이들을 효과적으로 생산하기에는 어려움이 따른다. 이러한 이유로 최근에는 다양한 종류의 바이러스나 미생물에 특이적인 항생효과가 있는 항 미생물 펩타이드를 무세포 단백질 합성 시스템으로 합성하는 것에 대한 연구가 이루어지고 있다. 이런 항 미생물 펩타이드는 바이러스, 박테리아, 진균류까지 타겟 생물체로 삼아 세포막 또는 세포벽의 온전한 상태를 변화시키거나 세포 내부로 들어가 세포 생장에 중요한 경로를 방해함으로써 타겟 생물체를 사멸시킬 수 있다. 무세포 단백질 발현 시스템으로 합성한 Cecropin P1, Cecropin B, BP100이 대표적인 그람 음성균인 대장균과 대표적인 그람 양성균인 Bacillus subtilis의 성장을 크게 방해하는 것이 확인되었다[3].
효소 효소는 생체 안에서 이루어지는 생화학 반응의 촉매로서, 온도나 pH 등 환경 요인에 의하여 기능이 크게 영향을 받으며, 따라서 반응조건을 잘 조절하는 것이 활성을 극대화시킬 수 있는 방법 중에 하나이다. 효소들을 무세포 단백질 합성 시스템으로 생합성하게 되면, 이러한 다양한 조건에서 효소들의 활성을 쉽게 확인할 수 있다. 일례로 L-트립토판을 전구체로 5단계의 효소반응을 거쳐 항암치료제로 알려진 바이오리신을 생합성하는 연구에서는 각 효소반응을 다양한 반응조건 및 DNA 농도를 조절하여 최적화하고, 그 최적화된 조건으로부터 무세포 시스템 내에서 바이오리신을 쉽게 합성할 수 있음을 보였다. 또한 이들을 구성하는 5개의 효소들을 다양한 조합으로 배합함으로써 서로 다른 5가지의 바이오리신 계열 화합물도 ‘주문자 제작 방식’, 즉 대상DNA 종류들을 단순히 달리 조합함으로써 쉽게 여러 조합의 화합물이 생산 가능함이 추가적으로 예시되었다[3].
박테리오파지 박테리오파지는 세균을 숙주세포로 하는 바이러스를 일컫는 말이다. 무세포 단백질 합성 시스템에 바이러스 게놈을 혼합물에 넣어 주는 것만으로도 완전한 활성을 갖춘 T7 박테리오파지가 합성될 수 있음이 알려졌다. 같은 시스템에서 MS2, ΦX174와 같은 다른 형태의 박테리오파지도 자가 조립과 게놈 복제를 통해 무세포 시스템에서 증식 가능함이 확인되었다[5]. 최근에는 위의 세 파지보다 유전자 조절, 구조, 신진 대사 등이 훨씬 복잡한 파지 T4가 같은 방법으로 합성 가능함이 알려졌다[6]. 이렇듯 무세포 단백질 합성 시스템은 목적 단백질 생산뿐만 아니라 바이러스 등의 생물학적 개체를 상향식 접근으로 합성하는 것 등에도 이용될 수 있어 앞으로 더 많은 응용이 기대된다.
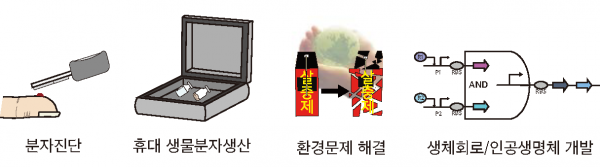
무세포 단백질 합성 시스템의 적용분야
분자진단 분자진단은 유전자를 이용한 질환 진단 검사, 질병 감염 여부 등을 판정할 목적으로 혈액, 뇨, 타액 등 인체에서 유래하는 검체로부터 분자생물학적 기술을 이용하여 감염물질의 유전 정보를 담고 있는 유전자를 검사하는 방법이다. 이러한 분자진단 결과를 출력하기 위해 색이나 형광등의 변화를 표현할 수 있는 단백질들을 리포터단백질로 많이 활용하는데, 무세포 단백질 합성 시스템은 이러한 단백질들을 합성하는 데 적용된다. 최근, 모기에 의해 전염되는 지카 바이러스에 대한 빠른 진단방법으로써 RNA 게놈 검출을 위해 설계 시간이 짧고, 유효성 검증이 빠르게 이루어질 수 있는 RNA 구조기반의 분자진단 메커니즘을 사용한 종이기반의 검출 시스템이 개발되었다[7]. 이 시스템 상에서 무세포 단백질 발현 시스템은 동결 건조된 형태로 종이 위에 올려져서, 목적 RNA 분자가 검출되면 리포터단백질이 발현될 수 있게 한다. 이 무세포 및 종이기반의 검출 시스템을 통해 지카 바이러스의 염기서열변이를 단일 염기쌍 수준에서 구분해 낼 수 있었으며, 이 시스템은 ‘동결건조’ 와 ‘등온 RNA 증폭기술’을 이용하기 때문에 실험실뿐만 아니라 지카바이러스의 진단이 필요한 현장과 즉각 대응이 필요한 곳에서 쓰일 수 있는 형태로 활용될 수 있다[7].
휴대 생물분자생산 단백질 및 단백질 유래 의약품들을 유통시키기 위해서는 저온유통체계가 필수적이다. 이러한 사항은 비용에도 영향을 미치며, 개발도상국과 같이 전기 공급이 원활하지 않는 등의 인프라가 낙후된 지역에서는 더욱 이렇게 생산된 단백질 치료제 등이 보급/보관되기가 어렵다. 이러한 점을 해결하기 위해 휴대 생물분자 생산시스템이 고안되었는데, 이는 바로 동결 건조된 무세포 기반의 단백질 합성시스템에 기반한 것이다. 이 시스템을 이용하면 생산품에 대한 정보가 담긴 DNA와 물을 가하는 것만으로도 손쉽게 우리가 원하는 생물분자를 현장에서 얻을 수 있다. 이플랫폼은 무세포 합성이 갖는 모든 장점을 가지고 있으며, 동결 건조된 형태이기 때문에 상온에서 보급/보관할 수 있고, 저렴한 비용으로 생산할 수 있다는 이점이 있다. 또한 이 플랫폼으로 앞서 언급되었던 백신, 항체, 펩타이드 등을 생산할 수 있으며, 생산된 생물분자들의 활성도 기존의 방법으로 생산한 것과 동일하다[3].
환경문제 해결 무세포 단백질 합성 시스템은 환경 문제에 대한 해결책으로도 활용될 수 있다. 자연계 내 미생물들은 연료, 염소화 용제, 살충제, 벤젠 등 다양한 환경오염 물질을 분해할 수 있는 역량이 있는 것으로 알려졌다. 이러한 미생물들을 유전공학적인 방법으로 개량하면 환경오염 물질을 분해하는 데에 적용할 수 있으나, 유전자변형생물체 방출에 대한 우려로 대규모 적용에 어려움이 따른다. 하지만 무세포 단백질 합성 시스템을 이용하면 이러한 문제를 해결할 수 있다. 즉, 이들을 분해하는 활성만을 무세포 시스템 형태로 도포함으로써 유전자변형생물체의 방출에 대한 우려를 없앨 수 있다[8]. 이외에도 폐수 탈색과 같은 곳에 사용되지만, 그동안 생체 내에서 효율적 생산이 어려웠던 다중산화 효소 등도 무세포 시스템에서 합성 가능함이 최근 보고된 바가 있다[9].
생체회로/인공생명체 개발 유전자 회로란 세포 내 유전자 발현에 관련된 조절 인자들과 이들의 영향을 받는 유전자 서열, 즉 프로모터 등 유전자 발현 인자들을 유전자 수준에서 분리하고 인위적으로 재구성하여 이들의 유기적 반응을통해 유전자 발현 형태를 임의적으로 설계 및 제어하기 위한 회로를 말한다. 무세포 시스템에서 이들을 개발하게 되면 세포 내에서 오랜 시간이 걸리는 유전자 회로 설계-구축 주기를 하루 만에 처리할 수 있게 되어 ‘유전자 회로의 설계’가 용이해지게 된다. 프로모터, 라이보조절자, 유전자 회로 등의 실험에도 유용하게 사용될 수 있다. 예를 들면, 긴 전사활성 복합회로를 구성하는 데 쓰일 수 있고, 이들을 서로 쉽게 비교하는 것이 가능하다[5]. 최근에는 이러한 유전자 회로들을 각기 다른 리포좀 내로 구획화하여, 확장성이 있는 시스템으로 개발한 사례가 보고되었다[10]. 즉, 리포솜 막을 통해 각각의 유전자 회로들을 독립적으로 존재하게 하면서 유도분자를 이용하여 리포좀 내의 유전자 회로들의 기능을 서로 연결될 수 있게 하였다. 이렇게 무세포 단백질 합성 시스템을 리포솜 막 속에 넣어서 인공 세포 형태로 만드는 연구는 생명의 기원과 초기 진화에 대한 연구에도 이용될 가능성이 충분한 것으로 보인다[10].
그림 2. 무세포 단백질 합성 시스템의 다양한 응용
결론
앞서 살펴보았듯이, 무세포 단백질 합성 시스템은 다양한 생물분자를 생산하는 데 활용될 수 있고, 이를 통해 분자진단, 휴대생물분자생산, 환경정화, 인공생명체 개발 등 여러 분야에 직간접적으로 적용될 수 있다. 많은 시간과 노력이 필요한 형질전환, 세포성장과 분리/정제 등의 여러 단계의 복잡한 단계를 간소화시킴으로써 발생하는 여러 전체공정수준의 장점에 더하여, 생산되는 생물분자와 이를 생산하는 전사/번역 시스템간의 간섭도 상대적으로 줄일 수 있어서 생산가능한 생물분자의 스펙트럼이 더욱 다양해지는 추가적인 장점도 있다 하겠다. 이러한 측면 때문에 무세포 단백질 합성 시스템은 생물공학의 다양한 분야에서 앞으로의 그 활용이 더욱 기대된다.
참고문헌
1. 최원재, 무세포 단백질 합성 시스템
2. 김동명, 무세포 단백질 합성 기술의 연구 동향, NICE, 2009, 27(6):650-656
3. Pardee K et al., Portable, On-Demand Biomolecular Manufacturing, Cell. 2016, 167(1):248-259
4. Tsuboi T et al., Wheat Germ Cell-Free System-Based Production of Malaria Proteins for Discovery of Novel Vaccine Candidate,Infect Immun. 2008, 76(4):1702-8
5. Garamella J et al., The All E.coli TX-TL Toolbox 2.0: A Platform for Cell-Free Synthetic Biology, ACS Synth. Biol. 2016, 5:344-355
6. Rustard M et al., Cell-free TXTL synthesis of infectious bacteriophage T4 in a single test tube reaction, Synthetic Biology, 2015,3(1):ysy002
7. Pardee K et al., Rapid, Low-Cost Detecting of Zika Virus Using Programmable Biomolecular Components, Cell. 2016,165(5):1255-1266
8. Karig DK, Cell-free synthetic biology for environmental sensing and remediation, Curr Opin Biotechnol. 2017, 45:69-75
9. Li J et al., Cell-free protein synthesis enables high yielding synthesis of an active multicopper oxidase, Biotechnol J. 2016,11(2):212-8
10. Adamala KP et al., Engineering genetic circuit interactions within and between synthetic minimal cells, Nat Chem. 2017, 9(5):431-439
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update