| Microbiome 기반 신약 개발 동향 | |
|---|---|
| Date 2018-10-08 09:54:31 |
|

연구소장
㈜고바이오랩 마이크로비옴치료연구소
twnam@kobiolabs.com
1. 서론
모든 인간의 몸에는 수 조 ~ 수십 조 개의 공생 미생물이 존재하고 있으며 이는 이들 미생물이 살아가고 있는 인간 신체의 세포 수에 육박한다(기존에는 인간 세포의 수에 10배 이상의 미생물이 존재한다는 가설에 따라 “10% Human” 등의 개념이 사용되었으나, 최근 연구 결과에 따르면 이는 과대평가된 것으로 보임) [1,2]. 이들 인체 내 전체 미생물의 집합인 microbiota의 genome 정보의 총합이 microbiome 으로 정의되고 있으나[1], 일반적으로 microbiota 자체 및 이들의 생리적 특성, genome 및 16SrDNA 분석에 따른 개체군의 군집 정보 등을 microbiome 이라는 개념으로 통칭하여 사용하기도 하며[3], 본 기고에서는 이와 같이 인체내 공생 미생물 및 생리, 유전적인 정보를 집합적으로 표현하는 개념으로 사용하고자 한다.
미생물은 대장 등의 소화관뿐만 아니라 피부, 구강, 폐, 생식기 등 수많은 인체 조직에 서식하고 있다[4]. 최근 진행된 연구 결과를 종합하면, 일반적으로 인체 microbiome은 인간의 대사에 관여하고, 장관 등 신체 각 부위를 병원균으로부터 보호하며, 면역 체계 발달과 상호 작용하는 등 다양한 방법으로 인간의 생리적 기능에 영향을 미친다[5]. 이와 같은 연구 성과에 따라 microbiome을 조절하거나 microbiome에서 선별된 유용 미생물 혹은 대사체를 질병 치료에 활용하기 위한 신약 개발 역시 꾸준히 이루어지고 있다. 현재 수백 개의 스타트업 신약개발 회사 및 일부 Big Pharma 들이 microbiome 기반의 신약 개발에 참여하고 있으며, 가시적인 개발 단계에 있는 의약품도 2018년 2월 현재 120개를 넘어서고 있다[6]. 현재까지 치료제로 승인된 약물은 없으나, 임상 3상이 진행 중인 Seres Therapeutics, Rebiotix 및 Ritter Pharmaceuticals의 제품들을 포함하여 현재 수십 개의 후보가 전임상 단계를 넘어 임상시험에 진입한 상태이므로 연구 개발 및 잠재적인 시장은 계속 확대될 것으로 예상된다. 본 기고에서는 이러한 각 회사들의 microbiome 기반 치료제 개발 현황을 각 회사의 개별 전략에 따라 분야별로 살펴보고자 한다. 단, 최근 각 회사에서 방대한 규모로 개발이 진행중인 microbiome 기반의 면역 항암 치료제에 대한 현황 및 전망을 논하기에는 본 필자의 연구 이력이 적절치 않아 본 기고에서는 다루지 않을 예정이다.
2. 본론
2.1 주요 회사별 개발 전략
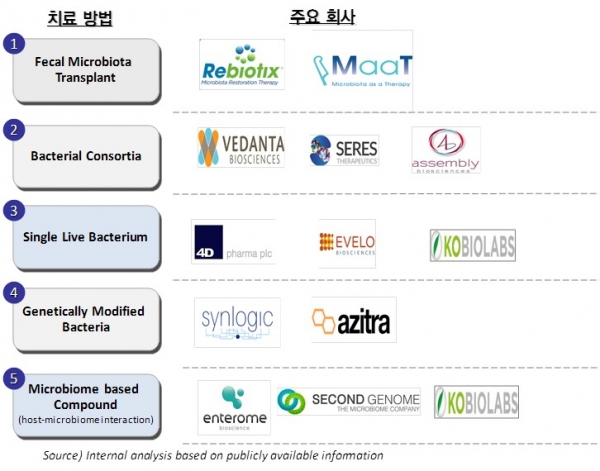
Microbiome 기반의 치료제를 개발하고 있는 회사들의 전략은 크게 다음과 같이 구분할 수 있다(그림 1). 우선, 분변 이식(FMT; Fecal transplantation) 기반의 치료법 혹은 치료제를 개발하는 회사들이 있으며 Rebiotix 및 MaaT Phama 등의 회사를 들 수 있다. 이러한 FMT 기반의 개발 전략은 안전성 및 불확실성 등의 단점을 가지고 있어, 현재 대부분의 회사들은 특정 기능성 혹은 microbiome 회복 효과 등을 토대로 인체 microbiome에서 선별된 bacteria를 살아있는 상태로(LBP; Live Biotherapeutic Products) 치료제로 사용하는 전략을 취하고 있다. 이들 회사는 다시 여러 기능성을 조합하여 하나의 효과를 내도록 할지(Bacterial consortia) 혹은 단일 균종만으로 원하는 치료 효과를 얻을지에 따라 개발 전략이 구분될 수 있다. 효과를 나타내는 물질이나 mechanism이 이미 규명된 경우, 효과를 극대화 시킬 수 있도록 대상 bacteria에 대한 genetic engineering을 시도하거나(Synlogic, Azitra 등) 혹은 타겟 물질만을 선별하여(Enterome, Second Genome 등) 의약품으로 개발이 가능하다.
그림 1. 주요 microbiome 치료제 개발사의 개발 전략에 따른 분류
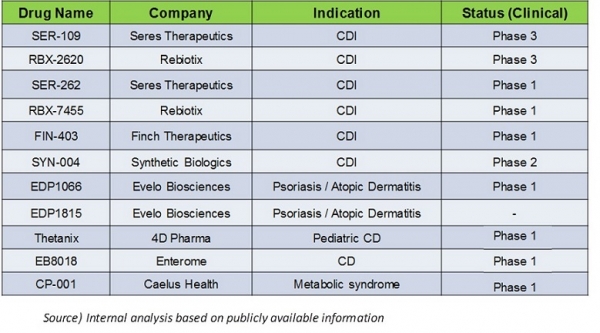
그림 2. 현재 임상이 진행되거나 예정되어 있는 주요 microbiome 치료제
2.2 주요 질환군별 개발 현황
자가 면역 질환(Autoimmune Disease )
인체의 가장 많은 미생물의 서식처라는 대장의 특성상 대장염은 microbiome 기반의 치료제 연구가 가장 많이 이루어진 질환 중 하나이다. 이중에서도 IBD (Inflammatory bowel disease)는 면역 불균형에 의해 발생하는 염증성 대장질환으로, 결장(colon) 부위에서 발생하는 궤양성 대장염(UC; ulcerative colitis)과 소화관의 어디에서든 발생할 수 있는 크론병(Crohn’s disease)으로 크게 구분할 수 있다. IBD의 치료제로는 현재 5-ASA 기반의 aminosalicylates와 같은 항염증제나 Infliximab (Remicade) 와 같은 TNF에 대한 항체 등 생물학적 제제가 사용되고 있다[7]. IBD에 대한 치료제가 꾸준히 개발되고 있음에도 불구하고 각 치료제에 대한 반응률의 차이, 부작용, 재발률 등의 문제가 존재하고 있어, 안전한 동시에 효과가 우수한 치료제에 대한 요구는 여전히 존재한다. Microbiome 기반의 IBD 치료제로 4D Pharma, Seres Therapeutics, Enterome 등 회사에서 개발 중인 3개 후보가 임상에 진입하였다. 이중 4D Pharma의 Thetanix의 경우 Bacteroides thetaiotaomicomic 단일 균주로 구성되어 있다. 장내 mucosal barrier의 기능을 향상시켜 염증을 유발하는 세균들의 침투를 방지하는 것이 주요한 기능이며 2013년 FDA에서 크론병 치료제로 orphan drug 승인을 받았고 2018년 4월 임상 1상이 종료되었다[8]. Seres Therapeutics의 SER-287는 단일 균주가 아닌 균주들의 조합으로 구성되어 있으며(사용된 균주들의 정보는 공개되지 않음), 궤양성 대장염 치료를 위해 개발된 경구용 제제로 특이하게 세균 포자(spore) 형태로 제작된다. 이들 균주는 장벽의 밀착성을 증가시켜 염증 유도를 억제하는 역할을 한다고 하며, 최근 임상 1b 단계가 긍정적인 결과를 얻은 채 종료되었다[9]. Enterome의 EB8018의 경우, 앞의 두 제품과는 달리 LBP가 아닌 소형 분자 기반의 크론병 치료제로, FimH라는 단백질의 기능을 차단하는 역할을 담당한다. FimH는 크론병을 유발한다고 알려진 염증성 세균이 장벽에 부착하는 데 기여하는 단백질로, FimH의 구조에 기반하여 디자인된 EB8018은 염증성 세균이 장벽에 부착하는 것을 차단하여 장내 염증 반응을 감소시키게 된다[10]. EB8018의 임상 1상은 2017년 종료되었다[11].
대장 외의 부위에 나타나는 염증성 자가면역 질환으로는 1형 당뇨병, 아토피, 천식, 건선, 류마티스 관절염 등 비교적 잘 알려진 질병에서부터 루프스, 다발성 경화증 등 다양한 질병들이 있다. Evelo에서 개발한 EDP1066는 단일 균주로 구성되어 있으며, 건선, 아토피 등에 대한 임상 1상이 진행 중이다[12]. 같은 회사의 EDP1815 역시 건선, 아토피 등에 대한 임상 시험을 준비 중이며, 류마티스 관절염 및 대장염에 대한 임상도 동시에 계획 중이다. 4D Pharma에서도 MRx0001, MRx0002, MRx0004, MRx0006 등 네 개 후보에 대해 각각 알레르기성 천식, 다발성 경화증(Multiple sclerosis), 천식, 류마티스 관절염 등에 대한 전임상 연구가 진행 중인 것으로 보인다. 필자가 소속된 고바이오랩에서도 자가면역 질환, 특히 아토피 및 건선 등에 대한 임상 1상 시험을 1 ~ 2년 내에 시작할 예정이며, 대장염에 대한 전임상 연구 역시 진행 중이다.
신경 질환
장내 microbiome의 변화가 자폐증, 우울증, 불안장애, 만성 통증 등의 인간의 뇌질환과 연관이 있을 수 있다는 연구결과가 꾸준히 제시되었다[13]. 이는 장-뇌 축(Gut-Brain Axis) 이라는 개념으로 중추 신경계와 장 신경계가 서로 연결되고, micrbiome의 대사 물질이나 구성 물질이 두뇌의 발달이나 기능에 직접적인 영향을 줄 수 있다는 견해[14], 혹은 microbiome 변화에 의해 유발된 염증성 면역 반응이 두뇌 발달 등에 영향을 끼친다는 견해[15] 등으로 확장되어 장내 microbiome 기반의 정신 질환의 치료제 개발이 가능하게 하였다. Evelo Biosciences, 고바이오랩 등에서 면역 조절기능 혹은 두뇌와 연관된 대사 조절 등을 통해 우울증, 불안 등 심리적 질환, 혹은 다발성 경화증 등의 신경 염증 치료제에 대한 연구를 진행하고 있다.
대사질환
20세기 이후 인류에게 새로운 위협이 된 대표적인 질병으로 당뇨병과 심혈관 질환을 비롯한 비만 및 관련 합병증을 들 수 있다. 장내 microbiome의 대사 질환 간의 연구 결과에 따르면 microbiome은 비만과 인슐린 저항성의 발달에 중요한 역할을 한다. 상대적으로 비만인 사람들의 장내 microbiome이 장내 투과성을 방해하고 염증을 유발하는 lipopolysaccharide의 흡수를 증가시켜 인슐린 signaling을 방해, 비만을 촉진하는 역할을 한다는 연구 결과가 있다[16]. 또한 동일한 식단에서도 상대적으로 더 많은 에너지의 축적이 일어나게 만드는 microbiome 등이 확인된 바 있어[17], 비만 및 대사 질환 환자의 장내 균총 조절은 대사 질환의 예방 혹은 직접적인 치료에 대한 잠재력을 가지고 있다.
이러한 연구 결과에 근거하여 비만 관련 대사 질환에 대한 microbiome 기반 치료제 후보로 Caelus Health사에서는 Eubacterium hallii 로 구성된 CP-001를 이용한 임상 1상을 진행 중이다[18]. E.hallii 는 상대적으로 날씬한 사람의 장내에서 주로 발견되며 비만 및 당뇨 마우스 모델을 통한 연구에서 에너지 대사 및 인슐린 민감성을 향상시키는 것이 확인되었다[19]. Caelus Health의 CP-002의 경우 Intestinimonas 속의 균주를 이용한 2형 당뇨의 치료를 목적으로 하고 있다[20]. 이 외에도, LNC Therapeutics의 경우 Christensenella minuta 에 기반한 비만 관련 대사 치료제를 개발하고 있다고 소개되고 있으나[21], 아직까지 알려진 정보는 제한적이다.
비만 등의 대사 이상으로 영향을 받는 대표적 장기로 간이 있다. 내장 microbiome의 dysbiosis가 알코올 및 비알콜성 간 질환, 원발 경화 담관염(primary sclerosing cholangitis) 등과 관련이 있으며 이는 지방간, 간염 및 간경화 등으로 발전하는 데 영향을 끼칠 수 있다[22]. 이러한 간질환 발병에는 microbiome의 영향으로 유도되는 간의 염증 반응뿐 아니라, 단쇄지방산(SCFA), bile acid 대사체, LPS 및 alcohol 등 microbiome에 의해 만들어지고 조절되는 대사체의 영향이 지대하다[23]. BiomX의 경우 독특하게도 이러한 간질환과 microbiome의 상관 관계를 분석하여, 간질환에 pathogen으로 작용하는 bacteria를 선택적으로 제거할 수 있는 phage 기반의 치료제 개발을 목표로 하고 있다. 이 외에도 본 필자가 소속되어 있는 고바이오랩을 비롯하여 Synlogic, Assembly Biosciences등 다양한 회사가 대사 이상에 의한 비만, 간질환, 신장 질환 등의 치료 연구를 전임상 단계에서 진행중이다.
감염성 질환
항생제 및 백신의 도움으로 최근 100년간 대부분의 세균성 전염병들은 더 이상 인류의 위협이 되지 못하게 되었지만, 항생제 저항성을 가지는 내성균에 의한 위협은 여전히 존재하고 있다. 특히, Clostridium difficile 에 의한 감염(CDI) 은 대표적인 병원 감염으로, 최근 수십 년간 환자수는 폭발적으로 증가하였다[24]. C.difficile 은 흔히 정상인의 장에서는 문제를 일으키지 않으나, 병원 치료 시 항생제 처방 등을 받을 경우 병원균으로 작용, 위막성 대장염으로 사망에 이르기까지 할 수 있다. 원인은 항생제가 병원균은 물론 C.difficile 등에 의한 기회성 감염에서 보호하는 역할을 담당하는 정상균까지 제거하기 때문으로, 한번 발병된 CDI는 장내 microbiome이 회복되지 않는 한 치료가 힘들고 재발률이 높게 나타난다[25]. 따라서, 현재 CI 치료를 위해 개발이 진행 중인 열 개 이상의 후보들 중 상당수 제품은 장내에 여러 종류의 bacterial consortia 형태로 주입하여 건강한 microbiome을 회복하는 것을 목표로 하고 있으며, 이 중 두 개 제품은 이미 임상 3상 단계에 진입해 있다. 이 중 Seres Therapeutics의 SER-109는 2015 년 FDA로부터 orphan drug 승인을 받은 제품으로, 세균 포자의 조합으로 구성되어 있다. CDI 재발 환자에 대한 임상 2상 시험을 완료하고[26] 현재 임상 3상 시험이 진행 중이다[27]. Rebiotix의 RBX-2660은 살아있는 bacteria로 구성된 혼합물로 장에 직접 투여하는 일종의 FMT를 변형한 형태이며, 역시 CDI 재발환자 242 명을 대상으로 2017 년 임상 2상 시험이 종료[28], 2019년 완료를 목표로 현재 임상 3상 시험이 진행 중이다[29].
이 외에도, Seres Therapeutics의 SER-262, Rebiotix의 RBX-7455, Finch Therapeutics의 FIN-403가 모두 장내 microbiome을 복원하여 CDI 재발의 치료 효과를 확인하기 위해 임상 1상이 진행 중인 후보들이다. 본 필자가 소속된 고바이오랩 역시 C.difficile 생장 저해능 등의 검증을 통해 디자인된 bacterial consortia로 구성된 치료제를 개발 중이며, 1 ~ 2년 내 임상 시험을 시작할 예정이다. 특이적으로 Synthetic Biologics의 SYN-004는 β-lactam 계열 항생제 투입 시 장내 microbiome의 dysbiosis가 일어나는 것을 방지하기 위해 혈관으로 투여된 항생제가 장에서 분해되는 역할을 하는 예방 약물로, 항생제 투여 이후의 dysbiosis 및 C. difficile 감염을 예방하는 역할을 한다. SYN-004은 임상 2상이 종료되어 곧 임상 3상 시험이 시작될 예정이다[30].
3. 결론
미생물 연구의 진보를 토대로 최근 십 수년간 다양한 분야에서 진행된 microbiome 연구는 결과적으로 이 분야에 대한 의약 산업적 관심을 증가시키는 데 기여하였다. 다양한 학계 및 산업계의 연구 성과들은 기존의 치료제로 완치가 힘들었던 일부 질환에 대해 이러한 미생물 기반의 치료법이 새로운 대안으로 작용할 수 있다는 기대감을 높이고 있다. 개발 성과에 따라 가까운 미래에는 감염성 질환이나 자가 면역 질환뿐만 아니라 정신 질환, 암 등의 광범위한 난치성 질환에 대해 microbiome 기반의 치료제들이 핵심적인 치료법으로 작용할 수 있을 것이다.
참고문헌
1. Turnbaugh, PJ. et al. (2007) The Human Microbiome Project. Nature, 449(7164), 804-810.
2. Sender, R., Fuchs, S. and Milo, R. (2016) Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell, 164, 337-340
3. Whiteside, S. A. et al. (2015) The microbiome of the urinary tract – a role beyond infection. Nat. Rev. Urol., 12, 81-90
4. Huttenhower C, et al. (2012) Structure, function and diversity of the healthy human microbiome. Nature, 486(7402), 207-214.
5. Shreiner AB, Kao JY, Young VB (2015) The gut microbiome in health and in disease. Curr Opin Gastroenterol., 31(1), 69-75.
6. Persistence Market Research Pvt. Ltd., (06.Feb.2018), Worldwide Microbiome Therapeutic Market to Reach US$ 897.3 Mn by 2025. PRNewswire (NEW YORK)
7. Mowat, C. et al. (2011). Guidelines for the management of inflammatory bowel disease in adults. Gut, 60(5), 571-607.
8. NCT02704728: Study of Bacteroides Thetaiotaomicron in Young People Aged 16 to 18 Years With Stable Crohn’s Disease. ClinicalTrials.gov
9. NCT02618187: A Study to Evaluate the Safety, Tolerability and Microbiome Dynamics of SER-287 in Subjects With Mild-to-Moderate Ulcerative Colitis. ClinicalTrials.gov
10. Sivignon, A. et al. (2017) The potential of FimH as a novel therapeutic target for the treatment of Crohn’s disease. Expert. Opin. Ther. Targets., 21(9), 837-847.
11. NCT02998190: First-in-Human Single and Multiple Dose of EB8018. ClinicalTrials.gov
12. NCT03542994: A Study of EDP1066 in Healthy Participants and Participants With Mild to Moderate Psoriasis and Atopic Dermatitis. ClinicalTrials.gov
13. Mayer, EA. et al. (2014) Gut Microbes and the Brain: Paradigm Shift in Neuroscience. J Neurosci, 34(46), 15490-15496
14. Arentsen, T. et al. (2017) The bacterial peptidoglycan-sensing molecule Pglyrp2 modulates brain development and behavior. Mol Psychiatry ,22, 257-266
15. Kim, S. et al. (2017) Maternal gut bacteria promote neurodevelopmental abnormalities in mouse offspring. Nature 549(7673), 528-532
16. Caricilli AM. and Saad MJA. (2013) The role of gut microbiota on insulin resistance. Nutrients, 5(3), 829.51.
17. Turnbaugh, PJ. et al. (2016) An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 444(7122), 1027.131.
18. Chu, W. (30.Nov.2017) DuPont and Ireland’s APC venture forward in microbiome-inspired pact. NutraIngredients.com (Crawley, UK)
19. Udayappan, S. et al. (2016) Oral treatment with Eubacterium hallii improves insulin sensitivity in db/db mice. NPJ Biofilms and Microbiomes, 2(1), 16009.
20. Bui, TP. et al (2015) Production of butyrate from lysine and the Amadori product fructoselysine by a human gut commensal. Nat Commun. 6:10062.
21. Gray, N. (11.Jun.2018) Biotech focus: LNC to shift away from nutrition as it eyes promise in microbiome therapies., NutraIngredients.com (Crawley, UK)
22. Tilg H, Cani P.D., and Mayer E.A. (2016) Gut microbiome and liver diseases. Gut, 65(12), 2035-2044.
23. Poeta, M., Luca Pierri, L., and Vajro, P. (2017) Gut-Liver Axis Derangement in Non-Alcoholic Fatty Liver Disease. Children, 4, 66
24. Stephen M Vindigni, SM. and Surawicz, CM. (2015), C. difficile Infection: Changing Epidemiology and Management Paradigms. Clin. Transl. Gastroenterol., 6(7): e99
25. Beaugerie L, et al. (2003) Antibiotic-associated diarrhoea and Clostridium difficile in the community. Aliment. Pharmacol. Ther., 17(7), 905-912.
26. NCT02437487: SER-109 Versus Placebo to Prevent Recurrent Clostridium Difficile Infection. ClinicalTrials.gov
27. NCT03183128: ECOSPOR III - SER-109 Versus Placebo in the Treatment of Adults With Recurrent Clostridium Difficile Infection (ECOSPORIII) ClinicalTrials.gov
28. NCT01925417: Microbiota Restoration Therapy for Recurrent Clostridium Difficile-associated Diarrhea (PUNCH CD) ClinicalTrials.gov
29. NCT03244644: Microbiota Restoration Therapy for Recurrent Clostridium Difficile Infection (PUNCHCD3) ClinicalTrials.gov
30. NCT02563106: A Study of SYN-004 for the Prevention of C.Diff in Patients With a LRTI. ClinicalTrials.gov
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update