| 피부 재생을 위한 줄기세포 유래 세포 외 소포의 응용 | |
|---|---|
| Date 2020-07-30 16:29:46 |
|

교수
강원대학교 생물의소재공학과
juhyunpark@kangwon.ac.kr
1. 서론
피부의 노화는 크게 내인성 요인과 외인성 요인에 의해 유발되는데 내인성 요인으로는 나이가 들어가며 나타나는 연대학적 노화가 있고, 외인성 요인으로는 자외선 노출에 의한 광노화가 대표적이다. 연대학적 노화의 경우 진피층의 위축으로 인한 피부의 탄력 저하와 미세한 주름 형성이 주로 나타나지만, 광노화의 경우 거칠고 깊은 주름이 생기며 불균일한 색소 침착, 변색, 그리고 심한 경우 피부암으로 이어지는 특징을 보인다 [1]. 피부는 표피, 진피, 그리고 피하 조직으로 구분되는데 각질층을 포함하는 표피는 피부의 최외곽에 위치하며 인체를 외부 자극으로부터 보호하는 동시에 수분이 소실되는 것을 억제한다. 진피는 피부 혈관, 신경, 모낭, 땀샘 등이 위치하여 있는데 이 중 모세혈관은 전체 피부 조직을 건강하게 유지하기 위한 산소와 영양분을 전달하는 역할을 한다. 진피 조직의 탄력성과 표피 조직과의 결합 강도는 콜라젠(collagen), 엘라스틴 (elastin)과 같은 섬유성 단백질의 진피 내 함량에 의해 결정되는데 노화가 진행되면 다양한 이유에 의해 콜라젠과 엘라스틴 함량이 감소하여 피부에 주름 형성이 촉진된다 [2].
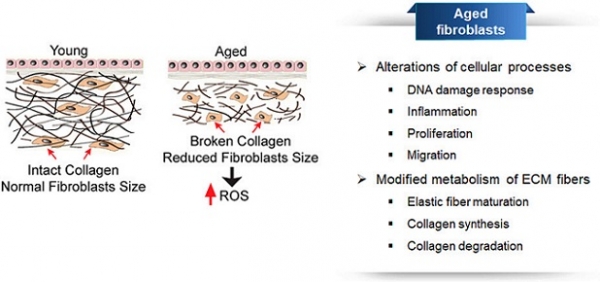
섬유아세포 (fibroblasts)는 진피층에 존재하는 가장 대표적인 세포로 콜라젠, 엘라스틴과 같은 세포 외 기질 (extracellular matrix, ECM)의 합성과 유지에 결정적인 역할을 한다. 내인성 혹은 외인성 요인에 의해 노화가 진행되면 섬유아세포의 성장(proliferation), 이동 (migration), 그리고 콜라젠과 같은 섬유성 단백질 합성이 감소하게 된다. 또한, 노화된 섬유아세포에서는 세포 외 기질을 분해하는 MMP (matrix metalloproteinase)라는 효소의 분비량이 증가하는데 그 결과 진피 조직의 탄력성과 강도가 감소하고 주름이 형성되는 결과로 이어지게 된다 [3,4].
그림 1. 노화에 따른 진피층 내 섬유아세포의 생리학적 특성 변화 [4].
그런 이유로, 진피층의 섬유아세포를 자극하여 성장과 세포 외 기질 합성을 촉진함으로써 노화에 따른 피부 조직의 소실을 회복시키는 기술이 주목을 받고 있는데, 최근에는 이를 위해 줄기세포 유래 세포 외 소포 (extracellular vesicle)를 활용하려는 연구가 활발히 진행 중이다. 본 기고에서는 피부 재생을 위한 줄기세포 유래 세포 외 소포의 활용과 관련된 최신 연구 동향을 살펴보고자 한다.
2. 세포 외 소포의 구성 및 기능
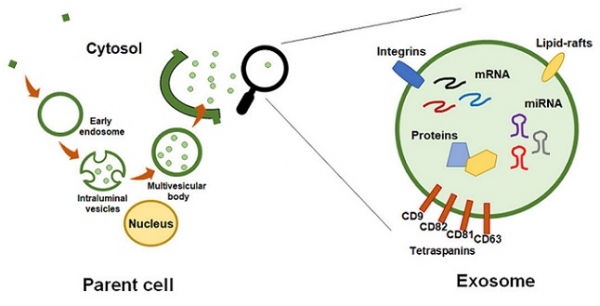
세포 외 소포는 이중 지질층 (lipid bilayers)으로 구성된 나노미터에서 마이크로미터 크기의 소낭으로 세포에서 자연적으로 분비된다. 세포 외 소포는 생성 기작과 크기 등에 따라 엑소좀 (exosome), 미소낭포 (microvesicle), 외막 소포 (outer membrane vesicle) 등으로 구분되는데 이 중 엑소좀과 미소낭포가 대표적이다. 엑소좀과 미소낭포는 세포에서 생성되는 방법에서 두드러진 차이가 있는데 엑소좀은 초기 엔도솜 (endosome)에 함입되어 다포성소체 (multivesicular body)를 만든 다음 세포의 원형질막 (plasma membrane)과 결합하여 세포 밖으로 배출되는 반면, 미소낭포는 이러한 과정 없이 원형질막이 바깥쪽으로 솟아 나와 세포로부터 분비된다 [5]. 그러나 이들은 세포 유래 물질을 포함하면서 동시에 이중 지질층으로 둘러싸인 소포체라는 점에서 명확히 구분되기는 어려우며 실제로도 많은 경우 엑소좀과 미소낭포를 완전히 구분하기보다는 어느 정도 혼합된 상태에서 연구가 이뤄지고 있다. 진핵세포뿐만 아니라 박테리아를 비롯한 원핵세포에서도 세포 외 소포가 생성되는 만큼, 이에 관한 연구도 활발히 진행되고 있으나 여기에서는 주로 포유동물 세포와 같은 진핵세포 유래 세포 외 소포에 대해 초점을 맞추어 기술하고자 한다.
그림 2. 엑소좀의 세포 내 생성 및 구성
세포 외 소포는 공여 세포의 원형질막과 같은 지질 이중막으로 구성되어 있는데 그 내부에는 공여 세포의 생물학적 특징을 반영하는 세포 특이 성분들 (단백질, 각종 RNA, 인지질 등)이 포함되어 있다 [6,7]. 최근 연구결과에 따르면, 세포가 세포 외 소포를 생성하는 것은 이들 세포 특이 성분들을 주변의 다른 세포 혹은 체내 다른 조직에 있는 세포에 수송하여 특정한 생물학적 신호를 전달하기 위함으로 알려져 있는데 이에 따라 세포 외 소포는 암, 대사질환 등 다양한 질병에 대한 진단에 바이오마커로 활용되고 있다 [5]. 한편, 사이토카인, 성장인자, 짧은 가닥 RNA (miRNA, siRNA) 등을 각종 조직의 세포에 전달하여 생리활성을 조절하는 기술의 개발이라는 관점에서, 다른 세포막과 효과적으로 융합할 수 있는 세포 유래 지질 이중막으로 구성되어 있으면서 각종 활성 성분들을 안정적으로 함유하는 세포 외 소포는 생리활성물질의 전달체로도 많은 관심을 받고 있다. 현재 다양한 종류의 세포에서 유래한 세포 외 소포를 이용하여 피부 상처 [8], 허혈성 뇌졸중 등의 질병을 치료하거나 [9,10] 암세포의 항원을 탑재한 후 해당 암에 대한 항체를 생성하게 하는 백신을 개발하는 연구 [11], 그리고 암의 조기진단 기술과 관련한 임상 연구들이 세계적으로 활발히 진행 중이다.
3. 피부 재생을 위한 줄기세포 유래 세포 외 소포의 응용
줄기세포는 일반 체세포와 비교하여 다양한 종류의 세포로 분화 (differentiation)할 수 있다는 것뿐만 아니라 훨씬 더 많이 증식 (proliferation)할 수 있는 특징도 갖는다. 또한, 줄기세포는 일반적으로 다양한 측분비 인자 (pararine factors)를 분비하여 주변 세포의 증식, 이동 등을 촉진함으로써 손상된 조직의 재생을 돕는다고 알려져 있다. 세포 외 소포는 공여 세포에서 유래한 활성 성분들을 다량 함유하고 이를 안정적으로 다른 세포에 전달함으로써 이러한 측분비 인자의 역할을 할 수 있는 만큼, 세계적으로 줄기세포 유래 세포 외 소포를 이용하여 피부 노화를 억제하거나 노화에 의해 소실된 피부 조직을 재생하려는 연구가 활발히 이뤄지고 있다.
지금까지 인체에서 수득 후 체외에서 배양하기 쉬운 골수 유래 중간엽 줄기세포 (bone marrow-derived mesenchymal stem cell, BM-MSC)가 많이 사용되었지만 [12,13] 최근에는 지방 유래 줄기세포 (adipose-derived stem cells, ASC)[14] 또는 만능줄기세포 (pluripotent stem cell, PSC)를 분화시켜 생성한 성체줄기세포도 세포 외 소포를 얻어내기 위한 공여체로 활용되고 있다 [15]. 많은 연구에서 이들 성체줄기세포 유래 세포 외 소포에 포함된 활성 성분들을 분석하였는데 이러한 분석은 특히 단백질과 짧은 가닥의 micro RNA (miRNA)에 초점이 맞춰 이뤄졌다. 이러한 분석을 통해 성체줄기세포 유래 세포 외 소포 내에 피부 섬유아세포의 성장, 이동 및 ECM 물질의 분비를 촉진하는 사이토카인 (혹은 성장인자), 그리고 이와 관련한 miRNA들이 다수 포함되어 있음이 밝혀졌다 [12-15]. 또한, 신생혈관형성 (angiogenesis)을 촉진하는 한편 면역반응을 억제하는 기능을 가진 성분들도 규명되었는데 이는 노화뿐만 아니라 화상, 당뇨성 궤양, 창상 등의 원인에 의해서도 유발된 피부 손상을 재생하는데 성체줄기세포 유래 세포 외 소포가 활용될 수 있음을 보여준다 [16,17].
4. 피부 재생을 위한 생체재료로써 만능줄기세포 유래 세포 외 소포의 가능성
배아줄기세포 (embryonic stem cell, ESC)는 초기 배아의 배반포 (blastocyst)에서 유래하며 체내 모든 종류의 세포로 분화할 수 있는 특징 (만능성, pluripotency)을 가진다는 점에서 분화능이 제한적인 성체줄기세포와 구분된다. 특히, 배아줄기세포는 무제한 증식할 수 있는 특성 (unlimited self-renewal)도 가지는데 이는 계대 배양의 반복 횟수와 상관없이 안정적으로 배양할 수 있다는 것을 의미한다 [18]. 성체줄기세포의 경우 배양이 반복됨에 따라 생리학적 특성에 변화가 생겨 여기서 생성된 세포 외 소포의 품질에도 영향이 생길 수 있지만, ESC는 이와 같은 문제에서 비교적 자유롭고 이에 따라 품질 관리가 수월하다는 점에서 세포 외 소포의 의학적 응용을 위한 새로운 공여체로 관심을 받고 있다. 한편, 체세포의 후생유전학적 특성을 전환하여 생성한 유도만능줄기세포 (induced pluripotent stem cell, iPSC)도 세포 외 소포 생산을 위한 공여 세포로 ESC와 함께 주목받고 있다.
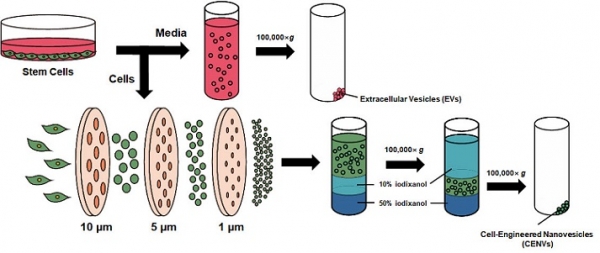
지금까지 ESC, iPSC를 포함한 만능줄기세포 유래 세포 외 소포에 관한 연구는 많이 이뤄지지 않았지만, 최근에 이르러서는 이들 세포 외 소포의 조직 재생, 특히 피부 조직의 재생과 관련한 연구들이 활발히 이뤄지고 있다. 생쥐의 ESC 또는 iPSC에서 유래한 세포 외 소포를 심근경색 생쥐 모델에 주입한 결과 심근 조직의 재생이 유도되었다는 결과뿐만 아니라 [19,20], 생쥐 ESC를 기계적으로 압출하여 인공적으로 생성시킨 세포 외 소포 유사체 (cell-engineered nanovesicle, CENV)가 피부 섬유아세포의 증식을 유도한 연구도 보고되었다 [21]. 또한, 피부 섬유아세포를 자외선에 노출하거나 계대 배양을 반복하여 노화를 유도한 후 인간 iPSC 유래 세포 외 소포 (혹은 CENV)를 처리하였을 때 세포의 증식과 이동이 촉진되는 한편, 노화에 의한 유전자 변화가 억제된다는 연구결과도 보고되었는데 이는 만능줄기세포 유래 세포 외 소포가 피부 노화 억제를 위한 새로운 생체재료로 활용될 수 있음을 시사한다 [22,23].
그림 3. 줄기세포 유래 세포 외 소포와 CENV의 분리법 [23]
5. 결론 및 전망
젊은 시절의 외모를 오랜 기간 유지하고자 하는 것은 동서고금을 막론하고 언제나 존재해온 인류의 기본적인 욕구이다. 때문에, 의료 수준의 발달에 따른 기대수명 증가에 따라 피부 노화를 억제하려는 기술에 대한 수요도 급격히 증대되고 있다. 노화된 피부 조직과 세포를 자극하여 활성을 회복시키기 위해 EGF (epidermal growth factor) 등과 같은 성장인자를 첨가한 기능성 화장품들이 시장에 선보였으나 이들 성장인자의 안정성과 피부 조직 내 전달효율이 낮아 두드러진 효과를 보기는 어려웠다. 줄기세포 유래 세포 외 소포는 피부 재생 기능을 가진 다양한 활성인자를 함유하고 있음은 물론 이를 안정적이면서도 효과적으로 전달할 수 있다는 장점으로 인해 피부 노화 방지를 위한 의학기술 및 기능성 화장품 개발에서 큰 관심이 집중되고 있다. 다만 세포가 배양 중 분비하는 것이니만큼 여기에 포함된 성분들의 구성과 함량 등 품질을 일정하게 유지하는 것은 아직 보고된 바가 많지 않아 더 발전해야 할 필요가 있다는 것이 현재의 일반적인 평가이다. 향후 의료 목적의 응용을 위해서는 각각의 줄기세포 유래 세포 외 소포에 포함된 핵심 성분들을 정확히 규명하고 대량 생산에서도 이들의 구성과 함량을 일정하게 제어할 수 있는 세포 배양 및 세포 외 소포 분리, 분석 기술의 개발이 선행되어야 할 것이다.
참고문헌
1. Varani J. 2010. Fibroblast aging: intrinsic and extrinsic factors. Drug Discov. Today Ther. Strategi.. 7: 65-70.
2. Farage M, Miller K, Elsner P, Maibach H. 2008. Intrinsic and extrinsic factors in skin ageing: a review. Int. J. Cosmet. Sci. 30: 87-95.
3. Tigges J, Krutmann J, Fritsche E, Haendeler J, Schaal H, Fischer JW, Kalfalah F, Reinke H, Reifenberger G, Stuehler K. 2014. The hallmarks of fibroblast ageing. Mech. Ageing Dev. 138: 26-44.
4. Tu Y, Quan T. 2016. Oxidative stress and human skin connective tissue aging. Cosmetics. 3: 28.
5. Ohno S-i, Ishikawa A, Kuroda M. 2013. Roles of exosomes and microvesicles in disease pathogenesis. Adv. Drug Deliv. Rev. 65: 398-401.
6. Choi DS, Kim DK, Kim YK, Gho YS. 2013. Proteomics, transcriptomics and lipidomics of exosomes and ectosomes. Proteomics. 13: 1554-1571.
7. Balaj L, Lessard R, Dai L, Cho Y-J, Pomeroy SL, Breakefield XO, Skog J. 2011. Tumour microvesicles contain retrotransposon elements and amplified oncogene sequences. Nat. Commun. 2: 1-9.
8. Rani S, Ritter T. 2016. The exosome-A naturally secreted nanoparticle and its application to wound healing. Adv. Mater. 28: 5542-5552.
9. Tian T, Zhang H-X, He C-P, Fan S, Zhu Y-L, Qi C, Huang N-P, Xiao Z-D, Lu Z-H, Tannous BA. 2018. Surface functionalized exosomes as targeted drug delivery vehicles for cerebral ischemia therapy. Biomaterials. 150: 137-149.
10. Yang J, Zhang X, Chen X, Wang L, Yang G. 2017. Exosome mediated delivery of miR-124 promotes neurogenesis after ischemia. Mol. Ther. Nucleic Acids. 7: 278-287.
11. Tan A, De La Peña H, Seifalian AM. 2010. The application of exosomes as a nanoscale cancer vaccine. Int. J. Nanomedicine. 5: 889-900.
12. Shabbir A, Cox A, Rodriguez-Menocal L, Salgado M, Badiavas EV. 2015. Mesenchymal stem cell exosomes induce proliferation and migration of normal and chronic wound fibroblasts, and enhance angiogenesis in vitro. Stem Cells Dev. 24: 1635-1647.
13. Kim Y-J, mi Yoo S, Park HH, Lim HJ, Kim Y-L, Lee S, Seo K-W, Kang K-S. 2017. Exosomes derived from human umbilical cord blood mesenchymal stem cells stimulates rejuvenation of human skin. Biochem. Biophys. Res. Commun. 493: 1102-1108.
14. Hu L, Wang J, Zhou X, Xiong Z, Zhao J, Yu R, Huang F, Zhang H, Chen L. 2016. Exosomes derived from human adipose mensenchymal stem cells accelerates cutaneous wound healing via optimizing the characteristics of fibroblasts. Sci. Rep. 6: 32993.
15. Zhang J, Guan J, Niu X, Hu G, Guo S, Li Q, Xie Z, Zhang C, Wang Y. 2015. Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis. J. Transl. Med. 13: 49.
16. Zhang B, Wu X, Zhang X, Sun Y, Yan Y, Shi H, Zhu Y, Wu L, Pan Z, Zhu W. 2015. Human umbilical cord mesenchymal stem cell exosomes enhance angiogenesis through the Wnt4/β-catenin pathway. Stem Cells Transl. Med. 4: 513-522.
17 Zhang B, Yin Y, Lai RC, Tan SS, Choo ABH, Lim SK. 2014. Mesenchymal stem cells secrete immunologically active exosomes. Stem Cells Dev. 23: 1233-1244.
18. Baharvand H, Hajheidari M, Ashtiani SK, Salekdeh GH. 2006. Proteomic signature of human embryonic stem cells. Proteomics. 6: 3544-3549.
19. Khan M, Nickoloff E, Abramova T, Johnson J, Verma SK, Krishnamurthy P, Mackie AR, Vaughan E, Garikipati VNS, Benedict C. 2015. Embryonic stem cell–derived exosomes promote endogenous repair mechanisms and enhance cardiac function following myocardial infarction. Circ. Res. 117: 52-64.
20. Adamiak M, Cheng G, Bobis-Wozowicz S, Zhao L, Kedracka-Krok S, Samanta A, Karnas E, Xuan Y-T, Skupien-Rabian B, Chen X. 2018. Induced pluripotent stem cell (iPSC)–derived extracellular vesicles are safer and more effective for cardiac repair than iPSCs. Circ. Res. 122: 296-309.
21. Jeong D, Jo W, Yoon J, Kim J, Gianchandani S, Gho YS, Park J. 2014. Nanovesicles engineered from ES cells for enhanced cell proliferation. Biomaterials. 35: 9302-9310.
22. Oh M, Lee J, Kim YJ, Rhee WJ, Park JH. 2018. Exosomes derived from human induced pluripotent stem cells ameliorate the aging of skin fibroblasts. Int. J. Mol. Sci. 19: 1715.
23. Lee H, Cha H, Park JH. 2020. Derivation of Cell-Engineered Nanovesicles from Human Induced Pluripotent Stem Cells and Their Protective Effect on the Senescence of Dermal Fibroblasts. Int. J. Mol. Sci. 21: 343.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update