| 해외 유래 전염병 유발 바이러스의 현장 검출을 위한 LAMP 기술의 활용 | |
|---|---|
| Date 2020-07-30 18:42:29 |
|

박사 / 교수
한국생명공학연구원 기술사업화지원센터 / 충북대학교 생명공학부
shlee@kribb.re.kr / jyahn@chungbuk.ac.kr
1. 서론
최근 기온 상승 등의 환경의 변화, 다양한 국가 간의 교류 확대로 인해 국내로 유입되는 감염성 질환 유발 바이러스의 종류가 증가하고 있다. 바이러스성 감염의 확산은 국민보건뿐만 아니라 사회의 정상적인 기능을 저해하고 대규모 사망을 수반하여 큰 경제적·사회적 손실을 불러일으켰다. 이와 같은 신종 바이러스성 질병에 대하여 전세계적으로 신속한 대응 체계를 구축하기 위해 노력하고 있으며, 세계보건기구(World Health Organization; WHO)에서는 R&D Blueprint를 발표하여, 전염병 발생 시에 연구와 개발 활동을 신속하게 활성화시킬 수 있도록 하는 글로벌 전략 및 대비를 위한 상세한 계획을 발표하였다[1]. 대한민국의 경우, 2017년도부터 「제2차 국가 감염병 위기 대응 기술 개발 추진 전략(2017~2021)」을 수립하였고, 이를 통해 국민건강의 위협성, 대유행 가능성, 전략적 지원 필요성 등의 기준을 바탕으로 3대 유형/10대 중점분야를 선정하여 국가 방역체계와 연계한 감염병 관련 R&D를 지원하고 있다. 특히 신·변종 감염병의 조기대응을 위한 융·복합 신기술 개발을 추진하고, 각 감염병에 특화된 핵심 원천 기술의 확보에 크게 투자하여 의료기관 현장에서 활용 가능한 고효율의 진단기술 개발을 추진하고 있다[2]. 이러한 필요성에 의해, 바이러스성 질병의 진단을 위한 핵심적인 원천 기술의 확보가 요구되고 있으며, 실제 현장에 직접 도입하여 활용될 수 있는 기반 기술의 개발 및 연구가 활발히 수행되고 있다.
현재까지 현장 검출 기술의 개발 및 현장으로의 도입을 위해 여러 기술들이 개발되고 있으며 그 중 가장 효율성이 높은 기술로 각광받고 있는 건 핵산(DNA 혹은 RNA)을 증폭하는 기술들이다. 1900년대에 개발된 중합 효소 연쇄 반응(Polymerase chain reaction; PCR)과 이 방법을 응용한 여러 방법들(Reverse transcription PCR, Real-time(q) PCR 등)이 병원체 검출을 위해 주로 활용되었지만, 최근에는 핵산을 온도의 변화 없이 증폭시키는 핵산 등온 증폭 반응이 두각을 드러내고 있다. 핵산 등온 증폭 반응의 종류는 RNA를 증폭시키는 Nucleic acid sequence-based amplification (NASBA)부터 HDA (Helicase dependent amplification), Isothermal multiple displacement amplification (IMDA), Recombinase polymerase amplification (RPA)와 Loop-mediated isothermal amplification (LAMP) 등이 있다.
온도를 반복적으로 변화시켜 세 가지 단계를 반복하여 핵산을 증폭시키는 PCR과는 다르게 핵산 등온 증폭 반응은 온도의 변화가 필요하지 않아 Thermocycler 등의 값비싼 온도 변화 기기가 필요하지 않다[3]. 특히 이 중에서도 LAMP기술은 미량의 핵산을 높은 효율로 증폭시키기는 고민감도의 방법이며, 주형의 총 여섯 부위를 인식하는 프라이머의 활용으로 인해 특이성이 매우 높은 것으로 알려져 있다[4]. 또한 RPA 기법이나 RCA 기법과는 다르게 한 가지 과정으로 진행되어 부가적인 물질 혹은 과정이 필요하지 않다[5]. LAMP 기법은 신속하며 민감도와 특이성이 높다는 장점과 결과 확인이 간편하다는 점이 부각되어, 현장에서 병원체를 검출 및 진단을 수행하기 위한 기반 기술로 주로 활용되고 있다.
본 기고문을 통하여 최근 현장 혹은 현장과 가까운 간이 실험실 등의 자원 제한적인 환경에서 활용될 수 있도록 연구·개발되고 있는 LAMP 기반의 병원체 검출 및 진단 기술의 연구 동향을 살펴보고자 한다.
2. 해외 유래 전염병 유발 바이러스 현황
2.1. 모기 매개 바이러스성 질병 (Mosquito-borne viral disease)
국내에서 모기를 통해 전염이 가능하거나 해외에서 모기에게 물려 국내로 유입 된 바이러스성 질병은 뎅기열, 지카열, 치쿤구니야열, 황열, 일본 뇌염 등이 있다. 해외 유래 감염병 중 6년 연속 1위를 유지하고 있는 뎅기열 유발 바이러스 (Dengue virus; DENV)[6], 임산부에게 감염될 시 태아에게 소두증을 유발할 수 있는 지카 바이러스 (Zika virus; ZIKV)[7], 간 손상으로 인해 황달과 복통을 유발하는 황열 바이러스 (Yellow fever virus; YFV)[8], 신경계에 영향을 미칠 수 있는 웨스트나일 바이러스 (West Nile virus; WNV), 치쿤구니야 바러스 (Chikungunya virus) 등은 주로 Aedes aegypti, Culex tarsalis 등의 모기들에 의해 전파되며, 이들에 의해 감염된 환자들은 대부분 심하지 않은 증상들(발열, 구토, 복통 등)을 나타내지만, 중증으로 진행될 경우 발열 후 수일 이내에 사망할 수 있다. 이 중, YFV, 일본 뇌염 바이러스(Japanese encephalitis virus; JEV)는 개발되어 상용화 된 백신이 존재하지만, 나머지 질병들은 공식적으로 검증된 백신이 없다.
2.2. 코로나 바이러스 유발 감염성 질병
2019년 12월, 중국 후베이성 우한 시에서 최초로 시작된 신종 코로나바이러스 감염병(COVID-19)는 2020년 4월인 최근까지 전 세계적으로 확산되고 있으며, 국내로의 유입은 2020년 1월 중순에 시작되어 현재까지도 확진자의 수가 만명을 넘어가고 있다. 국내에서는 소강상태에 접어들고 있지만 미국, 유럽 쪽은 확진자 수가 하루에 천 명 이상 증가하고 있으며, 사망자 또한 만 명 단위로 증가하고 있는 추세다. 이와 같은 코로나 바이러스에 의한 감염병은 2003년의 중증급성호흡기증후군(Severe Acute Respiratory Syndrom, SARS), 2015년에 유입된 중동호흡기증후군(Middle East Respiratory Syndrome, MERS) 등과 같이 몇 년을 주기로 크게 발병하고 있다. SARS, MERS, COVID-19를 유발하는 바이러스들은 모두 코로나 바이러스(Coronavirus; CoV)에 속한다. CoV는 사람에게 호흡기 질환을 유발하며 일반적인 감기와 비슷한 임상적 증상을 유발하지만 심할 경우 사람의 폐에 작용하여 심각한 질환을 유발하며, 중증으로 번질 경우 사망까지 초래한다. SARS-CoV(SARS-CoV-1, SARS-CoV-2)의 경우, 박쥐에서 유래된 바이러스이며 MERSCoV는 낙타에서 유래된 인간 감염성 바이러스로, 세 CoV 모두 동물과 인간에게 공통으로 감염되어 인수공통감염병을 유발한다[9,10]. 이 바이러스성 질환들을 치료할 수 있는 치료제나, 예방을 위한 백신은 개발 중에 있으나 아직 공식적으로 인증된 백신 및 치료제는 없다.
3. 감염성 질환의 진단을 위한 LAMP의 활용
3.1. LAMP 기법의 개요
모기 매개 질환 유발 바이러스와 코로나바이러스의 검출은 미국 질병통제예방센터(Centers for Disease Control and Prevention, 이하 CDC)의 공식적인 프로토콜에 따르면 항체 기반의 면역학적인 방법과 분자생물학적 기술에 기반 한 실시간 PCR 기법(qRT-PCR)을 활용하여 수행되고 있다[11]. 그러나 면역학적인 방법에서 활용되는 항체의 단가는 높은 편에 속하며, qRT-PCR 방법의 경우엔 값비싼 온도 변화 및 형광 측정을 위한 전문 기기와 전문적 분석 수행을 위한 고급 인력의 활용이 필요하다는 한계가 존재한다. 또한 개발도상국과도 같은 인력 및 도구가 부족한 자원 제한적인 환경(Resource-limited settings)에서 활용되기엔 경제적으로 효율적이지 않다. 이런 가운데, 고리 매개 등온 증폭 반응, 즉 LAMP 기법은 등온에서 미량의 핵산을 증폭하는 방법이며, 검사 결과를 육안으로 간편하게 확인할 수 있다는 장점으로 최근 들어 검출 기반 기술로써 주목 받고 있다. LAMP에 활용되는 재료는 증폭을 위한 반응액과 Bst 중합 효소, 두 쌍 혹은 세 쌍의 특이적인 프라이머들, 주형 가닥이며, 반응을 위한 히팅 블럭이나 항온 수조 같은 등온을 유지하는 간단한 기기다. 온도에 민감하지 않도록 반응 조건을 최적화하여 온도의 유동성이 큰 온열팩, 텀블러 등에서도 수행되는 경우도 있다. LAMP의 반응 시간은 최적화 된 조건에서 최소 15분 ~ 최대 60분이며, 민감도는 주형의 종류에 따라 달라지지만, 최소 약 10 copies로 알려져 있다.
상기 기술된 모기 매개 질환 유발 바이러스와 CoV는 유전체로 RNA를 지닌다. 따라서 각 바이러스의 유전체를 검출하기 위해서는 RNA를 DNA로 치환하는 역전사 (Reverse transcription; RT) 기술이 필요하며, LAMP의 경우 몇 가닥의 DNA만 존재해도 증폭이 이뤄지므로 AMV나 M-MLV RTase 등의 역전사 효소를 LAMP 반응액에 직접 도입하여 한 온도에서 역전사와 증폭 과정이 수행될 수 있다.
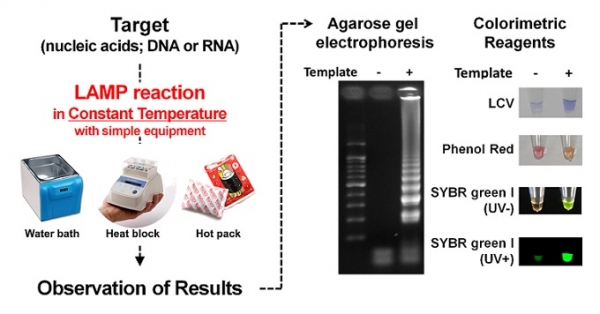
LAMP 기술을 활용한 검출법은 한 온도에서 모든 과정이 이뤄지며 값비싼 기기의 활용과 전문적인 인력의 분석을 필요로 하지 않는다. 색 시약이나 형광 물질을 함께 활용하여 양성과 음성을 간편하게 육안으로 확인할 수 있어, 현장에서 신속하게 검출을 진행할 때 충분히 활용될 수 있다(그림 1).
그림 1. 표적 물질(핵산; DNA 혹은 RNA)의 검출을 위한 LAMP 기술의 활용 모식도.
3.2. LAMP 기술을 응용한 POC 검출 기술
현장 검사 테스트(Point-of-care testing; POCT)를 위한 다양한 방안이 고려되고 있으며, 육안 관찰을 위한 색 시약과 미세 유체 기술 활용 기기(Microfluidic devices), 종이 기반의 간편 반응기기 등이 활발하게 개발되고 있다. 또한 주위에서 자주 볼 수 있는 간편 손난로(Porket warmer), 커피 텀블러 등을 접목하여 전문가가 아닌 이들도 손쉽게 활용할 수 있도록 개발된 방법들도 개발되었다.
3.2.1. 육안 관찰 시약 활용 기반 LAMP 결과 확인
초반에는 LAMP의 결과를 확인하기 위해 PCR 증폭 산물을 확인하는 방법과 유사하게 주로 아가로오즈 겔 전기영동을 활용하였다. 그러나 전기영동 방법은 실험실에서만 수행할 수 있으며, 약 25분 정도의 시간이 부가적으로 추가되기 때문에, 점차 육안으로 결과를 확인할 수 있는 방법들이 고안되었다.
LAMP의 최대 장점 중 하나는 반응 산물의 양이 육안으로 확인할 수 있을 정도로 많아진다는 점이다. 이 점을 활용하여 LAMP의 증폭 산물인 DNA 이중 가닥 사이에 끼어들어 형광을 나타내는 물질(Eva Green, SYBR Green I[12] 등) 이나 증폭되는 산물과 반응해서 결과를 육안으로 활용할 수 있는 시약(Leuco Crystal Violet(LCV)[13] 등), 반응 액의 pH 변화에 따른 색 변화를 나타내는 시약들(Phenol Red, Neutral Red[14] 등)이 주로 활용되고 있다. 최근 들어서는 튜브 내에서 결과 확인을 수행하는 방법에서 더 나아가 형광 정도를 측정하여 수치로 분석할 수 있도록 정형화 된 칩 등의 도구를 활용하는 방안도 고려되었다. Lee, 등(2017)은 MERS-CoV의 검출을 수행하기 위해, 플라스틱 마이크로 챔버 내에서 Evagreen을 포함한 10 ㎕의 LAMP 반응 액을 도입하여 RT-LAMP를 진행한 후 결과를 수치로 측정하여 분석할 수 있도록 고안하였다[12].
또한 LAMP나 RT-LAMP가 가지고 있는 고질적인 문제점이라고 할 수 있는 비특이적인 증폭에 따른 위양성 결과를 개선하고 특이성을 향상시키기 위하여 Dye가 고정된 프라이머를 활용[15]하거나, LAMP barcoding probe 등의 금 나노입자가 포함된 프로브를 활용하는 방법[16], 마찬가지로 금나노입자가 고정된 프로브와 streptavidin-biotin의 결합 반응을 활용하여 수행되는 Lateral-flow 기법(LFA)도 도입되어 색 변화에 대한 결과 분석에 정확성을 보장할 수 있도록 여러 기술들이 개발되고 있다.
3.2.2. 미세 유체 기술 활용 LAMP 수행
색 변화 및 형광을 반응 튜브 내에서 확인하는 일차원적인 방법에서 나아가 미세 유체 제어기기, 종이 기반 기기 등의 손바닥보다 작은 기기들에 적용되어 효율성을 향상시킨 검출 기기가 개발되고 있다.
미세유체 기술(Microfluidic technology)은 마이크로, 나노 크기의 채널에서 유체 조작을 하거나 이를 활용한 응용연구 기술이며, 1980년대에 등장하여 DNA chip, Lab-on-a chip, Microthermal analysis 등에 활용되었다.
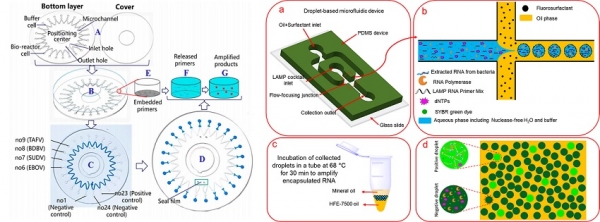
LAMP를 도입한 미세 유체 기기는 주로 적은 양의 시료를 다루거나 여러 개의 표적 시료를 한 개의 칩에서 진단하기 위해 개발되었으며, 표적의 DNA나 RNA 물질을 삽입하여 LAMP를 진행하고, 이를 반응액 내에 포함된 색 시약의 변화로 확인하는 방법 등이 활용되고 있다 (그림 2). Lin, 등(2019)은 바이러스의 검출을 위해 미세 유체 칩 기반의 휴대용 시스템의 개발을 수행하였으며, 형광 물질의 신호를 통해 검출 결과를 실시간으로 기록하는 플랫폼을 제작하였다[17]. 한 번의 시료 획득 후, 시료와 시약이 총 0.94 ㎕가 포함된 반응 액으로 교차 오염 없이 4개의 바이러스를 구별할 수 있으며, 반응과 검출은 50분 내로 수행되어 측정된 검출 한계는 반응 당 10 copies였다. Azizi, 등(2019)은 Droplet 기반의 미세유체 기술과 LAMP를 도입하여 병원체의 검출을 수행하였다. 매우 작은 크기(picoliter-size)의 droplet에서 LAMP를 진행하여 그 결과를 형광을 통해 확인하고 그 droplet 수에 대한 수학적 모델을 적용한 플랫폼을 제안하였다[18].
그림 2. 미세 유체 기술과 LAMP 기법을 결합한 표적 물질의 검출 방법. (A) Lin, X. et al. Micromachines 10(11), 777 (2019). Microfluidic-Chip-Based Portable RT-LAMP System. (B) Azizi, M. et al. ACS Sensors 4(4), 841-848 (2019). RNA-Based LAMP using Droplet Microfluidics.
3.2.3. 종이 기반 Portable devices 활용 LAMP 수행
LAMP 기술을 현장에서 활용하기 위하여 몇 가지의 고려되어야 할 사항들이 있다. POCT, 즉 현장에서 활용되는 기술의 경우 값비싼 Thermocycler 등의 기기나 전문적인 인력의 활용이 없어야 하며, 반응 과정과 결과 확인 또한 간편하게 수행되어야 한다. 이에 부합되는 LAMP 기술의 경제성을 극대화하기 위해 최근 들어 종이를 활용한 검출 플랫폼의 개발이 활발하게 진행되고 있다 (그림 3).
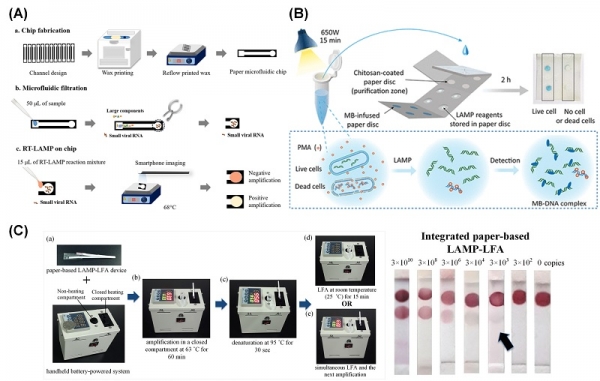
그림 3. 종이 기반의 LAMP 기술 활용 표적 물질의 검출. (A) Trieu, P. T. et al. Sci Rep. 8, 12438 (2018). Smartphone Detection with Paper Microfluidic Chips. (B) Azizi, M. et al. Analytical Chemistry, 91(17), 11013-11022 (2019). Paper-Based All-in-One Origami Microdevice. (C) Choi, J. R. et al. The Analyst, 141(10), 2930–9 (2016).
Kaarj, 등(2018)은 종이 미세 유체 칩을 활용하여 ZIKV를 검출할 수 있는 플랫폼을 제작하였다[19]. 그들은 ZIKV의 RNA를 추출하고 이를 RT-LAMP로 검출하기 위하여, 적정한 온도 조건과 활용된 Whatman paper의 종류 및 pore 크기를 최적화하였다. 또한 RT-LAMP 진행의 실시간 정량화를 위해서 스마트폰의 카메라 기능을 활용한 phenol red 포함 반응액의 색 변화를 감지하는 색상 모니터링을 5분-40분 동안 수행하였다. 이후에 검사 대상물을 연속적으로 희석하여 검출의 한계를 확인하였으며, 수돗물, 사람의 소변, 혈장 등의 실시간 검사 대상물을 활용하여 검출을 수행, LAMP 기반의 종이 미세 유체 칩의 현장 응용성을 확인하였다. Tung, 등(2019)은 LAMP 기반의 오리가미 종이 마이크로디바이스(origami paper microdevice)를 활용하여, 병원체의 종류를 구별하고 생사 여부를 확인할 수 있는 복합적인 (Multiple) 검출 방법을 고안하였다[20]. 부분적으로 양각된 마이크로 챔버를 구축하였으며, 민감하고 특이적인 LAMP의 진행을 위해 접을 수 있는 분할된 구역(splitting, purification, wicking, reaction, and dye pads)으로 구성되었다. 여기서 활용된 종이 마이크로디바이스 내에서는 추출된 유전체를 정전기적으로 포착하기 위해 키토산을 이용하였고, LAMP의 결과를 확인하기 위해 methylene blue 시약을 활용하였다. 총 LAMP의 반응 시간은 30분이었으며, 색 변화를 측정하기 위한 10분의 반응 시간이 추가되어 진행되었다. Choi, 등(2016)은 기존에 주로 활용되고 있는 Lateral Flow 기법(LFA)을 개선하는 방안을 고안하였다[21]. 시료에서 얻을 수 있는 유전체 핵산이 미량으로 존재하는 경우, 핵산의 증폭은 필수적으로 필요하다. 이를 위하여 저자들은 휴대용 배터리 구동 시스템 기반 LAMP 진행을 도입한 LFA를 개발하였으며, 개발된 기법의 한계는 3 x 10-3 copies로 확인되었다.
3.2.4. 간이 도구(텀블러, 손난로 등) 활용 LAMP 수행
최근 종이에서 더 나아가 주위에서 쉽게 볼 수 있는 도구나 기기를 활용하여 LAMP를 진행하는 플랫폼들이 개발되고 있다. 항온 수조나 히팅 블럭 등도 간단한 기기라고 할 수 있지만, 일반적인 가정이나 일반인이 활용하기엔 한계가 있다. Jiang, 등(2018)이 개발한 ZIKV의 진단 플랫폼은 바이러스의 파쇄를 위한 물질이 포함된 Ball 기반의 밸브와 유전체 RNA를 정제하여 얻기 위한 종이로 된 부분, LAMP를 진행하는 부분으로 구성되어 있다[22]. 종이 기반의 플랫폼은 상업적으로 이용이 가능한 커피 머그잔, 혹은 텀블러 등의 일정한 온도에서 RT-LAMP를 진행할 수 있도록 고안되었다. 증폭 결과는 SYBR green I을 활용하여 관찰하거나 스마트폰 카메라 기능을 활용하여 색 검출을 수행하였다. 이 플랫폼을 활용하여 인간의 소변, 침 시료에서 ZIKV의 검출을 수행하였고, 재현성 또한 확인하였다. 또한 Baek 등 (2018)은 일반인들이 주로 사용하는 손난로(Porket warmer)를 활용하여 바이러스 RNA의 검출을 수행하였다[23].
4. 결론
최근 중국에서 전 세계로 퍼져 나가고 있는 COVID-19는 사람에게 감염되어 경제적·사회적으로 심각한 피해를 주고 있다. 우리나라의 경우 훌륭한 방역 진행과 건강 보험 등의 여러 노력으로 인해 소강상태에 접어들고 있지만, 전 세계적으로는 아직도 피해가 확산되고 있는 실정이다. COVID-19의 치료제가 없는 지금 시점에서, 전파력이 빠른 SARS-CoV-2의 확산을 막기 위해서는 신속하고 정확한 진단 기법의 개발이 필수적일 것이다. 이는 SARS-CoV-2의 감염뿐만 아니라 해외에서 유입되는 모든 감염성 바이러스 질병에 대한 필수적인 대책이라고 할 수 있다.
또한 장비 및 재료가 한정적인 현장(Resource-limited settings)에서 활용되는 기술들은 경제성을 고려하여 값싼 재료와 방법의 용이성을 항상 고려해야 한다. 이는 WHO에서 제안한 ASSURED criteria에 제시되어 있는 내용으로, 이 기준들은 한정적인 현장에서뿐만 아니라 일반적인 검출 및 진단을 위한 기법들에 도입되어야 할 필요가 있다. 최근 개발되고 있는 LAMP 기반의 검출 기술들은 민감하고(sensitive), 특이적이며(specific), 간편하고(user-friendly), 신속하고 정확하다(rapid and robust)는 장점이 있으며, 매우 간편한 기기의 활용이 가능(equipment-free)하다. 그러나 LAMP 기술이 qRT-PCR과 같이 공식적인 검출 기법으로 인정받기 위해서는 아직 LAMP에 대한 실질적인 활용 연구 및 개발이 활발하게 수행되어야 할 것이라 사료된다.
[참고문헌]
[1] WHO. https://www.who.int/teams/blueprint.
[2] 질병관리본부(KCDC), (공개)제2차_국가 감염병 위기 대응 기술 개발 추진 전략_19년도_시행계획_최종 (2019).
[3] Vásquez, A.M., Zuluaga, L., Tobón, A. et al. Diagnostic accuracy of loop-mediated isothermal amplification (LAMP) for screening malaria in peripheral and placental blood samples from pregnant women in Colombia. Malar J 17, 262 (2018).
[4] Boldbaatar B, Inoue S, Sugiura N, Noguchi A, Orbina JR, Demetria C, Miranda ME, Yamada A. Rapid detection of rabies virus by reverse transcription loop-mediated isothermal amplification. Jpn J Infect Dis. 62(3):187-91 (2009).
[5] Phuoc Tung Trieu and Nae Yoon Lee. Paper-Based All-in-One Origami Microdevice for Nucleic Acid Amplification Testing for Rapid Colorimetric Identification of Live Cells for Point-of-Care Testing. Analytical Chemistry, 91 (17), 11013-11022 (2019).
[6] Timothy P. Endy, Supamit Chunsuttiwat, Ananda Nisalak, Daniel H. Libraty, Sharone Green, Alan L. Rothman, David W. Vaughn, Francis A. Ennis, Epidemiology of Inapparent and Symptomatic Acute Dengue Virus Infection: A Prospective Study of Primary School Children in Kamphaeng Phet, Thailand, American Journal of Epidemiology, 156(1), 40-51 (2002).
[7] Raghunath, Pendru. “Does Zika Virus Really Causes Microcephaly in Children Whose Mothers Became Infected with the Virus during Their Pregnancy?.” Iranian journal of public health 47(4), 613-614(2018).
[8] Reiter P. Yellow fever and dengue: a threat to Europe?, Euro Surveillance. 15(10), 19509 (2011).
[9] Wilder-Smith, Annelies, et al. Can we contain the COVID-19 outbreak with the same measures as for SARS?, The Lancet Infectious Diseases, Volume 0, Issue 0 (2020).
[10] Gorbalenya, A.E., Baker, S.C., Baric, R.S. et al. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol (2020).
[11] WHO. "Symptoms, Diagnosis, & Treatment". Centers for Disease Control and Prevention. USA.gov. 2018-12-10. (2019).
[12] Lee, S. H., Baek, Y. H., Kim, Y. H., Choi, Y. K., Song, M. S., & Ahn, J. Y.One-Pot Reverse Transcriptional Loop-Mediated Isothermal Amplification (RT-LAMP) for Detecting MERS-CoV. Frontiers in microbiology, 7, 2166 (2017).
[13] Roy, Sharmili & Mohd-Naim, Noor & Safavieh, Mohammadali & Ahmed, Minhaz. Colorimetric Nucleic Acid Detection on Paper Microchip Using Loop Mediated Isothermal Amplification and Crystal Violet Dye. ACS Sensors. 2. (2017).
[14] Nathan A. Tanner, Yinhua Zhang, and Thomas C. Evans Jr. Visual detection of isothermal nucleic acid amplification using pH-sensitive dyes. BioTechniques, 58(2), 59-68 (2015).
[15] Cameron S. Ball, Yooli K. Light, Chung-Yan Koh, Sarah S. Wheeler, Lark L. Coffey, and Robert J. Meagher. Quenching of Unincorporated Amplification Signal Reporters in Reverse-Transcription Loop-Mediated Isothermal Amplification Enabling Bright, Single-Step, Closed-Tube, and Multiplexed Detection of RNA Viruses. Analytical Chemistry, 88(7), 3562-3568 (2016).
[16] Se Hee Lee, Gna Ahn, Myung-Su Kim, Ok Chan Jeong, Jong Hyun Lee, Hyuck Gi Kwon, Yang-Hoon Kim, and Ji-Young Ahn. Poly-adenine-Coupled LAMP Barcoding to Detect Apple Scar Skin Viroid. ACS Combinatorial Science, 20(8), 472-481 (2018)
[17] Lin, X., Jin, X., Xu, B., Wang, R., Fu, R., Su, Y., Jiang, K., Yang, H., Lu, Y., Guo, Y., & Huang, G. Fast and Parallel Detection of Four Ebola Virus Species on a Microfluidic-Chip-Based Portable Reverse Transcription Loop-Mediated Isothermal Amplification System. Micromachines, 10(11), 777 (2019).
[18] Morteza Azizi, Meisam Zaferani, Soon Hon Cheong, and Alireza Abbaspourrad. Pathogenic Bacteria Detection Using RNABased Loop-Mediated Isothermal-Amplification-Assisted Nucleic Acid Amplification via Droplet Microfluidics. ACS Sensors, 4(4), 841-848 (2019).
[19] Kaarj, K., Akarapipad, P. & Yoon, J. Simpler, Faster, and Sensitive Zika Virus Assay Using Smartphone Detection of Loopmediated Isothermal Amplification on Paper Microfluidic Chips. Sci Rep 8, 12438 (2018).
[20] Phuoc Tung Trieu and Nae Yoon Lee. Paper-Based All-in-One Origami Microdevice for Nucleic Acid Amplification Testing for Rapid Colorimetric Identification of Live Cells for Point-of-Care Testing. Analytical Chemistry, 91(17), 11013-11022 (2019).
[21] Choi, J. R., J. Hu, Y. Gong, S. Feng, W. A. B. Wan Abas, B. Pingguan-Murphy, and F. Xu. An integrated lateral flow assay for effective DNA amplification and detection at the point of care. The Analyst, 141(10), 2930–9 (2016).
[22] X. Jiang, J. C. Loeb, C. Manzanas, J. A. Lednicky, Z. H. Fan, Valve-Enabled Sample Preparation and RNA Amplification in a Coffee Mug for Zika Virus Detection. Angew. Chem. Int. Ed. 57, 17211 (2018).
[23] Yun Hee Baek, et al. Simple, Rapid and Sensitive Portable Molecular Diagnosis of SFTS Virus Using Reverse Transcriptional Loop-Mediated Isothermal Amplification (RT-LAMP). J. Microbiol. Biotechnol. 28(11), 1928~1936 (2018).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update