| 이산화탄소 저감을 위한 탄산무수화효소 기반 고효율 생촉매 개발 | |
|---|---|
| Date 2020-07-31 11:17:11 |
|

교수
경상대학교 생명과학부
jobh@gnu.ac.kr
1. 서론
이산화탄소 (CO2)는 대표적인 온실가스로서 다양한 환경 문제를 일으키므로 대기 중 이산화탄소 배출을 감소시키기 위한 노력이 지속되고 있다. 물리·화학적 이산화탄소 분리 및 포집 기술과 더불어, 탄산무수화효소 (carbonic anhydrase; CA)를 이용한 생체 모방 CO2 포집 및 활용 기술이 최근 각광받고 있다. CA는 인간으로부터 박테리아에 이르기까지 모든 생명체가 지니고 있는 효소로서 α, β, γ 클래스를 포함하여 수렴 진화 (convergent evolution)를 통해 형성된 7 종류의 클래스로 나뉜다. CA는 수용액 상에서 아래와 같은 CO2 수화 반응을 매우 빠른 속도로 촉진시키며, 이를 통해 생체 내 CO2 대사·수송 및 pH 조절 등에 중요한 역할을 수행한다.
CO2 + H2O → HCO3- + H+
기존 아민 또는 탄산칼륨 기반의 연소 후 CO2 포집 기술뿐만 아니라 전기화학적 포름산 생산, CO2 광물화, 광합성 미세 조류를 이용한 생물학적 CO2 활용 등에 친환경 촉매인 CA를 적용하면 CO2 전환 속도를 촉진시킬 수 있으며 이를 통해 잠재적인 비용 절감 효과를 얻을 수 있다. 하지만 일반적으로 CA가 적용될 것으로 기대되는 공정조건은 고온 환경이므로 이러한 극한 환경에서 단백질 촉매인 효소의 불안정성을 극복해야 한다. 이는 효소 교체 주기를 극대화하기 위해서도 중요하다. 이 밖에도 재활용성 향상, 효소의 경제적 생산 등이 필요하며 각 공정의 세부 환경 조건이 다르므로 그에 맞는 맞춤형 촉매 제작이 요구된다. 본 기고문에서는 CA 기반 고효율 생촉매 개발을 위한 효소 발굴, 단백질 공학적 개량, 전세포 촉매 구축 등 전략에 대해 간략히 소개하고 향후 전망에 대해 고찰하고자 한다.
2. 본론
2.1. 신규 CA 발굴
발전소 및 제철소 등의 배가스 중 CO2를 저감하는 연소 후 습식 CO2 포집 기술에 CA를 적용하기 위해서는 60°C 이상의 고온 환경에서 장기간 활성을 유지할 수 있는 CA가 필요하다. 이러한 극한 환경에 적용할 수 있도록 주로 고온균으로부터 CA가 발굴되었다. 대표적으로 70°C 이상의 최적 생장 온도를 지니는 Thermovibrio ammonificans, Persephonella marina, Sulfurihydrogenibium yellowstonense, Thermosulfurimonas dismutans 등의 α 클래스 CA가 연구되었으며 이들은 해저 열수구 또는 온천에서 발견된 박테리아들이다. 이들 중 T. ammonificans의 CA는 수용액 조건 하에 60°C에서 60일 이상의 반감기를 가진 것으로 보고되었다 [1].
100°C 이상의 최적 생장 온도를 지니는 초고온성 고세균은 더욱 안정성이 뛰어난 CA의 원천으로 볼 수 있다. 하지만 이들이 지닌 γ 클래스 CA 유전자를 대장균 발현 시 γ 클래스 특유의 접힘을 지니고 있음에도 불구하고 효소 활성은 없는 것으로 나타났으며 그 원인은 아직까지 불분명하다 [2]. CA 기술의 혁신을 위해 이러한 초고온성 미생물 CA에 대한 깊이 있는 연구 및 성공적 발굴이 선행되어야 할 것으로 보인다.
2.2. 단백질 공학적 CA 개량
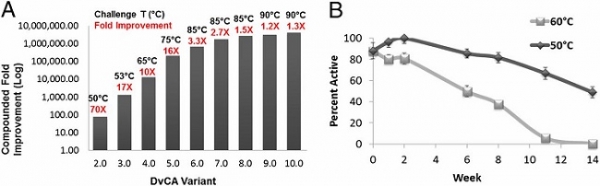
단백질 공학의 다양한 설계 전략을 통해 아미노산 서열을 치환하여 더욱 뛰어난 효소 변이체를 얻을 수 있다. CA 개량의 대표적인 성공 사례는 미국 Codexis社에 의한 연구이다. 9 라운드에 걸친 방향적 진화(directed evolution) 전략을 통해 Desulfovibrio vulgaris 유래의 β 클래스 CA의 고온 및 아민 용매에 대한 안정성을 야생형 대비 4,000,000배 증가시켰으며, 개량된 효소를 이용하여 파일럿 스케일에서 25배 향상된 CO2 흡수 효율을 달성했다 (그림 1) [3].
그림 1. (A) 방향적 진화를 통한 D. vulgaris CA의 안정성 증가. (B) 아민 계열 흡수제인 4.2 M MDEA에서의 효소 안정성. 50°C와 60°C에서의 효소 반감기는 각각 14주와 6주로 계산됨. 본 그림은 참고문헌[3]에서 발췌함.
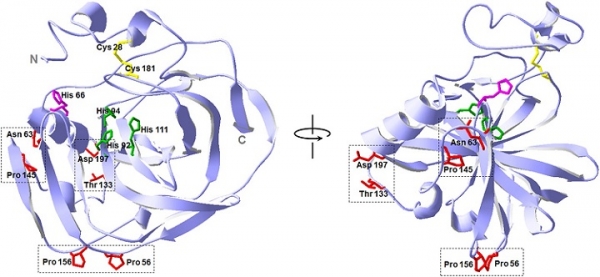
효소 안정성 증대를 위한 합리적 디자인 방법 중 이황화결합 도입은 매우 효과적인 방법으로 알려져 있으며, 단백질이 변성되었을 때의 엔트로피를 감소시켜 불안정화하여 상대적으로 native 상태의 안정성을 향상시키는 전략이다. 자연상태에서 이황화결합을 가지고 있는 박테리아 유래 CA의 시스테인 위치를 이황화결합이 결손 된 인간 유래 CA에 그대로 이식하여 안정성을 향상시킨 사례가 있었으나, 이는 도입 위치가 제한적이라는 한계를 지닌다. 이를 극복하기 위해 de novo 설계를 통해 Neisseria gonorrhoeae 유래의 CA에 이황화결합을 도입한 연구가 보고되었으며, 효소 안정성이 8배 증가되었다 (그림 2) [4].
그림 2. De novo 설계를 통한 CA 안정성 향상을 위한 이황화결합 위치 선정. 본 그림은 참고문헌[4]에서 발췌함.
높은 염 농도의 CO2 포집제에서의 안정성을 확보하고 배가스 불순물에 의한 활성 저해를 최소화하기 위해서 CA의 내염성이 중요한 특질임이 밝혀졌다 [5]. 내염성을 증대시키기 위한 전략으로 CA의 표면 잔기를 치환하여 음 전하 포텐셜을 띠도록 만들면 염의 양이온과의 직·간접적 상호작용을 통해 효소를 안정화할 수 있으며 활성 부위의 저해제로 작용하는 음이온의 접근을 감소시킨다는 것이 증명되었다 (그림 3) [6].
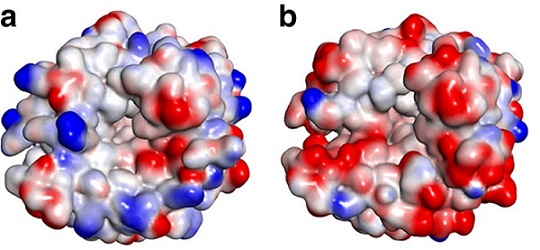
그림 3. 내염성 증대를 위한 단백질 표면 잔기 치환을 통한 표면 정전기 포텐셜 변화. (a) 야생형 CA. (b) 개량 CA. 본 그림은 참고문헌[6]에서 발췌함.
상기 전략들은 초기 안정성이 낮은 중온성 CA로부터 시작하여 개량하였으므로, 안정성 향상 정도가 매우 큼에도 불구하고 기존에 자연계에서 발굴된 고온성 CA에 비해 현저히 증가된 안정성을 지니지는 못한다. 향후 CA 개량 연구는 안정성 및 재활용성을 향상시킬 수 있는 효소 고정화와 더불어, 고온성 CA의 안정성을 최소 수 배에서 수 십 배 향상시키기 위한 효과적인 단백질 공학 전략 개발 및 적용에 초점이 맞춰져야 할 것으로 생각된다.
2.3. 전세포 촉매
미생물을 이용한 전세포 촉매 구축은 효소 정제를 위한 단계가 불필요하고 세포를 회수하여 재사용 가능하므로 경제적인 효소 활용을 가능하게 한다. 하지만 세포막에 의한 물질 전달 저해에 의해 낮은 효소 활성을 보일 수 있으므로 이러한 문제를 해결하는 것이 중요하다. 초기 CA를 지닌 CO2 저감용 전세포 촉매는 대장균 또는 효모에서 CA를 세포 표면에 발현하여 물질 전달 저해를 최소화하는 전략으로 구축되었다 [7,8]. 이러한 전세포 촉매 시스템을 이용하면 CO2 광물화 비용을 10% 이상 절감할 수 있다고 보고되었으나, 세포 표면 발현량이 매우 낮다는 한계점을 지녔다. 이후 물질전달 저해와 발현량을 타협하는 전략으로 대장균의 세포 간극에 CA를 발현한 연구가 보고되었으며 이는 기존 세포 표면 발현 전세포 촉매 대비 30배 가량 높은 활성을 지녔다 [9].
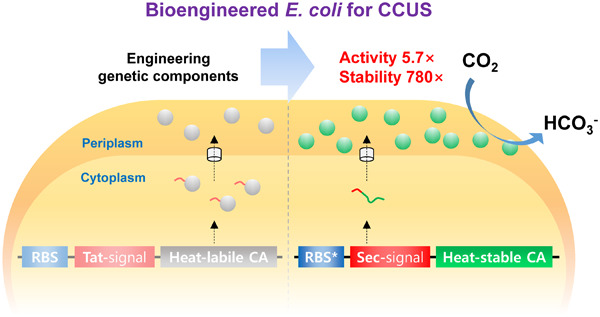
그림 4. 유전적 요소 개량을 통한 세포 간극 전세포 촉매 활성 극대화 전략. 본 그림은 참고문헌[10]에서 발췌함.
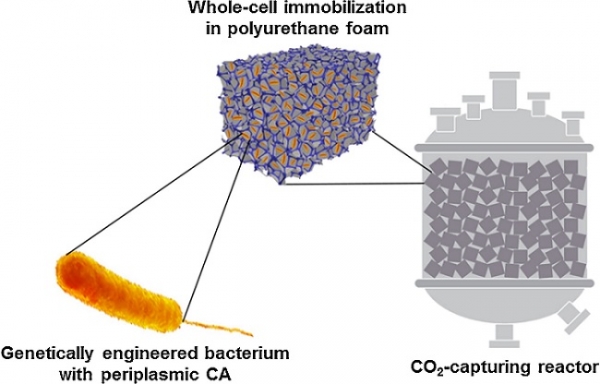
세포 간극 전세포 촉매 구축을 위한 주요 유전적 요소인 CA 유전자, 신호 서열 및 리보솜 결합 부위 (RBS) 등을 개량하여 기존 세포 간극 전세포 촉매 대비 약 6배 높은 활성을 보인 전세포 촉매가 최근 소개되었다 (그림 4) [10]. 박테리아 CA는 일반적으로 이황화결합을 지니고 있으므로 Tat 경로보다는 Sec 경로로 분비하는 것이 효율적인 단백질 접힘을 유도할 수 있으며, RBS 개량을 통해 발현량과 단백질 접힘을 더욱 향상시킬 수 있다는 것이 밝혀졌다. 이러한 고효율 전세포 촉매는 재활용성을 향상시키기 위해 값싼 고정체인 폴리우레탄 폼에 고정화되었으며, 이를 이용하여 저온환경에서 CO2 흡수 속도가 2배 증가됨을 보였다 (그림 5) [11]. 하지만 실제 습식 CO2 포집을 위한 매우 극한 환경 하에서 세포는 쉽게 파손되므로, 전세포 촉매는 CO2 광물화 및 전환, 활용 등 고부가가치 산물 합성에 응용되는 것이 더욱 적합할 것으로 보인다.
그림 5. 세포 간극 전세포 촉매의 재활용성 향상을 위한 폴리우레탄 폼 고정화. 본 그림은 참고문헌[11]에서 발췌함.
3. 결론
CA를 이용한 CO2 저감은 매우 유망한 기술로서, CO2 포집 및 활용 전분야에 활용될 가능성이 있다. 하지만 활성 및 안정성 이외에 CA 효소 간 특성 차이조차 아직까지 잘 밝혀지지 않은 실정이며 연구의 대부분이 α 클래스 효소에 국한되어 있다. CA 기술의 성공적인 활용을 위해 각 응용 분야별로 요구되는 환경 조건 및 효소 특성에 대한 명확한 정의를 기반으로 적절한 효소를 발굴하거나 개량하여 안정성을 극대화하고 동시에 경제적 효소 생산성을 향상시키는 노력이 필요할 것으로 보인다.
참고문헌
[1] B. H. Jo, J. H. Seo, H. J. Cha, Bacterial extremo-α-carbonic anhydrases from deep-sea hydrothermal vents as potential biocatalysts for CO2 sequestration, J. Mol. Catal. B: Enz. 109 (2014) 31-39.
[2] J. Jeyakanthan, S. Rangarajan, P. Mridula, S. P. Kanaujia, Y. Shiro, S. Kuramitsu, S. Yokoyama, K. Sekar, Observation of a calcium-binding site in the γ-class carbonic anhydrase from Pyrococcus horikoshii. Acta Crystallogr. D 64 (2008) 1012-1019.
[3] O. Alvizo, L. J. Nguyen, C. K. Savile, J. A. Bresson, S. L. Lakhapatri, E. O. P. Solis, R. J. Fox, J. M. Broering, M. R. Benoit, S. A. Zimmerman, S. J. Novick, J. Liang, J. J. Lalonde, Directed evolution of an ultrastable carbonic anhydrase for highly efficient carbon capture from flue gas, Proc. Natl. Acad. Sci. U. S. A. 111 (2014) 16436-16441.
[4] B. H. Jo, T. Y. Park, H. J. Park, Y. J. Yeon, Y. J. Yoo, H. J. Cha, Engineering de novo disulfide bond in bacterial α-type carbonic anhydrase for thermostable carbon sequestration, Sci. Rep. 6 (2016) 29322.
[5] B. H. Jo, S.-K. Im, H. J. Cha, Halotolerant carbonic anhydrase with unusual N-terminal extension from marine Hydrogenovibrio marinus as novel biocatalyst for carbon sequestration under high-salt environments, J. CO2 Util. 26 (2018) 415-424.
[6] A. C. Warden, M. Williams, T. S. Peat, S. A. Seabrook, J. Newman, G. Dojchinov, V. S. Haritos, Rational engineering of a mesohalophilic carbonic anhydrase to an extreme halotolerant biocatalyst, Nat. Commun. 6 (2015) 10278.
[7] L. H. Fan, N. Liu, M. R. Yu, S. T. Yang, H. L. Chen, Cell surface display of carbonic anhydrase on Escherichia coli using ice nucleation protein for CO2 sequestration, Biotech. Bioeng. 108 (2011) 2853-2864.
[8] R. Barbero, L. Carnelli, A. Simon, A. Kao, A. A. Monforte, M. Riccò, D. Bianchig, A. Belcher, Engineered yeast for enhanced CO2 mineralization, Energy Environ. Sci. 6 (2013) 660-674.
[9] B. H. Jo, I. G. Kim, J. H. Seo, D. G. Kang, H. J. Cha, Engineered Escherichia coli with periplasmic carbonic anhydrase as a biocatalyst for CO2 sequestration, Appl. Environ. Microbiol. 79 (2013) 6697-6705.
[10] B. H. Jo, H. Moon, H. J. Cha, Engineering the genetic components of a whole-cell catalyst for improved enzymatic CO2 capture and utilization, Biotech. Bioeng. 117 (2020) 39-48.
[11] H. Moon, S. Kim, B. H. Jo, H. J. Cha, Immobilization of genetically engineered whole-cell biocatalysts with periplasmic carbonic anhydrase in polyurethane foam for enzymatic CO2 capture and utilization, J. CO2 Util. 39 (2020) 101172.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update