| 그래핀 기반 하이브리드 물질을 이용한 세포 미세 환경 조절 연구 | |
|---|---|
| Date 2020-10-21 02:15:09 |
|

박사과정 / 교수
중앙대학교 융합공학부(과)
cheolhwi13@gmail.com / thkim0512@cau.ac.kr
1. 서론
세포 미세 환경이란 넓은 의미에서 세포가 생장할 수 있는 공간과 그 공간의 화학적, 물질적 상태를 의미한다. 자세히는 extracellular matrix (ECM)로 불리는 세포외 기질을 포함하여, 세포의 생장에 영향을 미칠 수 있는 다양한 종류의 단백질 및 구조체에 대한 총칭이다 [1]. 이러한 세포 미세 환경은 세포와의 공간적 상호작용을 통하여 세포의 성장과 기능에 관여하는데, 이 상호작용은 궁극적으로 인체 조직이나 기관을 형성하고 그 기능을 통제하는 데 있어서도 필수적인 것으로 알려져 있다. 따라서 최근에는 이러한 미세 환경을 제어하여 세포의 성장, 분화, 이동, 사멸 등 다양한 세포의 핵심 기능을 조절하고, 이를 궁극적으로 체내 조직 재생/형성과 체외 조직/장기 모사 등 광범위한 재생의학 및 약물 스크리닝 분야에 활용하는 연구가 진행되고 있다 [2]. 이제까지 보고된 연구에 따르면, 재생의학 분야의 경우 세포의 미세 환경 제어를 통하여 줄기세포의 분화능, 분화 방향성을 조절하고 이를 이용하여 손상된 장기 및 조직의 재생을 촉진할 수 있는 기술을 개발할 수 있음을 시사하고 있다 [3]. 이와 함께, 약물 스크리닝을 포함한 암 연구 분야에서는 미세 환경 제어를 통한 체내 종양의 체외 모사 연구가 각광 받고 있다. 구체적으로, 체내 종양은 다양한 종류의 세포 (암세포, 일반세포, 혈관세포, 면역세포 등)가 3차원적으로 복합 구조를 형성하고 있는데, 이를 체외에서 3차원적으로 모사하는 기술이다. 세포 미세 환경 조절을 통하여 기존의 단순한 2차원 세포 배양 방식에서 벗어나 다세포 3차원 배양을 가능케 하는 기술이 그 예이다 [4,5].
세포 미세 환경 조절에서 가장 중요한 요소인 세포외 기질은, 세포의 구조적 지지와 세포 간의 연결, 신호전달 등 세포 간 상호작용의 매개가 되는 프로테오글리칸(proteoglycans)과 섬유형 단백질 (콜라겐, 피브로넥틴, 키토산 등)의 복합체를 총칭한다. 따라서 세포 미세 환경 조절은 그간 이러한 세포외 기질을 구성하는 섬유형 단백질 또는 그 단량체 (펩타이드, 고분 자 등)의 다변화, 농도 최적화 및 방향성의 조절 등을 통한 연구가 대부분이었지만, 최근에는 세포외 기질을 단백질 기반 물질이 아닌 탄소 기반 복합체, 금속 물질 및 합성 고분자 등 다양한 형태의 나노물질 및 패턴으로 대체하고자 하는 연구가 대두되고 있다 [6].
가장 주목받고 있는 대체 물질 중 하나인 그래핀은 독특한 물리 /화학적 특징을 보유하는 2차원 나노물질이다. 일반적으로 그래핀은 높은 물리 /화학적 내성과 높은 전기 전도성, 높은 열 전도성과 열 내성을 가진 물질로 알려져 있다. 특히, 그래핀에 기반하여 흑연에서 제작이 가능한 산화 그래핀의 경우 낮은 생산 단가 및 생산의 편의성뿐만 아니라 높은 생체 친화성 및 양친매적 특성 등 우수한 물질적 특성에 기인하여 생체의학 분야에 있어 매우 활발히 활용되고 있다. 물 질적 특성의 경우, 산화 그래핀은 표면에 히드록시기 (hydroxyl group) 등 다양한 친수성 작용기를 보유하여 그 자체로 친수성을 띠며, 동시에 그래핀 기반 물질들이 공통적으로 보유한 소수 성질을 포함하는 양친매성 물질이다. 이러한 독특한 특성은 세포 미세 환경 조절에 있어서, 산화 그래핀이 세포막을 구성하는 인지질 이중층 및 세포 표면 단백질과 상호 작용하고, 결국 체외에서 세포의 부착 및 안정적인 성장을 유도할 수 있는 것으로 알려져 있다. 이와 함께 산화 그 래핀의 높은 생체친화성은 체외 세포외 기질 조절의 핵심 물질로써 사용이 가능할 뿐만 아니라 체내에서도 조직 /장기 의 기능 조절 및 치료에도 해당 물질의 가능성을 찾기 위한 연구가 활발히 진행 중이다 [7,8]. 이러한 그래핀 기반 물질 의 우수한 특성 및 생체재료로써의 가능성에 기반하여, 본 기고문에서는 국내외 세포 미세 환경 조절과 관련한 연구 중 그래핀 기반 물질이 활용된 사례를 소개함으로써 줄기세포 분화 및 암세포를 포함한 3차원 세포배양법에 관한 최신 연구 동향을 살펴보고자 한다.
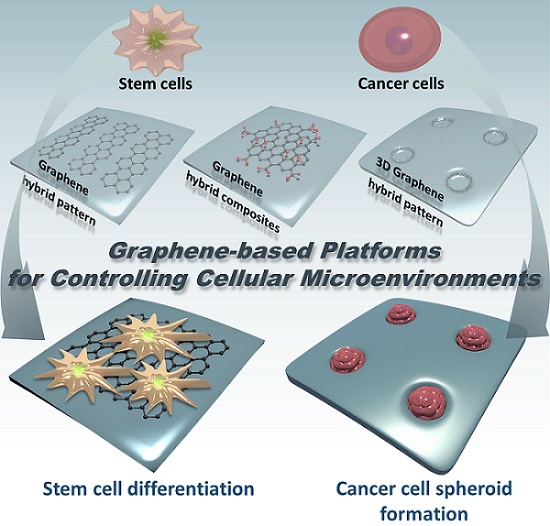
그림 1. 그래핀 하이브리드 복합 물질을 이용한 줄기세포 및 암세포 미세 환경 조절.
2. 본론
2-1. 그래핀 하이브리드 복합 물질을 이용한 세포 미세 환경 조절
줄기세포 분화 유도 연구는 세포 미세 환경 조절을 이용한 주류 연구 중 하나이다. 특히, 그래핀 하이브리드 복합 물 질을 이용한 연구는 2010년 이후 오늘날에 이르기까지 매우 활발히 진행 중이다. 그래핀 하이브리드 복합 물질은 세포 독성이 낮고 줄기세포 부착을 효과적으로 유도할 수 있는 조건을 갖춘 물질이다. 때문에 그래핀 하이브리드 복합 물질을 이용한 줄기세포 분화 유도 연구는 세포의 부착 유도를 통해 세포로 하여금 특정 배양 형태를 가지도록 유도하는 방향으로 진행되어 왔다.
2010년 관련 연구 초기, 산화 그래핀을 이용한 인간 중간엽줄기세포 분화 연구가 보고되었다 (그림 2a-d) [9]. 연구진들은 친생체성 고분자 물질인 PLA (Poly Lactic Acid) 나노섬유 스캐폴드에 산화 그래핀을 코팅한 형태의 플랫폼을 인간 중간엽줄기세포 분화에 이용하였다. 그들은 산화 그래핀이 코팅된 나노섬유 스캐폴드가 가지는 복잡한 구조를 따라 중간엽줄기세포가 부착되어 생장하는 것을 확인하였으며, 이 세포 부착 유도가 세포 분화를 야기할 수 있음을 입증하였다. 본 연구를 시발점으로 다양한 형태의 “그래핀이 코팅된 고분자 스캐폴드 ”를 이용한 줄기세포 분화 연구가 활발히 진행되었다.
그림 2. PCL 나노 섬유 스캐폴드 (a) 및 산화 그래핀이 코팅된 PCL 나노 섬유 스캐폴드 (b)의 주사전자현미경 이미지. PCL 나노 섬유 스캐폴드 (c) 및 산화 그래핀이 코팅된 PCL 나노 섬유 스캐폴드 (d) 상 인간 중간엽줄기세포 분화 확인을 위한 주사전자현미경 이미지. (e) 주름진 그래핀 구조 상 쥐 근원세포 배양 및 분화 과정 모식도. 본 이미지는 참고문헌 [9,10]에서 발췌한 것임.
최근에 들어서는 스캐폴드를 이용하지 않고 오직 그래핀만을 이용한 줄기세포 분화 플랫폼이 보고되었다 (그림 2e) [10]. 2019년 한국 연구진은 탄성을 가진 고분자 구조체 위에 그래핀을 코팅한 후 구조를 수축시키면 코팅된 그래핀이 주름진 구조를 형성하는 것을 확인하였으며, 주름진 그래핀 구조 위에 쥐 근원세포를 배양하여 이들이 골격근 조직을 형성할 수 있음을 보고하였다. 그래핀은 산화 그래핀과 달리 친수성 작용기를 보유하지 않기 때문에 소수성이 강하다. 따라서 주름진 구조 위에 배양된 세포는 그래핀 주름의 골 부분에 모여 생장하며, 골을 따라 길쭉한 모양의 배양 형태를 가지게 된다. 본 연구는 그래핀 기반 물질을 세포 부착 유도체로 사용하지 않고 그 반대로 사용하여 세포의 특정 배양 형태를 유도했다는 점에서 주목할 만하다. 이전의 연구에서는 산화 그래핀과 같은 친수기를 보유한 그래핀 기반 물질을 사용하여 특정 구조체를 따른 세포 부착을 유도하였으나, 주름진 그래핀은 세포 부착을 저해하여 세포의 배양 형태를 특정하였다. 이는 세포 미세 환경 조절에 대한 그래핀 기반 물질의 이용 범위를 확장했다고 볼 수 있을 것이다.
2-2. 그래핀 하이브리드 패턴을 이용한 세포 미세 환경 조절
그래핀 패턴은 무작위적인 배열이나 그래핀 자체의 전기/화학적 특성에서 기대할 수 있는 세포 미세 환경 조절을 넘어, 보다 의도적이며 정교한 물리적 영향을 미칠 수 있다. 패턴을 이용한 연구의 가장 큰 장점은 그래핀의 특정 배열을 연구자가 원하는 형태로 구성하여 세포 배양 유형을 특정 방향으로 유도할 수 있다는 점이다. 최근 보고된 연구 중에서는 환원된 산화 그래핀 (reduced graphene oxide) 패턴을 이용한 세포 분화 유도가 보고된 바 있다 (그림 3) [11]. 환원된 산화 그래핀은 산화 그래핀과 같이 표면에 친수성 작용기를 보유한다. 다만, 이들은 수용액 상태에서 발생하는 뭉침 현상의 유무에서 확연한 차이를 보인다. 산화 그래핀과 달리 환원된 산화 그래핀은 수용액 상에서 강한 뭉침 현상을 보이기 때문에 특정 구조체에 쉽게 코팅되지 않는다. 때문에 환원된 산화 그래핀은 스캐폴드나 평평한 구조체에 코팅하는 방식으로는 세포 미세 환경 조절에 사용되기 힘든 것이 사실이다. 하지만 2019년 한 연구진에 의해 “coffee-ring 효과” 를 이용한 환원된 산화 그래핀 패턴이 보고되었다. Coffee-ring 효과란, 미세 입자를 포함한 액적이 증발할 때 입자는 가장자리에 쌓이는 효과를 일컫는다. 이 효과를 이용하면, 환원된 산화 그래핀 수용액을 증발시켜 원형의 환원된 산화 그래핀 형태를 형성하는 것이 가능하다. 또한, 액적의 높이를 일정하게 고정시킨 상태에서 증발 속도를 조절하면 이를 패턴화할 수 있는 것이다. 해당 연구진은 증발 속도를 조절하여 일정한 간격을 둔 환원된 산화 그래핀 패턴을 구성한 뒤, 그 위에 쥐 근원세포를 배양하여 세포 분화를 확인하였다. 환원된 산화 그래핀 패턴을 따라 배양된 세포는 길쭉한 형태를 가지게 되며, 종국에는 골격근 조직 분화가 유도되었다.
그림 3. 환원된 산화 그래핀 coffee ring 패턴 상 쥐 근원세포 배양 및 분화 확인을 위한 광학/형광 이미지. 본 이미 지는 참고문헌 [11]에서 발췌한 것임.
그래핀 기반 물질을 이용한 패턴은 다양한 방식과 형태로 제작될 수 있음이 보고되고 있다. 물론 패턴의 크기 또한 패터닝 방식에 따라 다양한데, 2018 년 발표된 연구 중에는 나노 크기의 그래핀 -금 복합체 배열을 이용하여 줄기세포 분화를 유도했다는 보고가 있다 [12]. 관련 연구진은 laser interference lithography (LIL) 기술을 사용하여 나노 크기의 금 배열을 형성한 후 이 위에 그래핀을 진공 증착하여 그래 핀-금 복합체 배열 패턴을 완성하였다. 이 나노 크기의 작은 패턴은 인간 신경줄기세포 분화에 효과를 보였다.
그래핀 기반 물질을 이용한 패턴은 그래핀 기반 물질의 종류에 따라 다양한 방식으로 구성될 수 있다. 특히, 적용되는 패터닝 방식에 따라 패턴의 구조와 크기는 매우 다양해진다. 기존에 보고된 그래핀 기반 물질 패터닝을 토대로 한 새로운 방식의 응용 패터닝이 보고되고 있으며, 이 연쇄는 점차 가속될 것으로 사료된다. 이는 패턴의 종류에 따른 세포 미세 환경 조절 연구에 대한 무진한 응용 가능성을 시사한다.
2-3. 그래핀 하이브리드 복합체를 이용한 3차원 암세포 미세 환경 조절
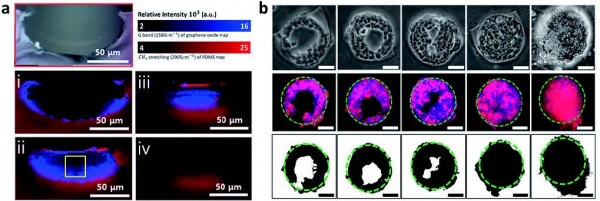
세포 미세 환경 조절은 비단 줄기 세포 분화에만 국한된 것은 아니다. 세포 미세 환경 조절은 암세포에도 적용될 수 있는데, 최근 연구 동향은 세포 미세 환경 조절을 통해 암세포를 3차원으로 배양하는 방법에 대한 연구 쪽으로 방향을 잡은 듯하다. 앞서 언급되었듯이, 그래핀 기반 물질에는 산화 그래핀과 같이 세포의 부착을 유도하는 작용기가 포함된다. 이들 작용기는 그들의 구조나 전기/화학적 특성, 패턴과 같은 의도적인 구조에 의해 세포의 배양 형태를 특정 모양 으로 제한할 수 있다. 2020년 한 연구진은 독특한 패터닝 방식을 통해 암세포의 배양 형태를 3차원으로 구현할 수 있는 플랫폼을 보고하였다 (그림 4) [13]. 이들은 산화 그래핀을 소수성 고분자 물질로 구성된 마이크로 크기의 원통형 구조의 벽면에 코팅하는 “수직 코팅 방식 ”을 보고하였으며, 본 방식을 사용해 제작한 플랫폼 위에 인간 간암세포를 배양하였다. 원통형 구조 벽면에 코팅된 산화 그래핀은 인간 간암세포의 부착을 유도하였으며 배양 시간이 지남에 따라 세포가 구조 내부를 채워, 종국에는 3차원 암세포 스페로이드가 형성됨이 보고되었다.
현재까지 보고된 그래핀 기반 물질을 이용한 세포 미세 환경 조절 연구 중, 암세포에 관한 연구 수는 비교적 적은 편이다. 일반적인 암세포의 경우 그래핀 기반 물질의 전기/화학적 특성, 패턴과 같은 구조를 사용해 만든 2차원 배양 형태는 줄기 세포에 비해 연구 가치가 현저히 떨어지는 탓이다. 하지만 최근 연구들을 토대로, 그래핀 기반 물질을 3차원 세포 배양에 응용될 수 있음이 확인되었다. 오늘날 암 관련 연구에서 3차원 체내 종양 모사는 중요한 분야로 각광받고 있으며 관련 연구가 활발히 진행 중이다. 더불어 그래핀 기반 물질과 고분자 등을 이용한 그래핀 복합체들은 제작이용이 하며 경제적인 우수성이 있어, 그래핀 기반 물질을 이용한 세포 미세 환경 조절 연구가 암 관련 생체의학 분야에 적극적으로 활용될 수 있을 것으로 예상된다.
그림 4. (a) 산화 그래핀 수직 코팅 플랫폼 단면에 대한 라만 분광법 촬영 이미지. (b) 산화 그래핀 수직 코팅 플랫폼 상 인간 간암세포 3차원 배양 과정 확인을 위한 광학/형광/이진화 이미지. 본 이미지는 참고문헌 [13]에서 발췌한 것임.
3. 결론
세포 미세 환경 조절 연구에 있어 그래핀 기반 물질은 우수한 물리/화학적 특성과 경제성, 세포 부착 조절에 대한 용이성으로 인해 관련 연구에 활발히 응용되고 있는 물질 중 하나이다. 그래핀 기반 물질이 가지는 세포 부착 조절 기능은 세포의 부착을 유도하거나 저해하여 세포의 배양 형태를 의도적으로 조절할 수 있음이 입증되었다. 이는 그래핀 기반 물질이 세포외 기질과 같은 세포 미세 환경의 일부를 기능적으로 모사할 수 있음을 시사한다. 실제로 앞선 소개를 통해 그래핀 기반 물질 및 고분자 그래핀 복합체 등은 줄기세포의 분화를 유도하거나 3차원 세포 배양을 가능케 할 수 있음을 확인하였다. 종합하면 그래핀 기반 물질을 이용한 세포 미세 환경 제어 연구는 줄기세포 기반 재생 의학과 암 연구에 매우 유망하다고 결론 내릴 수 있으며, 더욱 다양한 분야로 응용이 가능할 것으로 기대한다.
참고문헌
1. Midgley, A. C.; Wei, Y.; Li, Z.; Kong, D.; Zhao, Q., Nitric-Oxide-Releasing Biomaterial Regulation of the Stem Cell Microenvironment in Regenerative Medicine. Advanced Materials 2020, 32 (3), 1805818.
2. Barthes, J.; Ozcelik, H.; Hindie, M.; Ndreu-Halili, A.; Hasan, A.; Vrana, N. E., Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: the recent advances. BioMed research international 2014, 2014.
3. Daley, W. P.; Peters, S. B.; Larsen, M., Extracellular matrix dynamics in development and regenerative medicine. Journal of cell science 2008, 121 (3), 255-264.
4. Huh, D.; Hamilton, G. A.; Ingber, D. E., From 3D cell culture to organs-on-chips. Trends in cell biology 2011, 21 (12), 745-754.
5. Duval, K.; Grover, H.; Han, L.-H.; Mou, Y.; Pegoraro, A. F.; Fredberg, J.; Chen, Z., Modeling physiological events in 2D vs. 3D cell culture. Physiology 2017, 32 (4), 266-277.
6. Reing, J. E.; Zhang, L.; Myers-Irvin, J.; Cordero, K. E.; Freytes, D. O.; Heber-Katz, E.; Bedelbaeva, K.; McIntosh, D.; Dewilde, A.; Braunhut, S. J., Degradation products of extracellular matrix affect cell migration and proliferation. Tissue Engineering Part A 2009, 15 (3), 605-614.
7. Neto, A. C.; Guinea, F.; Peres, N. M.; Novoselov, K. S.; Geim, A. K., The electronic properties of graphene. Reviews of modern physics 2009, 81 (1), 109.
8. Balandin, A. A., Thermal properties of graphene and nanostructured carbon materials. Nature materials 2011, 10 (8), 569-581.
9. Shah, S.; Yin, P. T.; Uehara, T. M.; Chueng, S. T. D.; Yang, L.; Lee, K. B., Guiding stem cell differentiation into oligodendrocytes using graphene-nanofiber hybrid scaffolds. Advanced materials 2014, 26 (22), 3673-3680.
10. Kim, J.; Leem, J.; Kim, H. N.; Kang, P.; Choi, J.; Haque, M. F.; Kang, D.; Nam, S., Uniaxially crumpled graphene as a platform for guided myotube formation. Microsystems & nanoengineering 2019, 5 (1), 1-10.
11. Kang, S. H.; Shin, Y. C.; Hwang, E. Y.; Lee, J. H.; Kim, C.-S.; Lin, Z.; Hur, S. H.; Han, D.-W.; Hong, S. W., Engineered "coffeerings"of reduced graphene oxide as ultrathin contact guidance to enable patterning of living cells. Materials Horizons 2019, 6 (5), 1066-1079.
12. Lee, J. H.; Choi, H. K.; Yang, L.; Chueng, S. T. D.; Choi, J. W.; Lee, K. B., Nondestructive Real-Time Monitoring of Enhanced Stem Cell Differentiation Using a Graphene-Au Hybrid Nanoelectrode Array. Advanced Materials 2018, 30 (39), 1802762.
13. Kim, C. H.; Suhito, I. R.; Angeline, N.; Han, Y.; Son, H.; Luo, Z.; Kim, T. H., Vertically Coated Graphene Oxide Micro-Well Arrays for Highly Efficient Cancer Spheroid Formation and Drug Screening. Advanced Healthcare Materials 2020, 1901751.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update