| 핵산나노공학기술을 이용한 바이러스 검출용 인플루엔자 바이오센서 연구 동향 | |
|---|---|
| Date 2020-10-21 02:53:00 |
|

교수 / 석사과정 / 연구원
광운대학교 화학공학과
taeklee7@naver.com / wls629@icloud.com / 1497rg@hanmail.net
1. 서론
고대부터 바이러스는 인류의 역사에서 여러 번 영향을 주었지만, 바이러스가 별개의 생물체로 존재한다는 사실은 지금으로부터 약 100년 전이다. 2020년 현재, 거의 모든 국가는 코로나 바이러스-19 (Corona Virus Disase-19: COVID-19 의 등장으로 바이러스의 높은 감염성과 치사율, 빠른 변형체로 인해서 사회, 경제, 의료, 방역 시스템의 붕괴를 실감하고 있는 위기에 처해있으며, 다시 한 번 신종 바이러스의 위력에 경악하고 있다 [1].
인류가 존재하기 전부터 바이러스는 유기생명체와 함께 상호작용을 하면서, 끊임없는 진화를 반복해왔다. 크기가 작고 구조가 단순한 원핵세포기반의 박테리아, 고세균, 원생생물에서부터 구역별 영역이 복잡한 기관과 큰 진핵세포의 집합으로 이루어진 미생물, 식물, 곤충 및 고등 동물들도, 바이러스의 침입에 대응하기 위하여, 지속적으로 내부 면역체계의 진화, 소화계 및 방어 시스템의 발달 등과 같은 방법으로 진화해 왔다. 이와는 반대로, 바이러스는 이러한 생명체에 생명체의 방어 시스템을 뚫고 체내로 침투하기 위하여, 더 강한 전염성과 돌연변이, 생존 능력과 감염 방식을 더욱더 복잡하고 까다롭게 진화해 나가며, 다양한 변종을 만들어 왔다 [2].
인플루엔자 바이러스는 세계에서 가장 유명한 바이러스 중 하나로, 흔히들 독감의 원인이 되는 바이러스로 매해 변종이 전 세계적으로 유행하고 있으며, 기침, 고열, 두통 및 오한, 설사 등과 같은 질환을 일으키며, 심할 경우, 숙주에게 죽음을 일으킬 정도로 치명적이다. WHO에서는 매년 인플루엔자 바이러스의 유전자 변형 형태와 감염력, 유행성 등을 예측하고 리포트할 정도로 사회적인 파급력이 높다. 특히, 최근에는 COVID-19와 유사한 증상 때문에, 많은 사람들에게 과도한 공포감을 줄 수 있다. 거의 매해 인플루엔자 바이러스는 다양한 변종으로 사람뿐만 아니라, 가금류, 돼지, 박쥐 등 에게 인수감염과 수인감염을 일으킬 정도로, 파급력과 사회, 경제, 보건적인 피해가 크다 [3].
유전학적으로, 인플루엔자 바이러스는 단일가닥 RNA 바이러스이고,Hemagglutinin (HA), Nucleoprotein, Neuraminidase (NA), Membrane 단백질, non-structural 단백질, 효소 등이 코딩된 유전자를 지니고 있다. 4가지 타입 (인플루엔자 A, 인플루엔자 B, 인플루엔자 C, 인플루엔자 D) 으로 구분될 수 있고, 감염성이 높은 HPI (High Pathogenic Influenza)와 감염성이 낮은 LPI (Low Pathogenic Influenza)로 구분되기도 한다. 특히, 16 종류의 HA 단백질 (H1-H16) 과 9종류의 NA (NA1-NA9) 단백질의 형태 및 조합에 따라서 다양한 숙주를 매개로 바이러스를 전파한다 [4].
비교적 바이러스에 대한 근대적 연구가 진행될 수 있었던 1918년 스페인 독감 (100만 명 피해자 추청 )을 시작으로, 1968년 홍콩 독감 (50만 명 추정), 2009 년 돼지독감 (40만 명 추정) 등으로 막대한 인명 피해와 사회적 파장을 일으키는 바이러스 아종, 변종에 대한 진단은 유전자 기법과 면역학적 기법으로 인플루엔자 바이러스를 검출해 왔다. 전통적인 ELISA 기법과 더불어 PCR을 매개로 하는 기법은 바이러스 진단에 기준이 되어 왔다. 그러나, 복잡한 검출 공정과 고가 의 장비, 긴 시간 등을 극복하기 위하여, 대두되고 있는 전기화학과 분광학적 기법은 현장에서 인플루엔자 바이러스를 검출하는 데 효과적인 툴을 제공하고 있다 [5,6]. 특히 나노바이오공학 기술이 발달함으로 인해, 바이러스를 검출하는 프로브의 직접적인 변형과 적용, 나노구조체를 이용한 민감도의 상승 등은 전기화학 기법과 표면플라즈몬 분광 (Surface Plasmon Resonance Spectroscopy) 기반 바이오센서 제작에 검출 공정과 민감도를 향상 시킬 수 있어, 휴대용 현장형 인플루엔자 바이러스 검출 센서 제작에 널리 적용될 수 있다.
본 기고문에서는 이러한 인플루엔자 바이러스를 검출할 수 있는 나노바이오공학 기술 기반의 전기화학 바이오센서와 표면플라즈몬 분광 기반 바이오센서에 적용하는 연구동향에 대해 살펴보고자 한다.
2. 전기화학 바이오센서
현장에서 바이러스를 검출하기 위해서는 신속하고 정확하며, 저렴한 비용으로 대량생산이 가능하여야 한다 [7]. 전기 화학적 검출 방법은 위의 조건을 만족하며, 누구나 쉽게 사용이 가능하고 탐침과 분석물이 반응할 때 발생하는 아날로그 신호를 데이터 처리가 쉬운 전기적 신호로 변환하기에 바이오센서 분야로서 큰 잠재력을 가지고 있다. 전기화학적 검출 방법을 이용한 현장형 바이오센서 중에서 가장 빈번하게 사용되는 순환 전압 전류법 (Cyclic Voltammetry; CV) 과 전기화학 임피던스 분광법 (Electrochemical Impedance Spectroscopy; EIS)을 이용한 바이오센서를 살펴보고 관련 연구를 소개할 것이다.
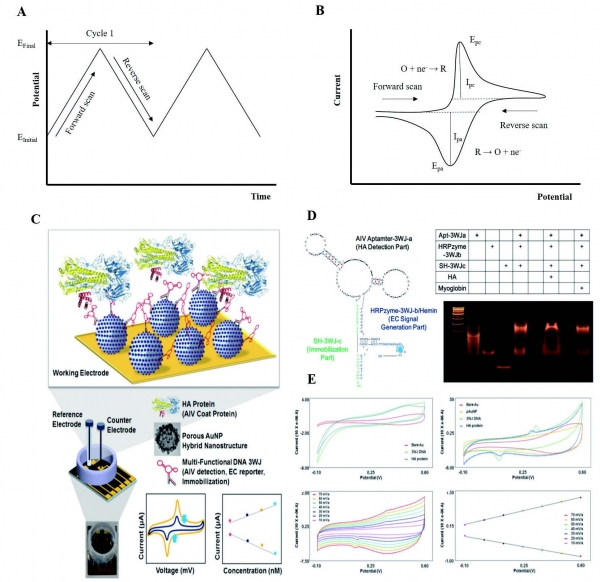
순환 전압 전류법은 그림 1.(A)와 같이 작업전극의 전위를 한 방향으로 주사 (scan)하다가 특정 지점에서 주사 방향을 반대로 하는 것으로 이 때 발생하는 전류의 변화를 기록 (그림 1. (B)) 하는 방법이다. 순환 전압 전류법은 전압의 주사 속도, 온도, 산화-환원종의 농도 등 다양한 조건에 따라 산화 -환원 전류의 세기가 변화한다 [8]. 바이오센서로 응용될 때, 분석물과 탐침이 반응하여 변화하는 산화 -환원 전류의 세기를 측정하는 방법이 많이 이용된다. Lee의 그룹이 최근 보고 한 연구는 이러한 순환 전압 전류법을 이용하여 인플루엔자를 효과적으로 검출한 대표적 연구이다 [9]. 그림 1. (C)는 이 연구의 개략적 이미지를 보여준다. 전기 화학적 신호를 생성하는 DNAzyme 서열, H5N1의 HA 단백질과 선택적으 로 결합하는 압타머 서열, 기판에 고정 될 수 있도록 -SH기 (Thiol group)를 포함하는 서열이 DNA 3 중 가닥 (DNA-3WJ)을 형성하여 탐침으로 사용되었다. 전기화학적 신호를 증폭시키기 위하여 직경 60-110 nm 의 다공성 금 나노입자 (pAuNP)를 사용하였다. 그림 1.(D)는 DNA-3WJ의 모식도와 DNA-3WJ이 올바르게 형성되었는지 확인하기 위해 수행된 TBM-PAGE의 결과를 보여준다. 센서의 제작법은 제조된 전극에 Cysteamine, pAuNP, DNA-3WJ 를 도포하여 자기 조립법으로 고정한 후, 1mM 헤민(Hemin)을 처리하였다. 헤민 분자는 DNAzyme 서열의 단일 구아닌 서열이 G-quadruplex DNA 구조를 형성하게 하여 peroxidase와 유사한 기능을 수행하게 한다. 제조 공정은 원자력 현미경 (AFM)과 순환전압전류법을 이용하여 확인하였으며, pAuNP 가 고정된 전극은 그렇지 않은 전극보다 전기 활성이 높은 것으로 확인되었다. 센서는 순환전압전류법을 수행하여 탐침과 HA 단백질이 결합할 때, 산화-환원 전류가 감소하는 것을 이용하였다. HA 단백질의 농도 1 pM ~ 100 nM 범위에서 산화 -환원 전류의 세기와 HA 단백질의 농도가 선형적관계가 있음을 확인하였다. 검출 한계는 닭 혈청에서 HA 단백질 농도 1pM로 결정되었다 (그림 1. (E)).
그림 1. 순환 전압 전류법의 전압 주사 (A) 및 이에 따른 CV 곡선 (B). (C) 조류 독감 바이러스 (Avian Influenza Virus; AIV) 검출용 다공성 금나노입자가 도입된 바이오센서의 개략도 (D) DNA-3중 가닥의 모식도와 TBM-PAGE 결과. (E) 센서의 제작과정을 확인하기 위한 CV곡선과 AIV 농도별 CV곡선.
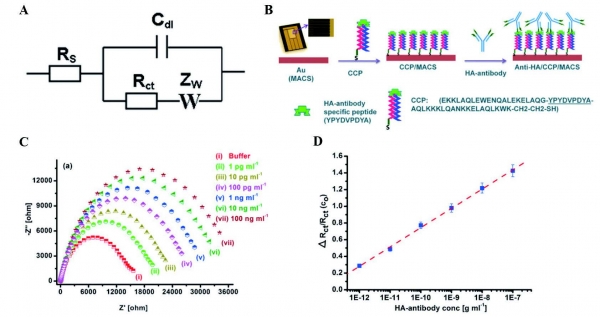
전기화학 임피던스 분광법은 주파수가 다른 교류신호를 셀에 인가하여 임피던스를 계측하는 방법으로, 본 기고문에서는 랜들 회로(Randles circuit; 그림 2.(A))를 등가회로로 하여 전하전달저항 (Charge trnsfer resistance; Rct)의 변화를 통해 바이러스를 검출하는 방법에 대하여 살펴볼 것이다. Sunil K. Arya 그룹은 Coiled-coil peptide (CCP)로 변형된 미세 전극 배열을 이용하여 인플루엔자 HA 단백질의 항체를 검출하는 연구를 진행하였다 [10]. CCP는 HA 단백질 항체에 기질로 작용하는 펩타이드와 -SH기로 구성되었으며. CCP와 HA 항체가 결합하기 전후 EIS를 측정하였다 (그림 2. (B)). EIS 측정 결과를 그림 2. (C)와 같이 각 주파수에서 임피던스를 복소평면 위에 도식하는 나이키스트 플롯 (Nyquist plot)을 이용하면 손쉽게 Rct 을 구할 수 있다. 나이키스 플롯의 수평축은 저항을, 수직축은 리액턴스를 나타내므로 반원과 수평축과의 두 교점이 전해질 내의 저항 (Rs)과 Rct를 나타낸다. 다시 그림 2. (C)를 살펴보면, 각기 다른 농도의 HA 항체와 CCP간의 상호 작용에 의해 임피던스가 변화함을 볼 수 있다. HA 항체의 각 농도에서의 Rct를 그림 2.(D)에 보여주었다. HA-항체의 농도가 증가할수록 Rct 이 분명하게 증가하는 것을 볼 수 있다. Rct 와 HA 항체 농도의 선형 관계는 1 pg/mL ~ 100 ng/mL 범위를 가지며, 다른 단백질과는 반응하지 않는 높은 선택성을 보여 표적의 민감한 검출을 위한 방법을 제시하였다.
그림 2 (A) 랜들 회로의 회로도. (B) HA-항체 검출을 위한 EIS 바이오센서의 개략도. (C) CCP 농도에 따른 임피던스 변화를 나타낸 나이키스트 플롯. (D) 전하 전달 저항의 변화를 이용해 작성한 검량곡선
3. SPR (Surface Plasmon Resonance) 기반 바이오센서
광학 바이오 센서는 빛의 흡수, 반사 및 방출과 같은 광학적 특성의 변화를 특정하는 방식이다. 특히 나노 입자의 광학적 특성으로 인해 신호 증폭의 기반이 되었다. 광학 바이오 검출 방식은 주로 형광과 비색계 라만 분광법, 표면 플라즈몬 공명 방법으로 나눌 수 있다.
그중 국소 표면 플라즈몬 공명 (Localized Surface Plasmon Resonance: LSPR) 현상은 전도성 물질의 표면에서 빛 에너지를 흡수할 때, 분극이 발생하고 분극에 의해 전기장의 강도를 증대함에 따라 형성된 전자들이 집단을 이루게 된다. 이 중 국소 표면을 갖는 금속 나노 입자 표면에 국소적으로 진동이 발생하는 현상을 국소 표면 플라즈몬 공명 방법이라 한다 [11]. LSPR 현상을 발생시키고 센싱의 민감도를 높이기 위해 다양한 나노입자를 사용하는데, 일반적으로 가장 널리 사용되는 입자는 금과 은, 알루미늄이 있으며 대체로 생체 적합성과 안정성이 높은 금이 사용된다. 이러한 나노입자의 표면 위에 올라간 바이오 프로브와 바이러스 간의 결합 유무가 파장의 세기와 길이 변화로 나타나며 이러한 차이를 이용하여 LSPR을 확인할 수 있다. LSPR 기반의 바이오센서는 구조의 단순성, 쉬운 작동성과 휴대성을 기반으로 현장형 인플루엔자 바이러스 검출용 바이오센서에 적용될 수 있다 [12].
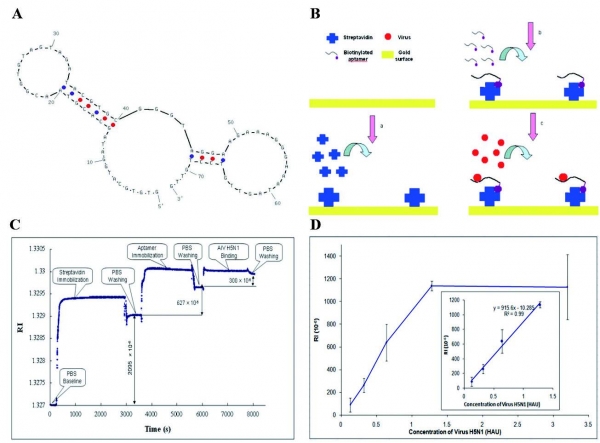
가금류 면봉 샘플에서 AIV H5N1 의 검출을 하기 위해, 휴대용 SPR (Surface Plasmon Resonance) 바이오 센서 기반의 DNA Aptamer 를 사용하는 센서가 있다. SPR 바이오 센서는 streptavidin-biotin을 통해 streptavidin으로 코팅된 센서 금 표면에 DNA Aptamer 를 Biotinylation화하여 제작되었다. 바이오 프로브로 쓰인 DNA Aptamer 는 샘플 용액에서 AIV H5N1을 검출함에 따라 굴절률 (RI)이 증가했으며, RI 값이 0.128 ~ 1.28 HAU 범위의 AIV 농도에 선형적으로 변했다 (R2 = 0.99). 또한 이 샘플 농도 범위 내에서, 가금류 면봉 샘플의 AIV H5N1 은 1.5 시간 이내에 검출할 수 있었다 [13].
그림 3 (A) DNA Aptamer 이차 구조 (B) AIV H5N1 검출을위한 SPR 바이오 센서의 원리 (C) 표면 개질 및 AIV H5N1 검출에 대한 SPR 압타 센서의 전형적인 반응 곡선 (D) AIV H5N1 검출을위한 보정 곡선.
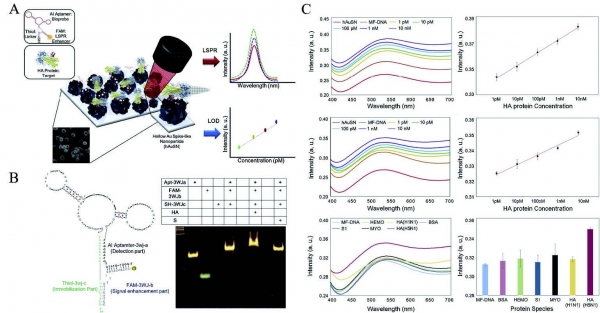
이어서 국소 표면 플라즈몬 공명 (LPSR) 방법을 사용하여 hollow Au Nano Spike (hAuNS) 에 다기능 DNA 나노 구조 (MF-DNA)로 구성된 비표지 조류 인플루엔자 (AIV H5N1) 감지 바이오 센서가 제안되었다 (그림 4A). H5N1을 검출하기 위해 단일 가닥 DNA를 프로브로 사용하는 대신 DNA 3WJ 구조를 제작했다. 제작된 DNA 3WJ 은 각 가닥의 기능화를 통해 3가지 기능을 수행할 수 있는데, H5N1 을 인식할 수 있는 DNA Aptamer, 신호 증폭을 위한 FAM 염료, 추가적인 연결 과정없이 바이오 프로브 고정을 가능하게 하는 Thiol로 표지되었다 (그림 4B). 또한 hollow Au Nano Spike 모양의 나노 입자를 사용하여 LSPR 효과를 생성했으며, 제작된 LSPR 기반 바이오 센서는 PBS 용액과 닭 혈청에서 HA 단백질을 1pM까지 검출할 수 있었다 (그림 4C) [14]. 이러한 바이오센서를 통해 LSPR 기반 바이오 센서가 짧은 시간 안에 검출이 가능하며, 민감도가 높은 센서라는 것이 증명되었다. 이 후, 생물학적 측면에서 분자 단위의 측정도 가능할 것이라 예상된다.
그림 4. (A) LSPR 방식을 기반으로 한 바이오 센서의 개략도. (B) DNA 3 WJ의 개략도 및 DNA 3 WJ, HA 단백질, 스파이크 단백질의 TBM PAGE Gel 결과. (C) PBS buffer 및 닭 혈청에서 HA 단백질의 검출 및 선택성 테스트.
4. 결론
2. B. Panigrahy, D. A. Senne, J. C. Pedersen, A. L. Shafer, J. E. Pearson, usceptibility of pigeons to avian influenza, Avian diseases (1996) 600-604.
3. T.M. Uyeki, Human infection with highly pathogenic avian influenza a (H5N1) virus: review of clinical issues, Clin. Infect. Dis. 49 (2009) 279.290.
4. D. Nidzworski, P. Pranszke, M. Grudniewska, E. Krol, B. Gromadzka, Universal biosensor for detection of influenza virus, Biosensors and Bioelectronics 59 (2014) 239-242
5. N. R. Shanmugam, S. Muthukumar, A. S. Tanak, S. Prasad, Multiplexed electrochemical detection of three cardiac biomarkers cTnI, cTnT and BNP using nanostructured ZnO-sensing platform, Future Cardiol. 14 (2018) 131-141
6. S. Y. Oh, N. S. Heo, S. Shukla, H. J. Cho, A. E. Vilian, J. Kim, Y. S. Huh, Development of gold nanoparticle-aptamer-based LSPR sensing chips for the rapid detection of Salmonella typhimurium in pork meat, Sci. Rep. 7 (2017) 10130
7. C. H. van den Kieboom, S. L. van der Beek, T. Meszaros, R. E. Gyurcsanyi, G. Ferwerda, M. I. de Jonge. Aptasensors for viral diagnostics, TrAC Trends in Analytical Chemistry 74 (2015) 58-67
8. N. Elgrishi, K. J. Rountree, B. D. McCarthy, E. S. Rountree, T. T. Eisenhart, J. L. Dempsey, A practical beginner’s guide to cyclic voltammetry, Journal of Chemical Education, 95(2) (2018) 197-206.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update