| 미생물 생체모방 기반의 단백질 상호작용을 응용한 고효율 효소 복합체 설계 | |
|---|---|
| Date 2021-04-22 13:25:47 |
|

교수 / 석사과정
성신여자대학교 바이오식품공학과 / 성신여자대학교 바이오식품공학과
hyeonje@sungshin.ac.kr / bin7358@daum.net
1. 서론
생체모방 (biomimetics, biomimicry)은 자연에서 볼 수 있는 디자인 요소들이나 생물체의 특성 모방을 통해 인류의 과제를 해결하는 데 목적을 두고 있다. 현재의 생체 모방학은 새로운 생체물질을 만들고, 새로운 지능 시스템을 설계하며, 생체 구조를 그대로 모방하여 혁신적인 디바이스를 만들고, 새로운 시스템을 설계하는 연구에 많은 도움을 주고 있다. 생체모방을 위한 하나의 대상인 미생물은 자연에 존재하는 가장 다양한 생물체로 그 특성을 이해하여 유용한 기능을 모방하고 있다. 예를 들어, 미생물을 모방한 바이오매스 유래의 신규 나노 소재 개발 연구는 저렴한 기질의 무한한 공급을 통해 지속적인 생산을 가능하게 하는 저비용-고효율성 기술 확보를 가능하게 한다. 상기 기술이 적용된 효소 복합체 시스템은 국내 생명공학 기술과 연관된 식품, 농업, 의약, 정밀화학 등의 산업 발전에 원동력이 되어 선진국과의 기술 격차를 감소시킬 수 있다. 특히, 차세대 유전체 기능 분석 및 대사제어를 통한 미생물 오믹스 (Omics) 정보 시스템 연구와 연계하고 학문적으로는 대사공학 및 시스템 생물공학을 기반으로 하여 인위적으로 세포의 대사과정을 조절함으로써 유용 생물 소재를 대량생산하는 다양한 연구가 진행되고 있다.
본 기고문에서는 위에서 언급한 연구 중 단백질 상호작용을 이용하여 만들어진 효소 복합체를 통한 유용한 물질을 생산하는 기술을 소개하려 한다. 이 기술의 중심 원리는 단백질 상호작용 현상이며, 이는 물리적으로 하나의 단백질이 다른 단백질 또는 여러 개의 단백질과 서로 결합하는 현상으로 대표적인 생체 내의 생화학적 반응 중의 하나이다. 단백질 간의 결합은 파트너가 되는 단백질들 서로 간의 결합 부위에서 비공유결합, 전기적 상호작용, 소수성 등의 구조적 특성으로 결합하는 현상을 보여준다. 이 상호작용을 통해 형성되는 효소 복합체 중 하나인 혐기성 미생물의 셀룰로좀(Cellulosome)은 효소들의 복합체를 세포 표면에 고정하고 섬유소 기질을 효과적으로 이용하기 위해 기질에 대한 특이적 결합력을 가지는 특별한 골격 단백질 Scaffoldin에 의하여 구축된다 [1]. 이러한 미생물의 생체모방을 통해 설계 가능한 단백질 상호작용들을 설명하고, 이를 통해 이루어지는 효소 복합체의 결합력과 효율성을 이용한 유용한 물질의 생산에 관한 최신 연구 동향을 살펴보고자 한다.
2. 본론
2.1. 바이오매스 분해 미생물 : Cellulosome의 단백질 상호작용
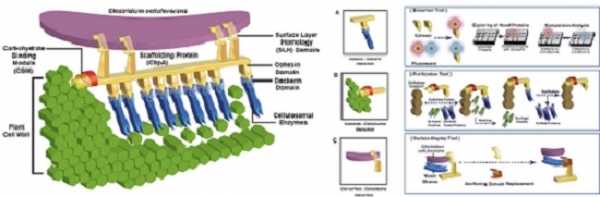
셀룰로좀이란 다중 효소 세포 외 복합체로, 미생물의 세포 표면과 연관되어 불용성 기질에 대한 세포 부착을 매개하고 이를 용해성 산물로 분해하여 흡수할 수 있도록 도와준다. 셀룰로좀 효소 복합체는 복잡한 다중 효소로 구성되어 식물 세포벽 다당류, 특히 지구상에서 가장 풍부한 유기 중합체인 셀룰로스의 효율적인 분해를 위해 많은 혐기성 미생물에 의해 생산된다 (그림 1).
셀룰로좀의 다중 서브 유닛은 서로 다른 유닛들 및 셀룰로스 기질과 상호 작용하는 수많은 기능적 펩타이드 모듈로 구성되며 이들 서브 유닛 중 하나인 골격 단백질 Scaffoldin은 비활성 폴리펩타이드의 독특한 부류이다 [2]. 셀룰로좀은 박테리아의 세포벽에 부착되거나 용액에 없는 세포 외 복합체로 존재하며, 여기서 불용성 기질은 용해성 생성물로 분해되어 미생물 세포에 흡수될 수 있다. 셀룰로좀을 구성하는 다양한 섬유소 분해 효소 중에서, 엔도글루카나아제, 셀로비오하이드롤라아제, 자일라노아제 및 기타 분해 효소는 이질적인 불용성 셀룰로스 기질을 분해하기 위해 시너지 효과를 발휘하며 이것은 골격단백질의 코히신 모듈과 각 효소 서브 유닛의 도커린 모듈의 단백질 상호작용으로 구성된다 [3-5]. 높은 친화력을 가진 코히신-도커린 상호작용은 셀룰로좀의 구조를 정의하며, 셀룰로좀이 섬유소 기질에 부착하는 것은 골격 단백질의 일부를 구성하는 Cellulose-binding Module (CBM)에 의해 매개된다.
셀룰로좀은 또한 다양한 효소의 함량에 따라 식물 세포벽 물질을 효율적으로 분해하며 이러한 효율적인 구성 및 가수 분해 활성으로 인해 셀룰로좀은 바이오매스 분해에 적용할 수 있는 엄청난 잠재력을 보유하고 있다. 따라서 현재 연구들은 리그노 셀룰로스를 바이오 연료와 같은 고부가가치 산물로 전환하기 위한 이상적인 효소 복합체 및 재조합 미생물을 설계하는 데 노력을 기울이고 있다 [6].
2.2. 그람 양성 미생물 : Fibronectin의 단백질 상호작용
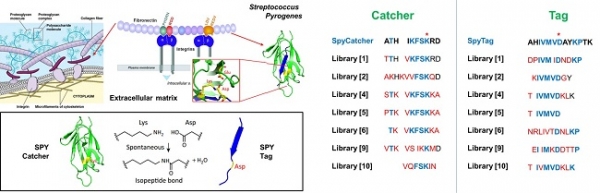
Fibronectin은 미생물의 세포외 매트릭스의 고분자 중량 (약 500kDa) 당단백질로서, Integin이라 불리는 막 스패닝 수용체 단백질 및 다른 세포외 매트릭스 단백질과 결합한다. Fibronectin은 단백질 이합체로 존재하며, 이황화 결합으로 연결된 거의 동일한 두 개의 단량체로 구성되어 있다 [7].
Fibronectin을 형성하는 단백질 상호작용에는 Isopeptide 결합이 있다. 이 결합은 한 아미노산의 카르복실기와 다른 아미노산의 아미노기 사이에 형성될 수 있는 아마이드 결합이며 이들 결합기 중 적어도 하나는 작용하는 아미노산 중 하나의 측쇄의 일부이다 [8]. 결합 형성은 트랜스글루타미네이스의 촉매를 통해 리신과 글루타민 사이에 형성되거나 박테리오파지 캡시드 형성과 그람 양성 박테리아에서 관찰된 것처럼 자발적으로 형성될 수 있다 [9-10]. 자발적 결합은 근접유도 방식으로 결합 형성을 촉매하는 또 다른 잔류물 글루타민산의 존재를 요구한다. Isopeptide 결합을 포함하는 작은 펩타이드의 예로는 글루타티온이 있는데, 글루타미트 잔류물의 옆 사슬과 시스테인 잔류물의 아미노 그룹 사이에 결합이 있다. Isopeptide 결합에 관여하는 단백질의 예는 유비퀴틴이 있는데, 이는 유비퀴틴의 C- 말단 글리신 잔기와 기질 단백질의 라이신 측쇄 사이의 결합을 통해 다른 단백질에 부착된다.
이러한 자발적인 Isopeptide 결합을 이용하여 SpyTag 이라는 펩타이드 태그를 개발했다. SpyTag는 공유 결합을 통해 결합 파트너 (SpyCatcher)와 자발적이고 비가역적으로 반응할 수 있다 [11]. 이 분자 도구는 생체 내 단백질 표적화, 형광 현미경 검사 및 단백질 마이크로 어레이에 대한 비가역적 부착을 위해 응용할 수 있다. 최근에는 이런 SpyTag-SpyCatcher를 보완하는 SnoopTag-SnoopCatcher [12] 및 SdyTag- SdyCatcher [13]와 같은 다른 시스템이 개발되었다 (그림 2).
2.3. 단백질 상호작용을 이용한 효소 복합체 연구
위에서 언급한 단백질 상호작용은 생화학, 양자 화학, 분자 역학, 신호 전달 등 여러 가지 방법과 다양한 관점에서 연구되었으며 세포 외 다중 효소 복합체 형성의 이론적 원리가 되기도 했다 [14]. 이 물질은 여러 코히신 모듈과 복합체를 세포 표면에 고정하고 셀룰로스 기질에 대한 특이적 결합을 매개하는 모듈 및 추가 기능 모듈로 구성된 골격 단백질의 설계로 시작된다. 이때 높은 친화성과 특이성을 가지고, 복합체 성분의 모듈성과 함께 효소 구성을 정의하고 제어할 수 있는 기술 확보가 중요하다. 그리고 이 기술은 이러한 복합체에서 일반적으로 관찰되는 높은 촉매 활성을 유도하기 위한 과학적인 원리를 반영하여야 한다. 효소 복합체의 원리를 기반으로 하는 복잡한 나노 머신은 인위적인 골격 단백질의 설계로도 가능하다 [15].
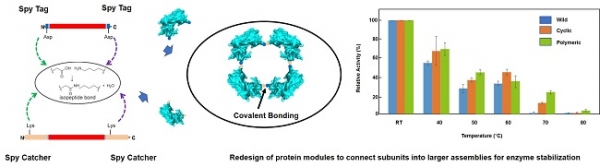
이것의 예시로는 앞에서 설명한 SpyCatcher 및 SpyTag를 들 수 있으며, 이들은 Streptococcus pyogenes 미생물에서 얻은 FbaB 단백질의 CnaB2 도메인의 분할 및 재설계로 형성되었고, 자연적으로 분자 내 Isopeptide 결합을 형성한다[16]. 특히 이러한 결합은 공유 결합으로 형성됨에 따라 구조적, 열적 및 pH 변화에 더 내성이 생기게 된다. 다시 말해, SpyTag-SpyCatcher 시스템은 재조합 단백질의 비가역적 접합을 위한 기술로, 펩티드 SpyTag (13개 아미노산)은 단백질 SpyCatcher (12.3kDa)과 자발적으로 반응하여 강한 결합을 형성한다. SpyTag 또는 SpyCatcher를 인코딩하는 DNA 서열은 원하는 다양한 효소 유전자에 재조합 방식으로 도입되어 융합 단백질을 형성할 수 있으며 이러한 융합 단백질은 SpyTag-SpyCatcher 시스템을 통해 간단하게 공유결합으로 연결될 수 있다. 이러한 단백질 상호작용을 응용하면 두 단백질 간의 전통적인 직접 유전적 융합으로 제한적이거나 불가능한 두 재조합 단백질 간에 생체 접합 또한 가능하다 (그림 3).
그림 3. 효소 복합체 설계를 통한 열안정성 효소 개발 연구 [20].
3. 결론 및 전망
단백질 상호작용을 통해 형성된 효소 복합체는 생물의 생합성 경로나 촉매 작용, 반응 속도 등 여러 부분에서 이점을 제공한다. 다중 효소 복합체를 형성하여 반응의 생성물이 거리를 최소화할 수 있는 구조가 있는데 이것은 효소의 공간적 구성을 최적화함으로써 반응 속도를 높일 수 있도록 해준다. 이 밖에 또 다른 대사적 이점은 다기능 효소에서 발생하는 것과 유사하게 이를 구성하는 효소의 촉매 활성을 조정하여 제어할 수 있다는 것이다. 위에서 언급한 세포 결합 다중 효소 복합체인 셀룰로좀은 지구상에서 가장 풍부한 폴리머 중 두 가지인 셀룰로스와 헤미셀룰로스의 분해를 조율함으로써 탄소 회전율에 중요한 역할을 한다.
현재 사회는 기존의 그리고 여전히 널리 사용되는 화석 연료에 대한 대체 및 재생 가능 에너지원을 찾는 도전적인 문제에 직면해 있으며 에너지 위기는 재생 가능한 기질을 기반으로 한 기술 개발이 필요하다. 이에 따라 재생 가능 에너지에 관한 관심이 높아지고 있으며, 모든 규모의 에너지 시스템으로의 구현을 계속 방해하는 기술 경제 장벽을 극복하기 위한 광범위한 연구가 진행되어왔다 [17]. 효소 복합체 기술은 이를 해결하는 방안으로 적용 가능하며, 최근에는 효소 활성을 최대화하거나 가수 분해와 미생물 발효 사이의 시너지 효과를 만들어 효소 작용을 개선하려는 수많은 연구가 있었다 [18,19]. Catcher와 Tag 간의 결합 또한 특이성, 비가역적 공유 결합 및 사용 용이성으로 인해 백신 생산에 응용되어 백신의 빠른 생산을 가능하게 하였고, 단백질의 양쪽 말단을 융합하여 열에 대한 효소의 안정성을 높일 수 있다[20]. 생의학에서 광범위한 응용 분야를 가지고 있는 단백질 하이드로겔 또한 Tag/Catcher 화학을 통해 겔 내에서 섬유 아세포와 같은 살아있는 포유류 세포의 캡슐화를 가능하게 하는 맞춤형 분자 네트워크를 생산할 수 있다.
이처럼 효소 복합체 기술은 현재 직면하고 있는 문제나 다양한 분야에 관하여 효과적인 방안을 제시할 수 있으며 그 효율을 향상할 수 있다. 본 기고문은 위와 같은 기술의 이론적 배경을 설명하면서 현재까지 진행되고 있는 관련 연구들에 대한 이해를 제공하였다. 이 주제에 대한 흥미를 도출할 수 있는 계기가 되었기를 바라며 이 글을 마친다.
참고 문헌
1. A. Galera-Prat et al., Impact of scaffoldin mechanostability on cellulosomal activity, Biomater. Sci., 8, 3601-3610 (2020).
2. Bayer, EA; Kenig, R; Lamed, R "Adherence of Clostridium thermocellum to cellulose". J. Bacteriol. 156(2), 818–827 (1983).
3. Fontes, Carlos M.G.A.; Gilbert, Harry J. "Cellulosomes: Highly Efficient Nanomachines Designed to Deconstruct Plant Cell Wall
Complex Carbohydrates". Annual Review of Biochemistry. 79(1), 655–681 (2010).
4. Hyeon JE, Jeon SD, and Han SO. Cellulosome-based, Clostridium-derived multi-functional enzyme complexes for advanced
biotechnology tool development: advances and applications. Biotechnol Adv. 31(6), 936-944 (2013).
5. Doi RH and Kosugi A. Cellulosomes: plant-cell-wall-degrading enzyme complexes. Nat Rev Microbiol. 2(7):541-551 (2004).
6. Artzi, L., Bayer, E. & Moraïs, S. Cellulosomes: bacterial nanomachines for dismantling plant polysaccharides. Nat Rev Microbiol 15,
83–95 (2017).
7. Pankov R, Yamada KM Fibronectin at a glance. Journal of Cell Science. 115 (Pt 20): 3861–3863 (2002).
8. DeJong, GAH; Koppelman, SJ Transglutaminase Catalyzed Reactions: Impact on Food Applications. Journal of Food Science.
67(8), 2798–2806 (2002).
9. Wikoff, WR; et al. Topologically linked protein rings in the bacteriophage HK97 capsid. Science. 289 (5487), 2129–2133 (2000).
10. Kang, H. J.; Coulibaly, F.; Clow, F.; Proft, T.; Baker, E. N. Stabilizing isopeptide bonds revealed in gram-positive bacterial pilus
structure. Science. 318 (5856), 1625–1628 (2007).
11. Zakeri, B. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin. Proceedings of the
National Academy of Sciences. 109 (12), E690–697 (2012).
12. Veggiani, Gianluca; Nakamura, Tomohiko; Brenner, Michael D.; Gayet, Raphaël V.; Yan, Jun; Robinson, Carol V.; Howarth, Mark.
Programmable polyproteams built using twin peptide superglues. Proceedings of the National Academy of Sciences. 113(5),
1202–1207 (2016).
13. Titeca, Kevin; Lemmens, Irma; Tavernier, Jan; Eyckerman, Sven. Discovering cellular protein-protein interactions: Technological
strategies and opportunities. Mass Spectrometry Reviews. 38 (1), 79–111 (2018).
14. MichalSlutzki, YoavBarak,, DanReshef, OraSchueler-Furman, RaphaelLamed,, Edward A.Bayer., Chapter twenty-two -
Measurements of Relative Binding of Cohesin and Dockerin Mutants Using an Advanced ELISA Technique for High-Affinity
Interactions, Methods in Enzymology, 510, 417-428 (2012)
15. Kang HJ, Baker EN. Intramolecular isopeptide bonds: protein crosslinks built for stress?. Trends in Biochemical Sciences. 36(4),
229–237 (2011).
16. Brune KD, Howarth M New Routes and Opportunities for Modular Construction of Particulate Vaccines: Stick, Click, and Glue". Frontiers in Immunology. 9, 1432 (2018).
17. Aditiya HB, Chong WT, Mahlia TM, Sebayang AH, Berawi MA, Nur H. Second generation bioethanol potential from selected
Malaysia’s biodiversity biomasses: a review. Waste Manag. 47(Pt A):46–61 (2016).
18. Goncalves, G.A.L.; Mori, Y.; Kamiya, N. Biomolecular assembly strategies to develop potential artificial cellulosomes. Sustain.
Chem. Process. 2, 19 (2014).
19. Moraïs, S.; Shterzer, N.; Lamed, R.; Bayer, E.A.; Mizrahi, I. A combined cell-consortium approach for lignocellulose degradation by
specialized Lactobacillus plantarum cells. Biotechnol. Biofuel. 7, 112 (2014).
20. Schoene C, Bennett SP, Howarth M. SpyRings Declassified: A Blueprint for Using Isopeptide-Mediated Cyclization to Enhance
Enzyme Thermal Resilience. Methods in Enzymology. 580, 149–167 (2016).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update