| 노인성 근감소증 개선을 위한 mitochondrial-derived peptide | |
|---|---|
| Date 2021-10-03 17:14:04 |
|

Postdoctoral Fellow / Professor / Research Assistant Professor
University of Southern California
hkumagai@usc.edu / hassy@usc.edu / sujkim@usc.edu
1. 서론
미국 질병 통제 센터 (CDC)에 따르면 근감소증이 발병한 미국의 65세 이상 성인 비율은 2030년까지 12.4%에서 19.6%, 2050년까지 25.8%로 증가한다. 미국에서 근감소증으로 인한 경제적 부담은 현재 연간 185억 달러에 달한다 [1]. 한국의 경우도 크게 다르지 않다. 최근 메타 분석에 따르면 한국인 65세 이상의 경우 남성의 14.9%, 여성의 11.4%가 근감소증이 있는 것으로 보고되었다 [2].
인체에서 가장 큰 기관인 골격근은 자세, 운동 및 내분비계 유지에 필수적이다 [3]. 이때문에 골격근의 감소는 신체 여러 필수 기능에 해롭다. Journal of the American Geriatrics Society 학술지에 발표된 역학 연구에 따르면 근감소증은 전체 사망률의 위험을 증가시키고 이동성 장애 (mobility disabilities) 발병 위험을 두 배로 늘리고 낙상 위험을 세 배로 하여 일상생활 활동에 지장을 준다 [4]. 또한, 연령에 따른 근육량 감소와 호흡근 감소는 호흡부전을 유발하여 고령자의 입원율을 높인다 [5]. 근감소증은 신체 장애를 일으킬 뿐만 아니라 내분비 기관으로서 포도당 및 지방산 대사에 관여하기 때문에 심혈관 및 대사 질환의 발병에 기여한다 [3,6].
근감소증의 병인은 시간이 지남에 따라 근육량의 점진적인 손실이 특징이며, 급격한 손실과 영양 부족으로 더 급속화 될 수 있다 [7]. 현재 근감소증 치료제는 없다. 근감소증에 가장 효과적인 중재는 저항운동 (resistance exercise)이고, 신체활동을 유지하는 것 또한 그 진행을 지연시킬 수 있다 [8]. 하지만 활동적인 생활 방식 (active lifestyle)을 유지하는 것이 중요하다고 강조되고 있으나, 유지하는 것은 쉽지 않다. 따라서 대체 근감소증 치료와 예방 솔루션이 필요하다. 본 기고문에서는 미토콘드리아 펩타이드 MOTS-c의 근감소증 치료제로서의 가능성에 대해 소개하고자 한다.
2. 근감소증과 미토콘드리아
근육량은 단백질 합성과 분해의 균형에 의해 조절되기 때문에 단백질 항상성의 유지는 전신 및 골격근을 포함한 조직 기능에 필수적이다. 골격근에서 단백질 항상성이 손상될 경우, 수축성 단백질이 근육내에 축적되어 근육 기능이 저하되고 근육양이 감소한다 [9]. 단백질 전환 및 손상된 단백질 복구에 관여하는 효소를 유지하기 위해서는 높은 에너지가 요구되기 때문에, 에너지 생산의 원천인 미토콘드리아는 적절한 단백질 항상성을 유지하는 데 중요하다. 따라서 미토콘드리아 기능의 손상은 단백질 항상성 유지를 손상시킨다. 여러 횡단면 인간 연구 (cross sectional human studies)에 의해 입증된 바와 같이 미토콘드리아 기능은 연대순 연령 (chronological age)이 늘어남에 따라 감소한다 [10]. Baltimore Longitudinal 연구는 골격근에서 미토콘드리아 호흡의 감소가 생체 내 산화 능력, 심폐 적합성 및 근력 감소와 병행한다는 것을 보여준다 [11]. 또한 연령에 따른 골격근 미토콘드리아 용량의 감소는 느린 보행 속도, 피로도 증가 및 근육 감소증의 원인이 된다 [12,13]. 전임상 모델을 이용한 연구도 미토콘드리아 에너지와 근육량 조절 사이의 밀접한 연관성을 보여준다. 근감소증 전임상 모델은 미토콘드리아의 세포자멸사 촉진 인자의 방출, 형태학적 변화 (fusion and fission), 낮은 ATP에 의해 유도된 에너지 스트레스, 증가된 미토콘드리아 활성 산소 종 (ROS) 방출을 보인다 [14-16]. 이러한 모든 결과는 근육감소증에서 미토콘드리아 에너지와 기능이 중심 역할을 하는 것을 보여준다.
3. 미토콘드리아 유래 펩타이드 (Mitochondrial-derived peptides, MDPs)
미토콘드리아 유래 펩타이드는 미토콘드리아 DNA의 short open reading frame에서 만들어지는 미세단백질 (microprotein)이다. 미토콘드리아 유래 펩타이드는 세포 내부와 외부에서 다양한 기능을 가지며 미토콘드리아 신호 전달 물질 (retrograde signaling)로 작용하기도 한다. 미토콘드리아 유래 펩타이드 계열에는 16S rRNA 영역에서 전사 (encode)되는 Humanin 및 SHLPs가 포함되며12S rRNA 영역에서 전사되는 MOTS-c가 있다 [17]. 미토콘드리아 유래 펩타이드는 다양한 질병 모델에 투여되어 동맥경화, 알츠하이머 및 항암치료로 인한 부작용의 진행을 지연시킨다. 혈장 Humanin, SHLP2 및 MOTS-c 양은 나이가 들면서 줄어들며, 그 수치는 내피 기능과 상관관계가 있으며 전립선암에서 알츠하이머에 이르기까지 다양한 질병과 연관성이 있다 [18]. 미토콘드리아 유래 펩타이드 수치는 식이 제한과 운동에 의해 상향 조절된다. 여러 미토콘드리아 유래 펩타이드가 노화 질환에 대한 다양한 전임상 개발단계에 있다 (그림 1).
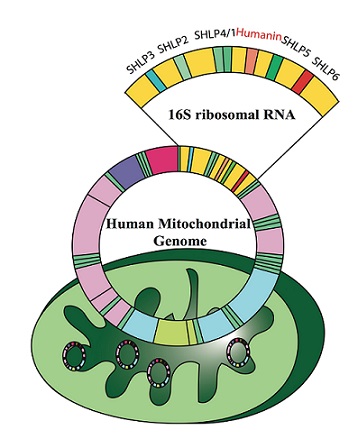
그림 1. 미토콘드리아 유래 펩타이드.
4. Mitochondria Open reading frame within the Twelve S rRNA c (MOTS-c)
4.1. MOTS-c 소개
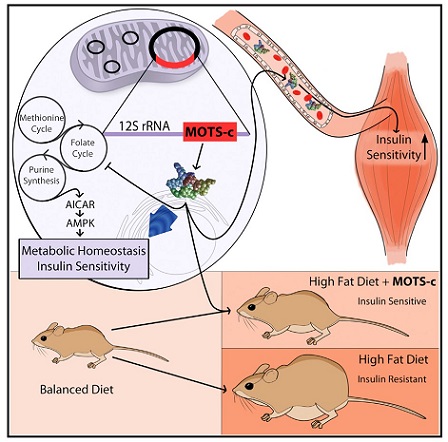
MOTS-c는 미토콘드리아 DNA의 12S rRNA 영역에 의해 전사되는 미토콘드리아 유래 펩타이드다. MOTS-c는 혈장과 심장 및 골격근과 같은 대사 활성 조직에서 발현된다. MOTS-c는 미토콘드리아와 핵 사이의 통신 (retrograde signaling)을 통해 세포 항상성을 조절하는데, 대사 스트레스 시 MOTS-c는 핵으로 이동하여 항산화 반응 요소 및 NRF2 발현을 촉진한다[19]. NRF2는 세포 산화 환원 항상성 조절의 핵심 요소이고, 미토콘드리아 biogenesis를 유발한다. 쥐 모델에 투여 시 MOTS-c는 지방 저장, 체질량을 감소시키면서 인슐린 감수성과 골격근 및 간으로의 포도당 흡수를 개선한다 [20]. 실제로, 최근 연구에 따르면 혈장 MOTS-c 수치는 일반 그룹에 비해 비만 남아의 경우 20% 감소해 있고 이러한 감소는 혈당 조절불량, 인슐린 저항성, 허리 둘레 증가 및 체질량 지수 증가와 관련이 있다 [21] (그림 2).
4.2. MOTS-c 와 운동 상관 관계
혈장 MOTS-c 수치는 급성 운동 중 및 후에 상승한다. 또한, 3개월간의 운동 프로그램 후에 혈장 MOTS-c 수치가 만성적으로 상승한다. 최근 연구에 따르면 급성 고강도 유산소 운동이 골격근의 MOTS-c 발현을 상향 조절하여 혈장 MOTS-c 발현을 증가시키는 것으로 나타났다. 규칙적인 유산소 운동은 대사 장애의 치료 및 예방 방법 중 하나이며, 그 유익한 효과는 AMPK 및 SIRT1과 같은 유산소 운동 유도 신호에 의해 매개된다는 것이 널리 받아들여지고 있다 [20]. 이전 연구는 MOTS-c의 대사 보호 효과가 AMPK 의존적 방식으로 달성되었음을 보여주었으며, 이는 유산소 운동과 MOTS-c가 골격근에서 동일한 신호 전달 경로를 공유함을 시사한다. 게다가, 우리의 최근 연구는 2주간의 MOTS-c 주사가 젊은 쥐와 늙은 쥐 모두에서 달리기 능력을 증가시킨다는 것을 보여주었다 [22]. 늙은 쥐 (22개월)에게 MOTS-c를 투여했을 때, 같은 나이의 처리되지 않은 쥐보다 회전하는 막대에서 균형을 유지하고 가속 트레드밀에서 달리는 것이 훨씬 더 우수했다. 또한, MOTS-c를 처리한 젊은 쥐와 늙은 쥐는 보행 (보폭으로 측정) 및 신체 능력 (걷기 테스트로 평가), 쥐는 힘이 개선된 것으로 나타났다. 유사하게, MOTS-c 투여는 고지방 식이를 섭취한 쥐의 신체 능력과 수행 능력을 향상시켰다. 이러한 연구결과는 MOTS-c가 운동 모방 효과가 있음을 시사한다.
4.3. MOTS-c 와 근감소증
운동 모방 펩티드인 MOTS-c는 고지방식이 (HFD)를 섭취한 쥐에서 대사 항상성을 유지하고 인슐린 감수성을 증가시키는 것으로 나타났다. 인슐린 저항성은 골격근 질량과 근력의 손실을 가속화한다. 따라서 우리는 MOTS-c가 HFD를 먹인 쥐의 근육량에 영향을 미치는 지를 조사했다. HFD를 먹인 쥐에서 근육량이 감소한 반면, MOTS-c 투여는 HFD를 먹인 쥐에서 근육량 감소를 방지했다 [23]. HFD 공급은 골격근에서 미오스타틴 mRNA 발현을 증가시키는 반면, MOTS-c는 HFD 공급 동안 미오스타틴 유전자 발현을 억제한다. 미오스타틴 유전자 발현은 마우스의 근육량과 반비례한다. 미오스타틴 (myostatin)은 근육 손실을 촉진하는 단백질이다. MOTS-c는 미오스타틴 이외 근육 손실을 촉진하는 유전자 atrogin-1의 발현도 억제했다. 근육 내 지질의 축적 증가는 인슐린 저항성, 이상지질혈증 및 지방독성을 유발할 수 있다. 팔미테이트 (Palmitate)는 순환계에서 가장 풍부한 포화지방산으로 이상지질혈증에서 포화지방산이 다양한 조직에 미치는 영향을 조사하기 위해 자주 사용되어 왔다. 여러 세포 유형에서 팔미테이트 처리는 세포자멸사를 초래하고 인슐린에 반응하여 AKT 활성을 억제하는 것으로 밝혀졌다. 예를 들어, 분화된 C2C12 근육세포가 팔미테이트에 노출되면 근섬유 손실이 발생한다. HFD는 팔미트산과 같은 포화 지방산이 풍부하기 때문에 MOTS-c가 분화된 C2C12 근육세포에서 팔미트산으로 인한 근섬유 손실을 예방할 수 있는지 여부를 조사했다. 팔미테이트는 근관의 수와 직경을 감소시켰으나 MOTS-c의 처리는 근관의 손실을 방지하고 또한 직경을 증가시켰다. 또한, 세포 직경의 분포는 팔미트산과 MOTS-c 처리된 근관에서 대조군 근관과 거의 동일했다. 이러한 결과는 MOTS-c가 팔미트산으로 인한 근관 위축 및 근관 손실을 예방한다는 것을 시사한다.
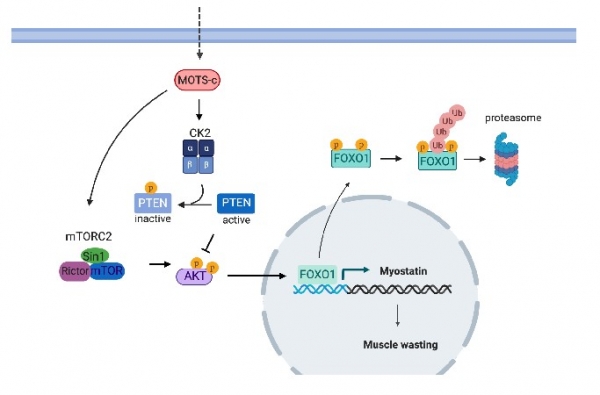
4.4. MOTS-c 와 근감소증 관련 신호전달 경로
전사인자 포크헤드 박스 단백질 O1 (FOXO1)은 미오스타틴 프로모터에 직접 결합하여 골격근에서 미오스타틴 및 근육 소모 유전자의 전사를 상향 조절한다 [24]. FOXO1 발현 수준은 번역 후 변형, 세포내 국소화 및 유비퀴틴-프로테아좀 시스템에 의해 엄격하게 조절된다 [25]. 예를 들어, 핵에서 FOXO1 활성화는 이러한 근육 소모 유전자의 상향 조절의 결과로 근육 위축을 유발하지만 FOXO1이 인산화되면 핵에서 제외되어 세포질로 이동한다. 세포질에서 인산화된 FOXO1은 추가로 유비퀴틴화되고 프로테아좀에 의해 분해된다. 따라서 이 인산화는 FOXO1 기능에서 중요한 역할을 한다. 골격근에서 인슐린 신호는 FOXO1 인산화를 증가시키고 근육 소모 관련 유전자를 억제한다 [26]. 인슐린은 수용체에 결합하고 PDK1을 활성화하여 Thr308에서 AKT를 인산화킨다. Ser473에서의 추가 인산화는 AKT를 완전히 활성화하고 활성화된 AKT는 FOXO1을 인산화한다. 인슐린-PI3K-AKT-FOXO1 경로는 인슐린 저항성 상태에서 덜 활성화될 수 있으며, 이는 HFD를 먹인 마우스에서 골격근 기능과 질량의 손실을 부분적으로 설명한다. 이전연구에서 MOTS-c는 AKT 인산화를 증가시키는 것으로 나타났다. 최근 연구에서 우리는 MOTS-c가 AKT 경로의 표적 부위인 Ser256 및 Thr24 잔기에서 FOXO1 인산화를 증가시키는 것을 발견했다. 또한 총 FOXO1 발현 양은 대조군 마우스와 비교하여 MOTS-c 처리된 마우스에서 더 낮았는데, 이는 인산화된 FOXO1이 세포질로 전위되어 분해됨을 시사한다. MOTS-c는 mTORC2를 증가시키고 PTEN 활성을 억제하여 AKT 인산화를 조절한다. 또한 MOTS-c는 CK2 활성을 증가시켜 PTEN 억제를 유도한다. 구체적인 신호 전달 경로는 올해 1월 미국 생리학-내분비학 및 대사 저널 (American Journal of Physiology-Endocrinology and Metabolism)에 발표되었다 [23] (그림3).
5. 결론
근감소증은 노화의 특징인 근육량, 근력 및 신체 기능의 손실이다. 근감소증의 진행은 점진적이지만, 질병이나 부상으로 신체 활동이 없는 동안 근육 손실 기간에 의해, 영양 섭취 부족, 또는 비만에 의해 가속화될 수 있다. 운동성 및 독립성의 상실 및 근감소증과 관련된 동반 질환의 증가는 노인에게 주요 의료 문제를 나타낸다. 근감소증에 치료법이 현재 존재하지 않기 때문에 근감소증 치료제 개발은 시급하다. 현재 치료제 개발은 미오스타틴과 같은 근육 감소를 촉진하는 단백질을 표적으로 하는 것이 대부분이다. 몇 가지 다른 미오스타틴 억제제가 확인되었지만 아직 임상 시험에서 근육 소모 상태를 성공적으로 줄이는 것은 없었다. 이것은 근육량을 개선하는 것만으로는 충분하지 않기 때문으로 여겨진다. 미토콘드리아 기능 장애 및 손상된 단백질 세포 메커니즘은 근감소증의 복잡한 병인에 기여한다. 따라서 근육량 개선과 함께 미토콘드리아 기능을 높이는 것도 핵심이다. 운동은 현재 근육감소증을 치료하는 유일한 효과적인 옵션이며 부분적으로 미토콘드리아 에너지와 단백질 회전율을 개선한다. 우리는 최근 연구를 통해 운동에 의해 유도되는 미토콘드리아 유래 펩타이드, MOTS-c의 근감소증에 대한 분자 기전을 밝혔다. MOTS-c는 근육양과 미토콘드리아 기능 두 가지를 모두 조절할 수 있기 때문에 중요한 표적이 된다고 생각한다. 따라서 다양한 근감소증 전임상 모델을 통한 후속 연구를 계획하고 있다. 현재 MOTS-c는 비알코올성 지방간염에 대한 치료제로 임상 1상을 마쳤다. MOTS-c와 근감소증 대한 후속연구를 통해 근무력증의 치료제로서의 개발 가능성을 기대한다.
참고문헌
1. Janssen, I., Shepard, D.S., Katzmarzyk, P.T. and Roubenoff, R. (2004) The Healthcare Costs of Sarcopenia in the United States: ECONOMIC COST OF SARCOPENIA. Journal of the American Geriatrics Society (JAGS), 52, 80-85.
2. Choo, Y.J. and Chang, M.C. (2021) Prevalence of Sarcopenia Among the Elderly in Korea: A Meta-Analysis. Journal of preventive medicine and public health, 54, 96-102.
3. Pedersen, B.K. and Febbraio, M.A. (2012) Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nature reviews. Endocrinology, 8, 457-465.
4. Janssen, I., Heymsfield, S.B. and Ross, R. (2002) Low Relative Skeletal Muscle Mass (Sarcopenia) in Older Persons Is Associated with Functional Impairment and Physical Disability. Journal of the American Geriatrics Society (JAGS), 50, 889-896.
5. Kelley, R.C. and Ferreira, L.F. (2017) Diaphragm abnormalities in heart failure and aging: mechanisms and integration of cardiovascular and respiratory pathophysiology. Heart failure reviews, 22, 191-207.
6. Batsis, J.A., Mackenzie, T.A., Barre, L.K., Lopez-Jimenez, F. and Bartels, S.J. (2014) Sarcopenia, sarcopenic obesity and mortality in older adults: results from the National Health and Nutrition Examination Survey III. European journal of clinical nutrition, 68, 1001-1007.
7. English, K.L. and Paddon-Jones, D. (2010) Protecting muscle mass and function in older adults during bed rest. Current opinion in clinical nutrition and metabolic care, 13, 34-39.
8. Landi, F., Marzetti, E., Martone, A.M., Bernabei, R. and Onder, G. (2014) Exercise as a remedy for sarcopenia. Current opinion in clinical nutrition and metabolic care, 17, 25-31.
9. Ayyadevara, S., Balasubramaniam, M., Suri, P., Mackintosh, S.G., Tackett, A.J., Sullivan, D.H., Shmookler Reis, R.J. and Dennis, R.A. (2016) Proteins that accumulate with age in human skeletal-muscle aggregates contribute to declines in muscle mass and function in Caenorhabditis elegans. Aging (Albany, NY.), 8, 3486-3497.
10. Trounce, I., Byrne, E. and Marzuki, S. (1989) DECLINE IN SKELETAL MUSCLE MITOCHONDRIAL RESPIRATORY CHAIN FUNCTION: POSSIBLE FACTOR IN AGEING. The Lancet (British edition), 333, 637-639.
11. Gonzalez-Freire, M., Scalzo, P., D’Agostino, J., Moore, Z.A., Diaz-Ruiz, A., Fabbri, E., Zane, A., Chen, B., Becker, K.G., Lehrmann, E. et al. (2018) Skeletal muscle ex vivo mitochondrial respiration parallels decline in vivo oxidative capacity, cardiorespiratory fitness, and muscle strength: The Baltimore Longitudinal Study of Aging. Aging cell, 17, e12725-n/a.
12. Coen, P.M., Jubrias, S.A., Distefano, G., Amati, F., Mackey, D.C., Glynn, N.W., Manini, T.M., Wohlgemuth, S.E., Leeuwenburgh, C., Cummings, S.R. et al. (2013) Skeletal muscle mitochondrial energetics are associated with maximal aerobic capacity and walking speed in older adults. The journals of gerontology. Series A, Biological sciences and medical sciences, 68, 447-455.
13. Santanasto, A.J., Glynn, N.W., Jubrias, S.A., Conley, K.E., Boudreau, R.M., Amati, F., Mackey, D.C., Simonsick, E.M., Strotmeyer, E.S., Coen, P.M. et al. (2015) Skeletal Muscle Mitochondrial Function and Fatigability in Older Adults. The journals of gerontology. Series A, Biological sciences and medical sciences, 70, 1379-1385.
14. Peter, J.A., Michael, F.N.O.L., Beatrice, C., Karen, L.W. and David, A.H. (2007) Effect of denervation on mitochondrially mediated apoptosis in skeletal muscle. Journal of Applied Physiology, 102, 1143-1151.
15. Petersen, Y., Sandri, M., Gomes, L., Milan, G., Roder, I., Sandri, C., Guadagnin, E., Del Piccolo, P., Scorrano, L., Masiero, E. et al. (2010) Mitochondrial fission and remodelling contributes to muscle atrophy. The EMBO journal, 29, 1774-1785.
16. Florian, L.M., Wook, S., Youngmok, C.J., Yuhong, L., Marian, S., Arlan, R. and Holly Van, R. (2007) Denervation-induced skeletal muscle atrophy is associated with increased mitochondrial ROS production. American Journal of Physiology - Regulatory, Integrative and Comparative Physiology, 293, 1159-1168.
17. Miller, B., Kim, S.J., Kumagai, H., Mehta, H.H., Xiang, W., Liu, J., Yen, K. and Cohen, P. (2020) Peptides derived from small mitochondrial open reading frames: Genomic, biological, and therapeutic implications. Exp Cell Res, 393, 112056.
18. Kim, S.J., Miller, B., Kumagai, H., Silverstein, A.R., Flores, M. and Yen, K. (2020) Mitochondrial-derived peptides in aging and agerelated diseases. Geroscience.
19. Kim, K.H., Son, J.M., Benayoun, B.A. and Lee, C. (2018) The Mitochondrial-Encoded Peptide MOTS-c Translocates to the Nucleus to Regulate Nuclear Gene Expression in Response to Metabolic Stress. Cell metabolism, 28, 516-524.e517.
20. Lee, C., Zeng, J., Drew, Brian G., Sallam, T., Martin-Montalvo, A., Wan, J., Kim, S.-J., Mehta, H., Hevener, Andrea L., de Cabo, R. et al. (2015) The Mitochondrial-Derived Peptide MOTS-c Promotes Metabolic Homeostasis and Reduces Obesity and Insulin Resistance. Cell metabolism, 21, 443-454.
21. Du, C., Zhang, C., Wu, W., Liang, Y., Wang, A., Wu, S., Zhao, Y., Hou, L., Ning, Q. and Luo, X. (2018) Circulating MOTS-c levels are decreased in obese male children and adolescents and associated with insulin resistance. Pediatr Diabetes.
22. Reynolds, J.C., Lai, R.W., Woodhead, J.S.T., Joly, J.H., Mitchell, C.J., Cameron-Smith, D., Lu, R., Cohen, P., Graham, N.A., Benayoun, B.A. et al. (2021) MOTS-c is an exercise-induced mitochondrial-encoded regulator of age-dependent physical decline and muscle homeostasis. Nature communications, 12, 470-470.
23. Kumagai, H., Coelho, A.R., Wan, J., Mehta, H.H., Yen, K., Huang, A., Zempo, H., Fuku, N., Maeda, S., Oliveira, P.J. et al. (2021) MOTS-c reduces myostatin and muscle atrophy signaling. American journal of physiology: endocrinology and metabolism, 320, E680-E690.
24. David, L.A. and Terry, G.U. (2007) Regulation of myostatin expression and myoblast differentiation by FoxO and SMAD transcription factors. American Journal of Physiology - Cell Physiology. 292, 188-99.
25. Huang, H. and Tindall, D.J. (2011) Regulation of FOXO protein stability via ubiquitination and proteasome degradation. Biochimica et biophysica acta Molecular cell research. 1813, 1961-4.
26. Cheng, Z. and White, M.F. (2011) Targeting Forkhead Box O1 from the Concept to Metabolic Diseases: Lessons from Mouse Models. Antioxidants & redox signaling. 14, 649-61.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update