| 노인성 근감소증 개선을 위한 microRNA | |
|---|---|
| Date 2021-10-03 17:32:44 |
|

책임연구원
한국생명공학연구원 노화제어전문연구단
kplee@kribb.re.kr
세계적으로 고령화에 대한 문제 인식이 높아지고 있는 가운데, 우리나라의 고령화 속도는 최고수준으로 2025년 초고령사회에 진입하면서 고령 의료비 지출도 급증할 것으로 전망된다. 현대의학의 발전으로 평균수명의 획기적 증가가 이뤄졌는데, 건강한 노후 생활을 위해서는 향후 노화과학 연구를 통한 건강수명 증가가 절실한 상황이다. 최근 수년간 과학자들의 연구로 인해 노화에 관련된 수많은 유전자와 작용 기전이 알려짐에 따라, 노화란 누구도 피할 수 없는 것이 아니라, 치료 혹은 늦출 수 있는 질병으로 보는 발상의 전환이 일어났는데, 본 연구팀도 이에 발맞춰 건강수명을 연장하고, 고령화 사회의 의료사회비용 문제를 극복하기 위해 노인성 근육감소증 (sarcopenia)에 대해서 연구하고 있다.
노화에 따른 근육량의 급격한 감소는 심각한 활동 장애 및 2차 노인성 질환을 유발하여 경제사회적 손실을 야기한다. 50대 후반부터 노인성 근감소증 환자가 발생하여 65세 이상 인구의 ~50%가 근감소증 환자에 해당하는 유병률(환자의 비중)이 가장 큰 질환이다. 노년기 근감소증에 의한 근력 약화는 노쇠 현상을 가속화하며 체력 저하 및 자립성 약화를 초래한다. 또한 근육은 체내 혈당을 낮추는 가장 큰 기관으로서 음식 섭취 시 혈액에 높아진 혈당을 흡수하였다가 공복시에 이를 다시 내어놓는 저수지와 같은 역할을 수행하여 당뇨와 비만 등을 억제한다. 특히 초기 당뇨의 경우 운동에 의한 근육량 증가로 완치효과를 볼 수 있다. 이렇게 노화로 인한 근육감소는 활동장애, 보행장애뿐만 아니라 다양한 노인성 2차 질환인 당뇨, 고혈압, 심혈관 질환을 유발하여 독립적인 노후 생활을 불가능하게 하고 장기간 병수발이 필요하게 하여 건강수명을 단축한다. 노인성 근감소증은 대부분의 노인들에게 있어서 피할 수 없는 질환임에도 불구하고, 치매, 심혈관 질환 및 골다공증과 같은 다른 노인성 질환에 비해서 그 중요성이 간과되고 있는데, 노인성 근감소증의 예방 및 치료 연구를 통해서 노인들의 건강하고 자립적인 노후 생활을 보장함으로써 건강수명을 연장하고, 고령인구의 삶의 질 향상에 기여할 것이다. 향후, 고령화로 인해 고령인구가 더 많아지는 역피라미드 형이 되면, 경제활동에 참여하는 인구가 줄어서 경제적 생산성이 감소할 것이다. 근육노화 제어 연구는 고령인구의 근력을 강화시켜서 자립적인 생활 및 경제활동 참여가 가능하게 할 것이다. 따라서 초고령 사회의 경제사회적 생산성 향상에 크게 기여하게 될 것으로 생각된다.
노인성 근감소증은 노화에 따른 근육량과 근육 기능 감소의 대표적인 증상으로, 호르몬 불균형, 운동신경 퇴화, 만성적인 염증반응, 산화적 스트레스 등에 의해 발생한다고 알려져 있다. 다른 유발 원인으로는 노화 근육줄기세포 (Satellite cell/Myoblast)의 자기재생능 및 분화능 저하이다. 본 연구팀은 2010년부터 본격적으로 근육노화를 유발하는 내재적 인자를 찾기 위해 전사체 분석을 수행하였고, 그 결과 근육과 근육줄기세포에서 특정 마이크로 RNA (miRNA) cluster의 발현이 변화하는 것을 확인하였다 (Kim et al., Aging, 2014; Lee et al., Genes Dev, 2015). 마이크로 RNA (miRNA)는 22개 nucleotide로 구성되어, 타겟 mRNA의 단백질로의 전환을 조절하는 인자로 알려져 있는데, 근육 특이적 miRNA가 존재하여 근육의 발생을 조절하는 다양한 단백질을 조절함으로써 근육의 크기, 기능 등을 조절함이 밝혀져 있었지만, 노화에 따른 근육 항상성 저하에 관여하는 miRNA는 밝혀진 것이 없기에, 이 분야에 대한 연구의 필요성이 꾸준히 제기되어 왔다. 또한 본 연구팀은 최근 특정 genomic locus에 존재하는 miRNA들이 근육노화를 제어할 수 있는 연구결과를 발표하였다 (Shin et al., J Cachexia Sarcopenia Muscle, 2020). 노화에 따라 근육량과 기능이 상실되는 것을 ‘Sarcopenia’로 정의하는데, 우리 연구팀을 포함한 몇몇의 연구그룹에서 근육노화를 조절하는 miRNA 역할에 관한 연구결과를 제시하고 있다. 근육 항상성에 관여하는 miRNA의 연구결과를 향후 관련 연구를 진행하는 연구자들에게 조금이라도 도움이 되었으면 하는 마음에서 한국생물공학회 소식지에 소개하고자 한다.
가장 광범위하게 연구된 noncoding RNA 부류인 MicroRNA (miRNA)는 약 22개 뉴클레오티드 길이의 단일 가닥 분자로, 전사 후 수준에서 유전자 조절자 역할을 한다. 본 연구팀은 최근 노화된 마우스 골격근 및 근원세포에서 발현이 감소되어 있는 miRNA의 > 50%가 the delta-like homolog 1 and the type III iodothyronine deiodinase (Dlk1-Dio3) 게놈영역에 클러스터되어 있음을 확인하였다. Dlk1-Dio3은 포유류에서 가장 큰 miRNA 클러스터로 알려져 있는데, 대부분의 miRNA는 안티센스 Rtl1 및 Mirg 의 더 큰 전사체 내에 존재한다. miR-127, miR-410, miR-431, miR-433 및 miR-434를 포함하여 Dlk1-Dio3 유전자좌에 위치한 여러 miRNA는 근육 분화 및 근육 재생과 같은 근육 항상성 기능과 관련이 있다고 보고된 바 있으나, 근육 노화에서 Dlk1-Dio3 miRNA 클러스터의 기능은 불분명하다. 본 연구팀은 최근 이 miRNA 클러스터가 노화에 의한 근육 위축을 개선할 수 있음을 확인하였다.
근육량은 동화작용과 이화작용의 동적 균형에 의해 결정된다. MuRF1 및 Atrogin-1과 같은 근육 특이적 E3 ligase는 근육을 사용하지 않거나 신경 손상과 같은 근육 질병에서 현저하게 증가하는 것으로 보고된 바 있는데, 노화 근육에서 E3 ligase 발현의 조절 메커니즘은 알려져 있지 않았다. 본 연구팀은 근육 노화 과정에서 miRNA에 의한 Atrogin-1 발현조절의 기본 메커니즘을 규명하였는데, Dlk1-Dio3 클러스터 내 존재하는 miRNA가 근육 노화에서 Atrogin-1 발현을 억제함으로써 근육 위축에 유익한 효과가 있음을 확인하였다. 본 연구팀은 Dlk1-Dio3 유전자 좌에서 마우스와 인간에서 서열이 보존된 42개의 pre-miRNA가 노화 근육의 주요 표현형인 근육 위축을 조절하는 효능이 있는지 확인한 결과, 흥미롭게도 42개 중 33개의 pre-miRNA가 대조군보다 훨씬 더 큰 직경을 유도하는 것을 관찰하였다. 이러한 결과는 Dlk1-Dio3 클러스터 내 miRNA의 노화에 의한 발현 감소가 골격근 위축에 기여할 수 있음을 제시한다. miRNA의 후보 표적을 확인하기 위해 TargetScan 알고리즘 (www.targetscan.org)을 사용하여 추정 결합 부위를 검색한 결과, 18개의 premiRNA가 근육 특이적 E3 ligase인 Atrogin-1 3’ UTR 에 결합하는 것으로 예측되었다. 예측된 miRNA 중 인간과 서열이 보존된 7개의 pre-miRNA 는 C2C12 근관에서 Atrogin-1 단백질을 유의하게 감소시켰다. 반대로 Atrogin-1 의 타겟으로 잘 알려진 eIF3f의 단백질의 발현은 증가시켰다. 인간 골격근모세포를 활용한 실험에서도 해당 miRNA에 의한 Atrogin-1 의 발현 억제를 확인하였다. 동화작용과 이화작용에 관련 있는 단백질의 발현을 확인한 결과, Atrogin-1 특이적으로 단백질 발현을 조절하는 것을 확인하였다. 그러나 Atrogin-1 전사체 수준의 현저한 변화는 관찰할 수 없었는데, 이는 Atrogin-1 단백질의 노화에 의한 발현 증가가 클러스터 내 miRNA에 의한 전사후 조절에 기인할 수 있다는 가설을 뒷받침한다.
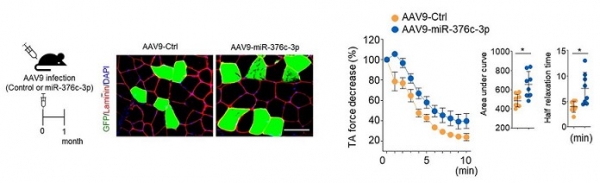
노화에 의한 근육감소를 극복하기 위한 Dlk1-Dio3 클러스터 내 miRNA의 치료 가능성을 조사하기 위해 본 연구팀은 myotube hypertrophy를 유도하는 데 가장 효과적인 miR-376c-3p를 선택하였다. 마우스에서 분리한 primary myoblast 및 인간 골격근모세포에 miR-376c-3p를 형질감염한 결과, Atrogin-1을 감소시켰고, 근육위축을 억제하는 세포 표현형을 확인하였다. Atrogin-1은 글루코코르티코이드를 처리한 근육에서 위축을 일으키는 주요 인자이므로 miR-376c-3p가 글루코코르티코이드로 유발된 근육 위축을 개선할 수 있는지 확인한 결과, 흥미롭게도 miR-376c-3p는 덱사메타손에 의해 유도된 근관 위축을 개선하는 것을 관찰하였다. miR-376c-3p가 생체 내에서 노화에 의한 근육 위축을 개선하는 효능을 검증하기 위해 23개월 된 노화 마우스의 근육에 AAV9-miR-376c-3p 아데노 바이러스를 감염시켰다. 4주 후 조직학적 및 기능적 분석을 통해 AAV9-miR-376c-3p에 감염된 근육이 대조군 바이러스에 감염된 반대쪽 근육에 비해 현저히 더 큰 단면적의 근섬유 표현형을 나타냈다. 세포 수준에서의 실험결과와 마찬가지로 miR-376c-3p는 Atrogin-1 단백질 발현을 특이적으로 억제한 반면 다른 구성 단백질의 발현 수준은 크게 변하지 않았다. miR-376c-3p를 과발현하는 근육이 개선된 기능을 나타내는지 확인하고자 본 연구팀은 바이러스를 감염시킨 근육 조직을 사용하여 ex vivo 등척성 힘을 측정하였다. miR-376c-3p 과발현 근육은 반대쪽 근육보다 통계적으로 유의하게 근육 기능과 피로도 회복이 개선된 것을 확인하였다. 위 결과를 종합해 보면, 본 연구팀의 결과는 miR-376c-3p가 근육 노화를 개선하기 위한 중요한 치료 표적이 될 수 있음을 시사한다 (그림 1).
그림 1. 노화 마우스 근육에 miR-376c 를 주입하면, 근육량 및 기능이 개선됨.
마우스에서 발견을 기반으로 본 연구팀은 젊고 나이 든 인간 골격근 검체에서 해당 클러스터의 miRNA의 발현 패턴을 조사하였다. 인간 Dlk1-Dio3 유전자 좌에는 99개의 mature miRNA가 포함되어 있으며 그 중 87개는 인간과 마우스 게놈 사이에 보존되어 있다. 인간 (25~80세 범위)의 골격근 조직 샘플 (n=20)에서 무작위로 선택한 15개의 pre-miRNA를 분석한 결과, 12개의 pre-miRNA는 유의하게 발현이 감소하였고 나머지 3개의 pre-miRNA은 노화 근육 샘플에서 감소하는 경향을 보였다. 마우스와 인간 모두에서 Dlk1-Dio3 클러스터 내 miRNA의 발현 패턴은 근육 노화에서 해당 miRNA 클러스터의 중요한 역할을 시사한다.
마우스, 토끼 및 인간의 다양한 근육 조직에서 Atrogin-1의 전사체 또는 단백질 발현에 대한 연구가 보고된 바 있으나 노화 근육에서 Atrogin-1을 조사한 연구결과는 주로 전사체 수준만을 기술하고 있다. 일부 논문에서 Atrogin-1 단백질 수준을 보고하였지만 검체 수의 부족 등의 문제로 인간의 노화에 의한 단백질 발현 수준은 여전히 알려진 바가 거의 없다. 본 연구팀은 노화 마우스에서 Dlk1-Dio3 클러스터 내 miRNA가 Atrogin-1의 발현을 직접 조절할 수 있음을 확인하였고, 인간 근육검체에서 역시 발현이 감소하며 Atrogin-1 단백질 발현을 조절함을 규명하였다 (그림 2).
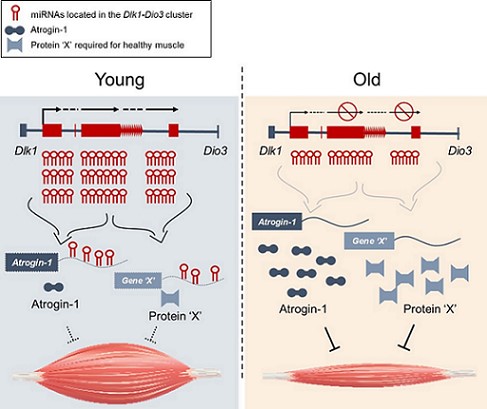
향후 본 연구팀은 어떻게 Dlk1-Dio3 유전자좌에 위치한 miRNA의 발현이 노화에 의해 감소되는지 그 조절 메커니즘을 규명하고자 한다. 유도 만능 줄기세포 (iPSC)의 재프로그래밍 동안 Dlk1-Dio3 의 miRNA가 DNA 메틸화 및 히스톤 탈아세틸화에 의해서 후성적으로 억제되는 것이 보고된 바 있기에, 인간과 마우스 근육에서 Dlk1-Dio3에 위치한 miRNA의 억제가 후성 유전 프로그램이나 다른 핵심 조절인자에 의해 조절되는지를 향후 조사하고자 한다. 결론적으로, 본 연구팀은 근관 비후에 가장 효과적인 miRNA 중 하나인 miR-376c-3p이 골격근의 Atrogin-1 단백질 함량을 조절하고 골격근 위축을 개선하며 노화 쥐의 근육 기능을 개선한다는 것을 발견하였다. 본 연구팀은 Atrogin-1 3’ UTR을 표적으로 하는 miR-376c-3p를 포함한 miRNA가 노화과정 동안에 근육 항상성을 유지하기 위한 치료법 개발에 유용한 후보가 될 것으로 생각한다.
원고를 마무리하면서 본 연구실에 대해서 간단히 소개를 하면, 한국생명공학연구원 노화제어전문연구단 단장이신 권은수, 권기선 박사를 중심으로 근육줄기세포 노화연구를 수행하는 이광표 박사, 혈액내 逆노화인자를 발굴 및 기능검증 연구를 담당하는 양용렬 박사 그리고 3명의 Post-doc, 10명의 석/박사과정이 하나가 되어 노화 연구를 하고 있다. 최근 국내외적으로 ‘노화’, ‘고령화’ 등의 키워드로 각광받고 있는 노화과학 연구분야를 같이 주도하고 싶은 열정 있는 연구자분들을 언제든 환영하기 때문에 관심있는 분들은 연락해 주셔도 좋습니다. 감사합니다.
참고문헌
1. Mitchell, W. K. et al. Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Frontiers in physiology 3, 260, doi:10.3389/fphys.2012.00260 (2012).
2. English, K. L. & Paddon-Jones, D. Protecting muscle mass and function in older adults during bed rest. Current opinion in clinical nutrition and metabolic care 13, 34-39, doi:10.1097/MCO.0b013e328333aa66 (2010).
3. Nair, K. S. Aging muscle. The American journal of clinical nutrition 81, 953-963, doi:10.1093/ajcn/81.5.953 (2005).
4. Morley, J. E., Anker, S. D. & von Haehling, S. Prevalence, incidence, and clinical impact of sarcopenia: facts, numbers, and epidemiology-update 2014. J Cachexia Sarcopenia Muscle 5, 253-259, doi:10.1007/s13539-014-0161-y (2014).
5. von Haehling, S., Morley, J. E. & Anker, S. D. An overview of sarcopenia: facts and numbers on prevalence and clinical impact. J Cachexia Sarcopenia Muscle 1, 129-133, doi:10.1007/s13539-010-0014-2 (2010).
6. Kim, T. N. & Choi, K. M. Sarcopenia: definition, epidemiology, and pathophysiology. J Bone Metab 20, 1-10, doi:10.11005/jbm.2013.20.1.1 (2013).
7. Anker, S. D., Morley, J. E. & von Haehling, S. Welcome to the ICD-10 code for sarcopenia. J Cachexia Sarcopenia Muscle 7, 512-514, doi:10.1002/jcsm.12147 (2016).
8. Ambros, V. The functions of animal microRNAs. Nature 431, 350-355, doi:10.1038/nature02871 (2004).
9. Kim, J. Y. et al. Genome-wide profiling of the microRNA-mRNA regulatory network in skeletal muscle with aging. Aging 6, 524-544, doi:10.18632/aging.100677 (2014).
10. Lee, K. P. et al. miR-431 promotes differentiation and regeneration of old skeletal muscle by targeting Smad4. Genes & development 29, 1605-1617, doi:10.1101/gad.263574.115 (2015).
11. Jung, H. J. et al. Comprehensive miRNA Profiling of Skeletal Muscle and Serum in Induced and Normal Mouse Muscle Atrophy During Aging. J Gerontol A Biol Sci Med Sci 72, 1483-1491, doi:10.1093/gerona/glx025 (2017).
12. Shin, Y. J. et al. A subset of microRNAs in the Dlk1-Dio3 cluster regulates age-associated muscle atrophy by targeting Atrogin-1. J Cachexia Sarcopenia Muscle 11, 1336-1350, doi:10.1002/jcsm.12578 (2020).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update