| “노화치료제(Senotherapeutics)” 발굴에 대한 최근 연구동향 소개 | |
|---|---|
| Date 2021-10-03 17:42:56 |
|

연구교수 / 교수
DGIST 뉴바이올로지 전공
hjcho.dr@dgist.ac.kr / lee.youngsam@dgist.ac.kr
1. 서론
작년에 발표된 통계청 보도에 따르면 지난해 우리나라의 65세 이상 고령인구가 전체 인구의 15.7%를 차지했다 [1]. UN은 65세 이상의 인구 비중이 14% 이상이면 고령사회, 20% 이상이면 초고령사회로 분류하는데 2017년 고령사회에 진입한 우리나라는 향후 3~4년 내 초고령사회로 진입할 것이라는 관측이 나오고 있다 [2]. 특히 지난 2018년 세계보건기구 (World Health Organization, WHO)에서 발간한 “국제질병분류 (International Classification of Disease)”에 그동안 “노쇠”(Code R54: Senility)로 분류되어오던 것에서 나아가 “노화”가 질병코드를 부여 받음 (Code MG2A: Old age) [3]에 따라 지금까지 막연하게 인식되어 오던 노화가 질환으로 인식될 수 있는 계기가 마련되었다. “불로장생”이라는 인간의 본능적인 바램이 “건강장수”라는 화두로 대변되는 현재, 생명과학 연구를 바탕으로 인류의 영속성에 기여하고 이를 통해 우리 사회가 직면하고 있는 초고령사회로의 진입에 따른 사회·경제적 문제를 해결할 수 있는 실마리를 제공하고자 하는 노력의 일환으로 항노화를 넘어 역노화를 목표로 하는 “노화치료제 (Senotherapeutics)”(노화 치료 및 노화 관련 질병과 관련된 세포 노화를 구체적, 선택적으로 표적하는 치료제) 발굴에 대한 최근 연구동향을 소개하고자 한다.
2. 칼로리 제한을 통한 수명연장의 분자기전 조절 소분자
“적게 먹으면 오래 산다”라는 속설을 뒷받침하는 동물 (rat) 실험 결과가 논문으로 처음 발표된 [4] 20세기 초반 이후, 다양한 동물 모델 (초파리, 예쁜꼬마선충, 마우스, 영장류 등)에서 음식물 섭취를 제한하거나 포도당과 같은 에너지원 공급 제한에 따른 수명연장 효과를 확인한 (성장 정도와는 별개로 함) 결과가 보고되어 왔다. 이와 같은 칼로리 제한과 수명연장의 연관성을 분자적 수준에서 설명하려는 노력이 진행되는 과정에서 주목할 연구결과가 1993년 Nature에 발표되었다 [5]. 예쁜꼬마선충이 daf-2 유전자 (인슐린/IGF-1 수용체) 돌연변이에 의해 개체수명이 2배 이상 증가될 수 있으며, 이와 같은 수명연장 효과는 daf-2로부터 시작되는 신호전달체계 하위에 있는 전사인자 daf-16 유전자를 통해 나타난다는 결과로, 이 결과를 시작으로 많은 연구 결과를 종합하여 여러 동물 종에서 진화적으로 보존되어 있는 섭식/에너지대사와 연관된 수명 연장의 분자기전 (그림 1) [6]이 밝혀졌다.
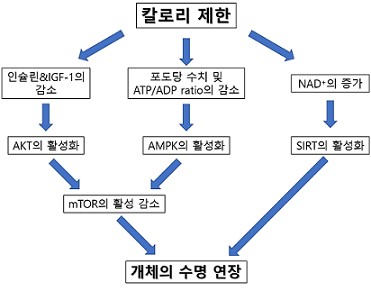
그림 1. 칼로리 제한을 통한 수명연장의 분자기전.
최근 수명연장의 분자기전에 관여하는 단백질을 타겟으로하는 소분자를 이용하여 세포의 노화표현형 개선 및 개체의 수명 연장여부를 검증하려는 연구가 활발히 진행되고 있다. 대표적인 예로 메트포르민 (Metformin)과 라파마이신 (Rapamycin)을 들 수 있다. 메트포르민은 바이구아니드계 (biguanides) 경구용 당뇨병 치료제로, 유럽에서 구전되어오던 식물인 프렌치 라일락 (Galega officinalis)에 함유된 바이구아니드계 화합물에서 아이디어를 얻어 1920년대 합성 개발되었다. 메트포르민은 AMPK (AMP-activated protein kinase)를 활성화시켜 간에서의 포도당의 생합성을 막고, PKA (Protein kinase A) 활성을 저해시킴으로서 글루카곤 (glucagon)에 의한 cAMP (cyclic AMP) 생산 저해를 통해 공복기 포도당 수치를 감소시키는 것으로 알려져 있다 [7]. 라파마이신 (동명으로 시롤리무스 (Sirolimus))은 장기 이식 시 사용되는 면역억제제로 영국 이스터 섬의 토양 세균 (Streptomyces hygroscopicus)에서 발견된 매크로라이드계 (Macrolide) 화합물이다. 라파마이신은 FKBP12 (FK506-binding protein)와의 결합을 통해 mTOR 활성을 억제하고 이로 인해 IL-2 (Interleukin-2) 등 사이토카인 (cytokine) 수용체로부터의 신호전달을 억제시켜 면역세포의 활성화를 차단하는 것으로 알려져 있다 (mTOR 억제의 면역 조절 기능 (http://www.nature.com/nri/index.html)). 이들 화합물의 작용점이 수명연장의 분자기전과 밀접한 연관성이 있기 때문에 이들의 주된 표적 질환과 함께 메트포르민과 라파마이신에 의한 세포 노화의 개선 및 개체의 수명연장 효과에 관한 많은 연구가 진행되고 있으며 현재 노화 연관 임상시험 (메트포르민 노화 임상연구: The Targeting Aging (with) Metformin (TAME) Trial [8], 라파마이신 노화 임상 연구: Participatory Evaluation (of) Aging (with) Rapamycin (for) Longevity Study (PEARL) [9])도 진행 혹은 예정되어 있다.
수명연장의 분자기전과 관련하여 주목을 받고 있는 또 다른 단백질은 Sirtuin 1 (Silent mating type information regulation 2 homolog 1; SIRT1)이다. Sirtuin은 NAD (니코틴아마이드 아데닌 다이뉴클레오타이드, nicotinamide adenine dinucleotide)를 조효소로 하여 기질로부터 아세틸 작용기를 제거하는 탈아세틸화 효소 (NAD-dependent deacetylase)이다. Sirtuin의 발현 증가에 의한 인슐린 감수성 향상과 더불어 Sirtuin의 효소활성 증가에 따라 자식 작용 (Autophagy, 오토파지) 연관 단백질의 탈아세틸화가 일어남으로써 자식작용 활성이 증가되어 수명 연장이 될 수 있다는 실험적 근거가 제시되고 있다 [10]. 이와 더불어 폴리페놀계 식물 추출물 resveratrol 및 합성화합물 SRT-1720 등 SIRT 활성화제 (activator)에 의한 개체의 수명연장 효과에 대한 연구도 진행되고 있다 [11]. 다만 아직까지 인간을 포함하는 척추동물에서의 SIRT1 및 SIRT 활성화제와 연관된 수명 연장 효과는 상반된 결과들로 인해 결론을 내리기에 다소 이르다.
Sirtuin과 연관된 NAD는 역노화 및 수명연장 관점에서 최근 부각되고 있는 물질이다. 칼로리 제한과 연관된 에너지 부족 상황에서 NAD 증가가 진행될 뿐만 아니라 노화에 따른 생체 내 NAD 감소 경향에 착안하여 NAD 생합성에 관여하는 니코틴아마이드 리보사이드 (nicotinamide riboside, NR)나 니코틴아마이드 모노뉴클레오타이드 (nicotinamide mononucleotide, NMN) 등의 NAD 전구물질 (precursor)의 투여나 NAD 분해나 과소비에 관여하는 효소의 활성 억제를 통해 생체 내 NAD 농도를 증가시키는 “NAD booster” 전략 [12]이 수명연장과 관련한 분자기전 조절 측면에서 새롭게 부각되고 있다.
3. 노화세포의 회복 유도 소분자 (Senomorphics)
2013년 Cell의 리뷰논문 – Hallmarks of Aging [13]에서는 노화의 세포분자생물학적 특징으로 유전정보의 손상, 텔로미어의 소실, DNA 메틸화 및 히스톤 변성 등의 후성유적학적 변화, 단백질의 합성과 분해의 조절 이상, 영양성분의 탐지 및 신호전달 이상, 미토콘드리아의 기능저하, 세포의 노화, 줄기세포의 감소, 세포사이의 신호전달의 변화를 제시했다. 이 가운데 노화세포는 나이가 듦에 따라 세포의 분열 및 성장 능력이 저하되는 세포로 이들의 증가는 생체 기능 저하와 노인성 질환의 원인으로 작용한다. 노화세포의 비가역성, 다시 말해 노화세포가 다시 젊은 상태의 표현형으로 돌아갈 수 없다는 패러다임이 최근 들어 가역적으로 회복시킬 수 있다는 연구 결과가 속속 보고되고 있으며, 이를 유도하는 소분자를 “Senomorphics”[14] (Senescence (생물학적 노화) + polymorphism (다형성)의 합성어)로 부르고 있다.
구체적인 senomorphics의 예로, 본 저자가 수행한 세포소기관의 기능개선을 통한 역노화 유도 가능성의 연구결과를 소개하고자 한다. 세포 내 단백질, 지질 등과 같은 생체 고분자를 분해하고 자식작용을 담당하는 세포 내 소기관인 리소좀의 기능 저하는 세포 내에서 제거돼야 할 생체 고분자를 축적하고, 제 기능을 수행하지 못하는 미토콘드리아의 불완전한 제거 등 물질 대사의 불안정성을 야기해 세포 노화를 유발한다. 또한 세포 내 에너지 및 물질 대사에 핵심적 역할을 담당하고 있는 세포 내 소기관인 미토콘드리아의 기능 저하는 활성산소의 증가, 에너지 생성의 효율성 저하 등에 의해 세포의 노화를 유발하는 원인으로 지목되고 있다. 본 저자는 노화세포에서 이들 세포소기관의 저하된 기능을 향상시킬 수 있는 약물을 발굴하고 이들을 노화세포 모델 및 노화동물 모델에 적용함으로써 노화표현형이 개선되는 효과를 보고하였다 [15,16]. 이와 같이 세포의 생리활성 유지와 밀접하게 연관되어있는 리소좀, 미토콘드리아 등 세포소기관의 기능 회복을 통해 노화세포의 역노화를 유도하고자 하는 노력뿐만 아니라 노화세포의 유전자의 항상성을 유지하고 세포주기를 복구시킴으로써 세포가 갖고 있는 증식능력을 극대화시켜 세포의 고유한 성질이 유지되면서 제 역할을 수행할 수 있도록 하는 방안 [17]들도 함께 제안되고 있다.
4. 노화세포의 선택적 사멸 유도 소분자 (Senolytics)
2011년 마우스 모델에서 노화세포의 선택적 제거가 가능하도록 유전자변형을 도입한 뒤 노화세포 사멸에 따른 마우스의 노화연관 질병의 개선 효과가 소개된 [18] 이후, 정상세포 대비 노화세포의 특징을 파악하고 이를 이용하여 노화 세포의 선택적 사멸을 유도하여 역노화 및 노화질환을 치료하고자 하는 전략이 주목받고 있다. 이를 유도하는 소분자는 앞에서 언급한 senomorphics과는 차별화하여 “Senolytics” [19] (Senescence (생물학적노화) + Lysis (세포의 용해)의 합성어)로 구분한다.
Senolytics 개발측면에서 정상세포 대비 노화세포의 특징 중 먼저 주목받은 것은 노화세포의 반응성 약화이다. 노화세포는 세포성장인자나 세포사멸인자에 대한 감수성이 떨어져 있어 이러한 인자들을 노화세포에 처리 시 정상세포 대비 성장이나 사멸이 신속하게 진행되지 않는다. 뿐만 아니라, 노화세포는 자기사멸방어기작 (anti-apoptotic pathway)이 정상세포에 비해 활성화되어 있는 특징이 있어 지난 2015년도 Mayo Clinic 연구 그룹에서는 이점에 착안하여 Dasatinib (Tyrosine kinase inhibitor 중 하나로 만성 골수성 백혈병 (CML)과 급성 림프 구성 백혈병 (ALL)의 치료제로 사용됨) 과 Quercetin (식물성 플라보노이드로 PI3K/AKT 경로를 억제함)의 병용처리 시 세포자기사멸방어 관련 단백질 (antiapoptotic factor)의 양적 감소를 통해 노화세포의 선택적 사멸이 유도됨을 보여주었다 [19]. 이후 세포자기사멸유도를 기반으로 개발된 항암제를 대상으로 노화세포의 선택적 사멸 유도 효과가 있는 소분자를 발굴하고자 하는 시도를 통해 Navitoclax (ABT263) [20]나 여러 PI3K/AKT 저해제들 [21]의 senolytic 효과를 세포 및 동물 실험에서 확인하였다. 본 저자의 연구실에서도 최근 SYK inhibitor 중 하나인 Tamatinib (R406)의 senolytic 효과를 보고한 바가 있다 [22]. 이밖에 p53 단백질에 의한 세포자기사멸유도 효과를 상승 시킬 수 있는 UBX0101 (MDM2 inhibitor) [23]나 peptide drug [24] 등도 개발되었다.
세포자기사멸 연관 이외의 senolytics 개발 전략으로는 정상세포 대비 노화세포에서 특이적으로 발현하는 세포막 단백질을 동정하고 이를 인지하는 항체를 기반으로 면역세포에 의한 선택적 세포용해를 유도 (antibody-dependent cellular cytotoxicity)하는 방법 [25] 혹은 노화세포의 생리활성 유지에 필수적인 대사 경로를 규명하고 이를 차단함으로서 선택적인 노화세포사멸을 유도하는 방법 [26] 등을 들 수 있다.
5. 맺음말
본문에 소개된 노화치료제 발굴을 위한 연구 전략에 이외에도 노화의 여러 세포분자생물학적 특징 역시 노화치료제 발굴을 위한 표적기전으로 고려되고 있다. 예를 들어, 예전부터 관심을 받은 항산화제나 텔로미어의 신장을 유도하는 소분자의 개발뿐만 아니라 단백질 항상성 [27]이나 후성유전학적 변화 [28]를 조절함으로써 노화를 극복하려는 시도들도 보고되고 있다. 또한 최근 주목을 받고 있는 유전체, 단백체, 대사체, 지질체 분석 등과 같은 시스템스 생물학 연구기법을 활용하여 노화에 따른 전신순환인자나 장내미생물의 구성 변화를 분석 [29]함으로써 생체 유래 노화회복 혹은 노화억제 인자를 발굴하려는 노력이 활발히 진행되고 있다.
현재까지는 메트포르민이나 라파마이신 등 예전부터 노화 회복이 아닌 원래의 적용증을 대상으로 사용되어오던, 따라서 어느 정도 독성에 대한 검증 결과가 확보된 소수의 약물들만이 수명연장이나 노화연관 질환의 치료를 검증하는 임상시험 대상 물질이 되고 있다. 하지만 명확한 분자기전을 바탕으로 최소한의 부작용과 우수한 효과를 갖는 노화치료제 후보의 발굴 시도가 계속된다면 노화 극복에 한 걸음 다가설 수 있는 약물로 활용될 수 있으리라 기대한다.
(본 기고는 아래 연구과제의 지원을 받아 작성되었습니다.)
NRF-2020R1A2C2013416 (이영삼)
NRF-2019R1I1A1A01058142 (조현지)
참고문헌
1. http://kostat.go.kr/portal/korea/kor_nw/1/1/index.board?bmode=read&aSeq=385322
2. https://yonhapnewstv.co.kr/news/MYH20210806011000641
3. https://www.thelancet.com/pdfs/journals/landia/PIIS2213-8587(18)30214-6.pdf
4. J Nutr, 10:63-79 (1935). https://doi.org/10.1093/jn/10.1.63
5. Nature, 366:461-464 (1993). https://doi.org/10.1038/366461a0
6. Aging (Albany NY), 4:525-534 (2012). https://doi.org/10.18632/aging.100481
7. Diabetologia, 60:1577-1585 (2017). https://doi.org/10.1007/s00125-017-4342-z
8. https://www.afar.org/tame-trial
9. https://clinicaltrials.gov/ct2/show/NCT04488601
10. Int J Biol Macromol, 117:225-234 (2018). https://doi.org/10.1016/j.ijbiomac.2018.05.174
11. 천연물로부터 sirtuin 활성화 물질의 탐색과 노화세포에서 작용기전 연구 (https://scienceon.kisti.re.kr/srch/selectPORSrchReport.do?cn=TRKO201200003420), Trends Pharmacol Sci, 35:146-154 (2014). https://doi.org/10.1016/j.tips.2013.12.004
12. 노화방지...새로운 NAD booster 개발 (http://www.bosa.co.kr/news/articleView.html?idxno=2093068)
13. Cell, 153:1194-1217 (2013). https://doi.org/10.1016/j.cell.2013.05.039
14. Nat Commun, 8:422 (2017). https://doi.org/10.1038/s41467-017-00314-z
15. KU-60019, Nat Chem Biol, 13:616-623 (2017). https://doi.org/10.1038/nchembio.2342
16. Y-27632, Aging Cell, 16:541-550 (2017). https://doi.org/10.1111/acel.12584
17. Nat Commun, 9:2834 (2018). https://doi.org/10.1038/s41467-018-05258-6
18. Nature, 479:232-236 (2011). https://doi.org/10.1038/nature10600
19. Aging Cell, 14:644-658 (2015). https://doi.org/10.1111/acel.12344
20. Nat Med, 22:78-83 (2016). https://doi.org/10.1038/nm.4010
21. Ther Adv Chronic Dis. 11:2040622320964125 (2020). https://doi.org/10.1177/2040622320964125
22. Aging (Albany NY), 12:8221-8240 (2020). https://doi.org/10.18632/aging.103135
23. Nat Med, 23:775-781 (2017). https://doi.org/10.1038/nm.4324
24. Cell, 169:132-147 (2017). https://doi.org/10.1016/j.cell.2017.02.031
25. Genes Dev, 31:1529-1534 (2017). https://doi.org/10.1101/gad.302570.117
26. Science, 371:265-270 (2021). https://doi.org/10.1126/science.abb5916
27. Aging Cell, 19:e13117 (2020). https://doi.org/10.1111/acel.13117
28. Aging (Albany NY), 10:3590-3609 (2018). https://doi.org/10.18632/aging.101617
29. Nat Cell Biol, 21:32-43 (2019). https://doi.org/10.1038/s41556-018-0206-052 2021
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
