| 기능성 생체소재 기반의 면역항암치료 기술 개발 | |
|---|---|
| Date 2021-10-03 18:45:19 |
|

교수
이화여자대학교 화학신소재공학과
kijoo@ewha.ac.kr
1. 서론
우리 몸의 면역체계를 조절하여 면역세포를 활성화함으로써 암세포의 성장을 억제하거나 파괴하여 치료 효과를 높이는 면역항암치료 (cancer immunotherapy)가 다양한 종류의 암 치료 임상연구에서 좋은 결과를 보이며 현재 선진적인 암 치료법으로 각광을 받고 있다 [1,2]. 특히, 현재 항체 기반의 면역항암제 관련 임상시험만 3,600여 건에 이를 정도로 차세대 핵심 치료법으로 자리를 잡아가고 있다 [3]. 기존의 항암약물과 방사선 기반의 암 치료요법은 암세포뿐만 아니라 정상조직과 정상세포도 함께 사멸시키기 때문에 치료 기간 동안 환자에게 심각한 부작용을 야기하는 문제점이 있다. 하지만 면역항암치료요법은 면역세포의 기능을 조절하여 암세포를 인지하고 공격하기 때문에 부작용을 줄이고 치료 효과를 높이는 장점을 가지고 있다 [4-6]. 대표적인 면역항암 치료에는 효과적인 항원 전달을 통해 암세포 특이적 면역반응을 유도하는 항암백신치료 (cancer vaccine therapy) [7,8], 환자의 면역세포를 수집하여 암세포 특이적 세포독성 T 세포로 활성화하거나 자연살해 (NK) 세포 기반의 면역세포치료 (immune cell therapy) [9,10], 그리고 암세포의 면역억제 기작을 차단하여 T 세포의 활성을 높여주어 암을 공격하는 항체 기반의 면역억제 차단 치료 (immune checkpoint blockade therapy) [11,12]로 구분된다. 현재 미국 식품의약국 (FDA)으로부터 승인된 면역항암 치료제는 흑색종 (melanoma), 신세포암 (renal carcinoma), 비소세포폐암 (non-small lung cancer), 호지킨 림프종 (Hodgkin’s lymphoma), 두경부암, 혈액암 등 다양한 암 치료에 사용이 되고 있다 [13]. 하지만 이와 같은 면역항암치료의 큰 발전에도 불구하고, 면역치료제를 환자에게 지속적으로 투여함으로 인해 발생하는 비특이적 반응 (offtargeting effect)과 과도한 면역반응 (over-activation)을 유발하여 자가면역질환 (autoimmune disorder)을 일으키는 문제점이 있다 [14]. 또한, 암 환자마다 치료 효과가 크게 다르고, 고형암에서는 치료 효과가 혈액암에 비해 현저히 떨어진다는 한계를 가지고 있다 [15].
약물 및 유전자 전달, 그리고 조직공학에서 광범위하게 개발되었던 나노입자, 하이드로젤, 다공성 지지체 (scaffold) 등 기능성 생체소재 기술을 바탕으로 최근 기존 면역항암치료의 한계점들을 극복하기 위한 많은 연구들이 진행되고 있다. 기능성 단백질, 고분자, 다당류 등 생체친화성을 갖는 다양한 생체소재를 기반으로 면역세포 활성을 치료부위에 국한하는 국소적 약물 제어 방출 (controlled release) 및 표적 전달 (targeted delivery)을 통해서 면역항암치료의 부작용을 낮추고 암세포 특이적 면역반응을 강화하여 치료 효율을 높이는 시도가 증가하고 있다. 본 기고문에서는 기능성 생체소재를 면역관문 차단치료 및 면역세포치료에 적용하여 면역항암치료 효율을 높이는 최근 연구 동향을 살펴보고자 한다.
2. 본론
2.1. 면역항암치료의 핵심 전략
우리 몸의 면역체계는 암세포와 같은 항원을 인지하고 대응하는 방어기전을 통해 우리 몸을 지키는 역할을 한다. 성공적으로 면역 반응을 유도하여 항암 치료를 하기 위해서는 다음과 같은 핵심적인 단계가 필요하다. 먼저, 1) 암세포 항원이 수지상세포 (dendritic cell)와 같은 항원제시세포 (antigen presenting cell, APC)에 의해 효과적으로 인식되고 처리되어 주조직 적합성 복합성 (major histocompatibility complex, MHC)에 제시되어야 한다. 2) 또한, 암세포 항원을 세포 표면에 표시한 활성화된 수지상세포는 림프절로 이동하여 미성숙 T 세포 (naive T cell)를 효율적으로 암세포 특이적 T 세포로 활성화 시켜야 한다. 3) 이처럼 활성화된 암세포 특이적 T 세포는 면역억제 (immunosuppressive) 환경인 종양 부위에서 효과적으로 암을 인지하고 공격할 때에 성공적으로 암을 사멸시킬 수 있다. 이와 같이 각 핵심 단계에서 면역반응을 강화하고 문제점들을 극복하기 위해 기능성 생체소재를 적용하거나 면역세포를 바이오공학적으로 설계하는 연구가 활발히 진행되고 있다 (그림 1).
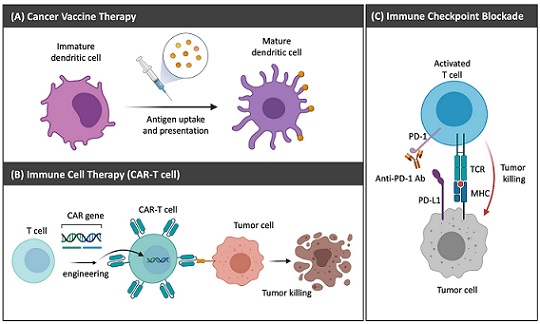
그림 1. 대표적인 면역항암치료 기술. (A) 효과적인 항원 전달을 통해 암세포 특이적 면역반응을 유도하는 항암백신치료 (B) 환자의 T 세포를 수집하여 암세포 특이적 T 세포로 활성화하고 환자에게 재투여하는 면역세포치료 (C) 암세포의 면역억제 기작을 차단하여 T 세포의 활성을 높여주는 항체 기반의 면역억제 차단 치료 기술.
2.2. 기능성 생체소재 기반의 면역관문억제제 전달 기술
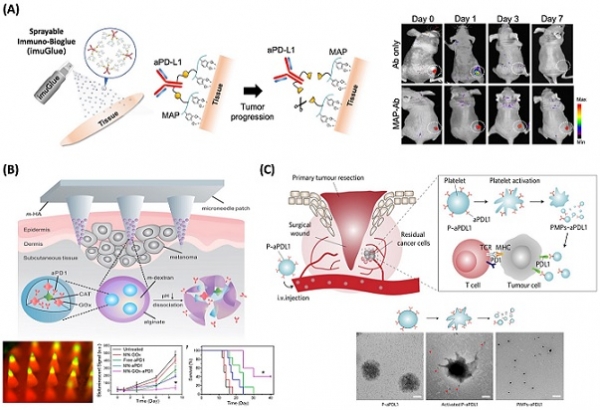
종양 미세환경에는 PD-L1 (programmed death-ligand 1)과 같은 면역 억제 분자들이 발현 되어 있을 뿐만 아니라, 암세포로부터 PD-L1이 발현된 엑소좀을 분비해 활성화된 세포독성 T 세포를 무력화 시킨다는 것이 알려져 있다. 또한, PD-1 (programmed death 1), CTLA-4 (cytotoxic T lymphocyte antigen 4) 등의 면역관문 단백질을 이용하여 면역세포 감지 기능을 무너뜨린다. 이와 같은 암세포의 면역억제 기작을 차단하기 위해서 항체 기반의 면역관문억제제로 nivolumab, pembrolizumab, atezolizumab 등이 상용화되어 현재 임상에서 활발히 사용되고 있지만, 정맥주사를 통해 온몸에 지속적인 항체를 투여하는 기존 치료법은 정상세포, 조직에 비특이적 면역반응으로 피해를 유발하고, 또한 다량의 항체의 방출로 인해서 자가면역질환이 발생하는 문제점이 있다. 또한, 국소 치료를 위해 항체를 표적 부위에 투여하여도 혈액 등에 의해 대부분의 항체가 표적 부위 밖으로 흘러나가게 되어 효과적인 치료 효능을 얻기 어렵다. 이를 위해 기능성 접착단백질 소재를 이용하여 수분이 많은 체내 환경에서도 표적 부위에 항체를 장기간 머물 수 있게 하고, 암세포가 있는 환경에서 선택적으로 반응하여 항체를 방출함으로써 치료 효과를 높이고 전신 부작용을 현저히 낮추는 기능성 생체소재 기반의 국소적 면역관문억제제 전달 기술이 개발되었다 (그림 2A) [16]. 또한, anti-PD-1 항체를 탑재한 나노입자가 포함된 기능성 마이크로니들 (microneedle) 패치를 이용하여 흑색종의 면역치료에 뛰어난 효능이 있음을 입증했다 (그림 2B) [17]. 국소적 전달뿐만 아니라 표적 면역치료 기술도 개발되고 있다. 혈관 손상 부위로 빠르게 이동하고 순환하는 암 세포를 인식할 수 있는 혈소판 (platelets)의 고유한 특성을 이용하여 암 제거 수술 후 재발을 예방하는 치료에 적용이 되었고 유방암과 흑생종 동물모델 기반 평가를 통해 뛰어난 면역항암치료 효과가 있음을 보고하였다 (그림 2C) [18].
그림 2. 기능성 생체소재 기반의 면역관문억제제 전달 기술. (A) 국소적 면역관문억제제 전달 플랫폼 imuGlue [16]. (B) 면역관문억제제 항체 탑재한 나노입자가 포함된 마이크로니들 패치 [17]. (C) 혈소판의 고유한 특성을 이용한 면역관문억제제 항체 전달 플랫폼 기술 [18].
2.3. 기능성 생체소재 기반의 항암백신 및 면역세포 치료 기술
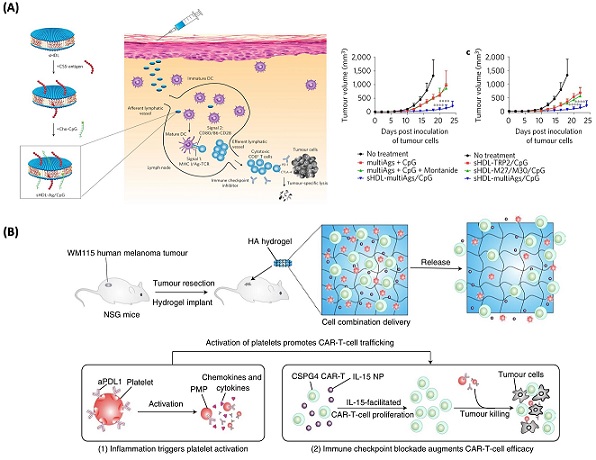
항암백신치료는 암세포 특이적 항원을 암환자에게 투여하여 항암 면역 기능을 활성화시켜 암을 제거하는 면역치료법이다. 전립선 암 치료 백신으로 sipuleucel-T가 상용화 되어 임상에 사용되고 있으며, 현재 많은 연구들이 다양한 항암백신 개발을 위해 진행 중에 있다. 성공적인 항암백신치료를 위해서는 암세포 특이적 항원과 보조제 (adjuvants)가 항원제시세포 중 하나인 수지상세포로 효과적으로 전달이 되어야 한다. 수지상세포는 T 세포와 B 세포를 조절하는 중심 면역세포로 암세포와 같은 항원을 인지하고 면역반응을 유도하는 방어기전에 중요한 역할을 맡고 있다. 항암백신 치료 효율을 높이기 위해 합성 고밀도지단백질 (high density lipoprotein, HDL) 기반의 기능성 나노디스크를 전달체로 이용하여 암 특이적 항원과 보조제를 수지상세포에 효과적으로 동시에 전달하였고, 결과적으로 대장암과 흑색종 면역치료에 좋은 효과가 있음이 보고되었다 (그림 3A) [19].
또한, 면역세포를 이용한 면역항암치료 기술개발이 활발히 진행되고 있다. 환자의 T 세포를 암세포 특이적 T 세포로 활성화하고 이를 환자에게 재투여하는 CAR-T 면역세포치료가 매우 우수한 치료 효과를 보였다. 히알루론산 기반의 하이드로젤에 CAR-T 세포와 anti-PD-L1 항체를 탑재하여 고형암에도 뛰어난 치료 효과가 있음을 보였다 (그림 3B) [20]. 또한, 세포독성 T 세포와 역할은 비슷하지만 면역거부반응이 적고 다른 건강한 사람의 세포를 환자에게 이식 가능한 NK 세포는 차세대 면역세포치료제로 자리를 잡아가고 있다.
3. 결론 및 전망
글로벌 의약품 시장에서 면역항암치료제가 2024년에는 500억 달러(한화 약 57조원)에 이를 것으로 전망되며 신약 연구개발의 차세대 핵심 분야로 자리 잡고 있다. 기존의 항암 치료법에 비해 높은 치료 효과와 비교적 낮은 부작용을 보이지만 면역반응의 전신 부작용은 환자에게 큰 위험을 초래할 수 있다. 그렇기에 면역항암치료 부작용을 최소화하고 치료 효과를 극대화 하기 위해 최근 생체소재를 이용한 면역치료 연구가 급증하고 있다. 고기능성 스마트 생체소재 개발에 많은 기초/응용 연구가 필요할 것으로 보이며 의공학, 면역학, 의학, 약학 등의 융합 연구와 제약 및 바이오 산업체와의 긴밀한 산학 협력을 통한 차세대 면역항암치료제 개발이 중요한 때이다. 이를 통해 난치성 암 정복에 한발 더 다가갈 수 있는 발판을 마련할 것으로 예상한다.
참고문헌
[1] D.N. Khalil, et. al., The future of cancer treatment: immunomodulation, CARsand combination immunotherapy, Nat. Rev. Clin. Oncol. 13 (2016) 273.
[2] Daniel S. Chen, et. al., Oncology meets immunology: the cancer-immunity cycle, Immunity 39(1) (2013)1-10.
[3] S. Upadhaya, et. al., Combinations take centre stage in PD1/PDL1 inhibitor clinical trials, Nat. Rev. Drug Discov. 20 (2021) 168-169.
[4] A.D. Waldman, et. al., A guide to cancer immunotherapy: from T cell basic science to clinicalpractice, Nat. Rev. Immunol. 20(11) (2020) 651-668.
[5] J.M. Mjösberg, et. al., Human IL-25- and IL-33-responsive type 2 innate lymphoid cells are definedby expression of CRTH2 and CD161, Nat. Immunol. 12(11) (2011) 1055-62.
[6] J.B.Swann, et. al., Immune surveillance of tumors, J. Clin. Invest. 117(5)(2007) 1137-46.
[7] I. Melero, G. et. al., Therapeutic vaccines for cancer: anoverview of clinical trials, Nat. Rev. Clin. Oncol. 11(9) (2014) 509-24.
[8] S.A.Rosenberg, et. al., Cancer immunotherapy: moving beyond currentvaccines, Nat. Med. 10(9) (2004) 909-15.
[9] A.D. Fesnak, et. al., Engineered T cells: the promise and challenges of cancer immunotherapy, Nat.Rev. Cancer 16(9) (2016) 566-581.
[10] C.H. June, et. al., CAR T cell immunotherapy for human cancer,Science 359(6382) (2018) 1361-1365.
[11] D.M. Pardoll, The blockade of immunecheckpoints in cancer immunotherapy, Nat. Rev. Cancer 12 (2012) 252.
[12] S.C. Wei, et. al., Fundamental mechanisms of immune checkpoint blockade therapy, Cancer Discov. 8(2018) 1069-1086.
[13] F. Teng, et. al., Progress and challenges of predictive biomarkers of anti PD-1/PD-L1immunotherapy: A systematic review, Cancer Lett. 414 (2018) 166-173.
[14] L. Milling, et. al., Deliveringsafer immunotherapies for cancer, Adv. Drug Deliv. Rev. 114 (2017) 79-101.
[15] J.S. Weber, et. al., Management of immune-related adverse events and kinetics of response withipilimumab, J. Clin. Oncol. 30(21) (2012) 2691-2697.
[16] K.I.Joo, et. al., Harnessing the bioresponsive adhesion of immuno-bioglue for enhanced localimmune checkpoint blockade therapy, Biomaterials 263 (2020) 120380.
[17] C. Wang, et. al., Enhanced cancer immunotherapy by microneedle patch-assisteddelivery of anti-PD1 antibody, Nano Lett. 16(4) (2016) 2334-2340.
[18] C. Wang, et. al., In situ activation of platelets with checkpoint inhibitors forpost-surgical cancer immunotherapy, Nat. Biomed. Eng. 1(2) (2017) 0011.
[19] R. Kuai, et. al., Designer vaccine nanodiscs for personalized cancer immunotherapy, Nat. Mater. 16(4) (2017) 489-496.
[20] Q. Hu, et. al., Inhibition of post-surgery tumour recurrence via a hydrogel releasing CAR-T cells and anti-PDL1-conjugated platelets. Nat. Biomed. Eng. (2021) in press
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update