| 미세조류 기름을 이용한 중쇄지방산 및 그 유도체의 생물학적 생산 | |
|---|---|
| Date 2022-04-08 22:43:05 |
|

교수 / 교수
국민대학교 바이오발효융합학과 / 이화여자대학교 식품생명공학과
joohyunseo@kookmin.ac.kr / jbpark06@ewha.ac.kr
1. Biomass 유래 지질의 활용
지질과 지방산은 지방족 화합물의 원료로서 많이 이용되고 있으며, 지질과 지방산을 활용하여 여러 가지 다양한 화합물과 중간체를 만들 수 있다 [1]. 이러한 예로는, 고분자, 레진, 접착제, 코팅제, 부식방지제, 윤활제, 가소제, 향수 등이 있다. 자연계에서 얻을 수 있는 지방산은 탄소 16개 혹은 18개짜리 지방산이 대부분이다. 이에 해당하는 것이 팔미트산(palmitic acid), 스테아르산(stearic acid), 올레산(oleic acid), 리놀레산 (linoleic acid) 등이다 (그림 1).
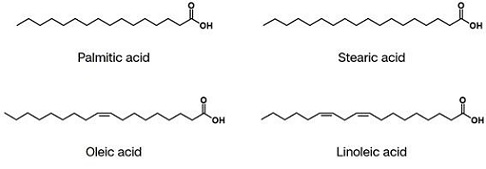
이러한 지방산은 포화지방산(팔미트산, 스테아릭산 등)과 불포화지방산(올레산, 리놀레산 등)으로 나눌 수 있다. 이 중, 포화지방산의 경우, 카르복시기를 제외하면 탄소와 수소로만 구성되어 있다. 따라서, 탄소-탄소 결합과 탄소-수소 결합만 존재하게 된다. 이러한 탄소-탄소 결합, 탄소-수소 결합은 자르기도 매우 어렵고, 활성화(activation of C-H bond for functionalization)시키기도 어렵다. 반면에, 불포화지방산의 경우, 이중결합이 존재(올레산의 경우 9번 탄소와 10번 탄소 사이)하는데, 이 이중결합이 지방산 사슬을 끊을 수 있는 중요한 역할을 하게 된다. 탄소-탄소 결합은 끊기가 매우 어렵지만, 만약 탄소에 산소가 하나 붙게 되면 여러 가지 다양한 화학반응을 통해 탄소-탄소 결합을 끊어낼 수 있다. 그러나, 분자를 자른 후 양쪽 말단이 –CH3가 되는 것은 아니고, 산소가 붙은 형태, 즉 –OH나 –COOH 기 등으로 만들어진다. 이러한 일련의 반응은, 불포화지방산에 존재하는 이중결합에 물이 첨가되면서 시작된다. 물이 첨가되어 C=C 그룹이 –C(OH)-CH2– 으로 바뀌고 난 후, 하이드록시기가 더욱 산화되면서, 최종적으로 탄소-탄소 사이에 산소가 끼워진 형태, 즉 탄소-산소-탄소의 원자배열(여기서는 에스터)이 만들어지게 된다 (그림 2).

그림 2. 하이드록시기로부터의 일련의 산화반응. 가장 마지막 반응은 Baeyer-Villiger oxidation이다.
이러한 일련의 산화반응은 효소를 이용하여 구현할 수 있는데, 이는 oleate hydratase, secondary alcohol dehydrogenase, Baeyer-Villiger monooxygenase를 활용한다 (그림 3) [1,2].
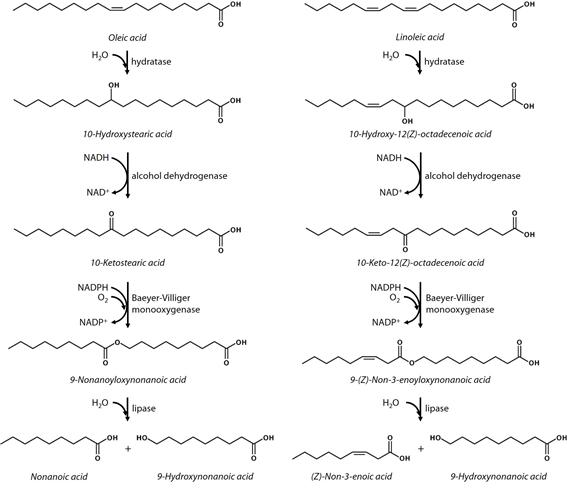
그림 3. 올레산, 리놀레산 등과 같은 불포화지방산의 이중결합에 하이드록시기를 만든 후, 에스터 형태로 변환하기까지의 효소반응 단계. 에스터가 만들어지면, lipase를 이용하여 에스터를 가수분해할 수 있고, 그 결과로 중쇄지방산과 그 유도체가 동시에 생성된다.
2. 미세조류 기름 가수분해물을 이용한 중쇄지방산 생산
미세조류는 높은 오일 함량과 경작지(육상 및 해상의 양식장 등)가 아닌 곳에서 배양할 수 있는 등의 장점 때문에 바이오매스 공급원으로서 많은 관심을 받아왔다 [3]. 콩기름 등과 같은 다른 생물체 유래 기름들처럼, 미세조류의 기름도 다양한 지방산으로 구성되어 있다. 예를 들어, 클로렐라 기름은 평균적으로 15.21%의 팔미트산, 18.41%의 올레산, 14.26%의 리놀레산, 15.21%의 α-리놀렌산(linolenic acid)로 구성되어 있다 [4]. 종합하면, 불포화지방산이 가장 많은 비율을 차지하고 있다. 따라서, 본 글에서는 이러한 불포화지방산을 활용하여 중쇄지방산 및 그 유도체를 생물학적으로 생산한 예에 대해서 소개하고자 한다.
소개하고자 하는 연구에서는 클로렐라 기름을 사용하여 중쇄지방산 및 그 유도체를 생산하고자 하였기 때문에, 먼저 클로렐라 기름의 조성을 확인하였다. 클로렐라 기름 가수분해물은 인하대학교 이철균 교수팀으로부터 제공받았다. 제공받은 원료를 분석한 결과, 기존에 보고된 조성 [4]과 차이가 있었다 (표 1).
Fatty acid | Percentage |
C16:0 | 28.7% |
C16:1 | 1.3% |
C16:2 | 0.7% |
C18:0 | 6.7% |
C18:1 | 4.0% |
C18:2 | 50.3% |
C18:3 | 2.8% |
C18:4 | 0.8% |
C20:5 | 4.7% |
우리가 사용하고자 했던 클로렐라 기름 가수분해물은 리놀레산이 반 이상의 비율을 차지하고 있었기 때문에, 이를 이용하여 중쇄지방산 및 그 유도체를 생산하려면 그림 3의 효소반응법을 이용하되, 리놀레산에 높은 반응성이 있는 oleate hydratase가 필요하였다. 한편, 이화여대와 건국대 연구팀은 리놀레산에 기질특이성이 높은 hydratase, 즉 linoleate hydratase (LHTase)를 보고한 바 있었다 [5]. 따라서, 클로렐라 기름 가수분해물 활용에서는 LHTase를 활용하여 중쇄지방산을 생산하였다. 따라서, 그림 3에서 나타난 hydratase-dehydrogenase-monooxygenase 연쇄 반응을 위해서, Lactobacillus acidophilus NBRC13951 유래 LHTase, Micrococcus luteus NCTC2665 유래 secondary alcohol dehydrogenase (SADH), Pseudomonas putida KT2440 유래 Glu×6 tagged Baeyer-Villiger monooxygenase (engineered form of Baeyer-Villiger monooxygenase) (BVMO) [6] 의 C302L 돌연변이 효소 (BVMO_C302L) [7] 를 사용하였다. 이들 효소는 모두 대장균 BL21 숙주에서 발현되었다. 또한, 지방산 수송을 원활하게 하기 위해, 대장균 유래의 FadL (fatty acid transporter)을 재조합 대장균에서 발현하였다. 먼저 LHTase가 클로렐라 기름 가수분해물에 반응성이 있는지 확인하기 위해 LHTase 반응을 먼저 시험해보았다. 클로렐라 기름 가수분해물을 10 mM (그림 4) 또는 20 mM (그림 5) 농도의 기질로 사용하여, 재조합 대장균 전세포를 처리하였다. 그 결과 리놀레산 가수반응의 전환율은 모든 기질 농도에서 60%를 보여주었다.
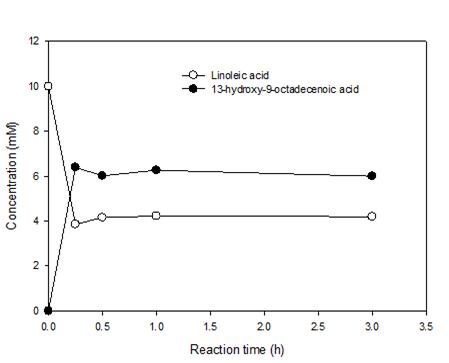
그림 4. 클로렐라 기름 가수분해물을 10 mM 사용했을 때, 리놀레산 가수반응 산물의 시간별 농도변화. 여러 성분 중 GC-MS를 이용하여 리놀레산 및 그의 생성물만 분석하였다.
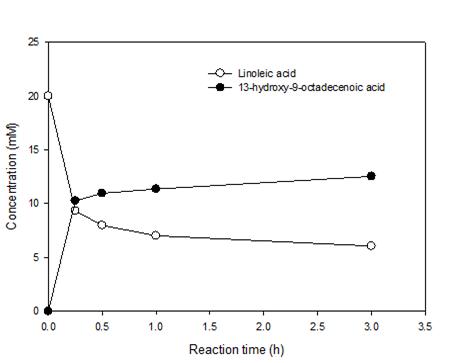
그림 5. 클로렐라 기름 가수분해물을 20 mM 사용했을 때, 리놀레산 가수반응 산물의 시간별 농도변화. 여러 성분 중 GC-MS를 이용하여 리놀레산 및 그의 생성물만 분석하였다.
클로렐라 기름 가수분해물을 사용하였을 때, LHTase가 반응성이 있는 것을 확인하였기 때문에, SADH와 BVMO_C302L을 이용하여 에스터 형태가 생성될 수 있는지 추가적인 반응을 수행하였다. BVMO는 keto-fatty acid를 기질로 사용하여 에스터형태를 만들 때, 두 가지 반응을 수행한다 (그림 6).
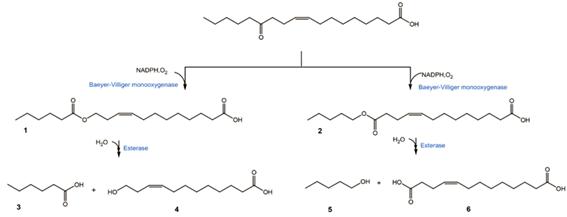
그림 6. BVMO가 수행하는 Baeyer-Villiger oxidation 반응. 1은 keto기를 기준으로 오른쪽에 산소가 삽입되고, 2는 keto기를 기준으로 왼쪽에 산소가 삽입된 형태이다. BVMO반응으로 1이 생성되느냐 2가 생성되느냐에 따라, lipase나 esterase로 ester를 가수분해했을 때 생성물이 달라진다 (3, 4 vs. 5, 6) [8].
BVMO는 그림 6에 나타난 것과 같이 두 가지 방법의 Baeyer-Villiger oxidation을 수행하는데, keto기를 기준으로 어떤 쪽에 산소 원자가 삽입되는가에 따라, 에스터를 가수분해 했을 때 최종 산물이 달라진다. 그림 6을 보면, BVMO가 에스터 1을 만들게 되면 에스터를 가수분해 했을 때 3(지방산), 4(하이드록시 지방산)를 만들지만, BVMO가 에스터 2를 만들게 되면 에스터를 가수분해 했을 때 5(지방족알콜)와 6(다이카르복시산)이 생성된다. 따라서, SADH와 BVMO_C302L의 반응을 추가적으로 수행하고 난 후 1과 2의 농도를 측정하였다. 다만, BVMO 반응에 있어, Glu×6 tag만 붙인 BVMO와 Glu×6 tag을 붙인 후 C302L 돌연변이까지 추가한 돌연변이 효소 두 가지를 모두 시험하였다. 반응 시간에 따른 전환율을 그림 7과 8에 나타내었다. LHTase 반응 산물인 13-hydroxy-9-octadecenoic acid를 기질로 사용하였을 때, 에스터 형태가 나타나는 전환율은 각각 66% (그림 7), 62% (그림 8)로 나타났다.
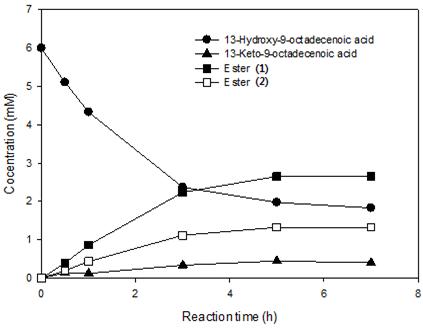
그림 7. ADH와 BVMO 반응을 통해 LHTase 반응의 산물인 13-hydroxy-9-octadecenoic acid를 에스터까지 변환한 반응의 시간별 반응 프로파일. 이 반응에서 BVMO는 Glu×6 tag만 붙인 야생형 BVMO를 사용하였다.
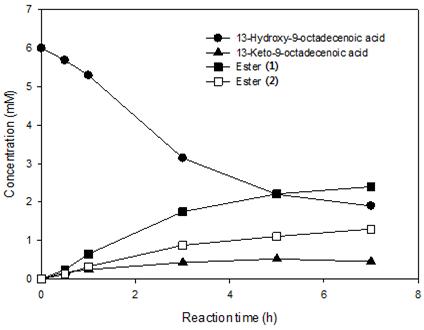
그림 8. ADH와 BVMO 반응을 통해 LHTase 반응의 산물인 13-hydroxy-9-octadecenoic acid를 에스터까지 변환한 반응의 시간별 반응 프로파일. 이 반응에서 BVMO는 Glu×6 tag를 붙이고 야생형 BVMO에 C302L 돌연변이를 추가한 돌연변이 효소를 사용하였다.
이 실험에서 최종적으로 에스터 형태 산물을 가수분해하지는 않았지만, 이는 예전의 많은 논문에서 이미 증명된 바 있으므로 [1,2,9], Candida rugosa 유래 lipase나 Thermomyces lanuginosus 유래 lipase를 사용하여 분해할 수 있을 것으로 확신한다.
3. 결론
이 연구에서 클로렐라 기름 가수분해물을 가지고 중쇄지방산을 생산할 수 있음을 보였다. 석유를 이용하지 않고 바이오매스를 이용하여 화합물을 생산하고자 하는 시도는 이제 확고히 자리를 잡았고, 우리나라와 같이 수출주도형 경제에서는 선진국의 환경 기준 및 탄소중립형 생산 기조를 맞추는 것은 필수적이다. 또한 바이오매스를 이용한 생물학적 생산은 거스를 수 없는 대세가 되었다. 이 글에서는, 차세대 화학물질 생산 공정 연구의 일환으로 바이오매스를 이용한 중쇄지방산 생산 연구를 소개하였다. 이 연구에서는 첫 단계로 국내에서 조달된 바이오매스의 성분 분석부터 진행하였다. 국내에서 마련된 클로렐라 기름의 가수분해물은 리놀레산이 주성분임을 알 수 있었는데, 이는 이전의 외국의 보고와는 차이가 있었다. 따라서, 본 연구에서는 클로렐라 기름 가수분해물을 더욱 잘 변환하기 위하여 hydratase를 새롭게 발굴하였고, 이를 적용하여 중쇄지방산을 생산하는 것을 보였다. 이러한 연쇄 효소 반응 (hydratase-dehydrogenase-BVMO) 방법은 아직 보완해야 할 점이 존재하는데, 올레산 혹은 리놀레산과 같이 순수한 물질을 사용할 때 보다, 클로렐라 기름 가수분해물과 같이 올레산 혹은 리놀레산 외에 다른 물질이 함유된 혼합물을 사용하여 효소반응을 진행할 때는 수율이 다소 떨어지는 것을 볼 수 있었다. 그러므로 혼합물을 쉽고 간단한 방법으로 전처리하는 방법을 고안하는 것은 바이오매스를 이용한 화합물 합성에서 반드시 필요한 방법으로 생각된다.
이 글에서는 클로렐라 기름 가수분해물을 사용하여 중쇄지방산을 생물학적인 방법으로 생산하는 연구를 소개하였다. 장쇄불포화지방산으로부터 중쇄지방산 생산을 위한 연쇄 효소 반응(hydratase-dehydrogenase-BVMO)은 예전에도 소개되었지만, 이 연구에서는 바이오매스를 사용하여 시험한 결과를 소개하였다. 상기한 결과에서도 볼 수 있듯이, 다소 간의 수율 차이는 있으나, hydratase-dehydrogenase-BVMO 연쇄 효소 반응은 바이오매스 사용 시에도 성공적으로 수행될 수 있음을 알 수 있었다. 추가적인 연구로서는 연쇄 효소 반응을 위한 유전자를 플라스미드로 삽입하지 않고, 게놈에 삽입하여 (예전 연구([10])를 참고) 플라스미드 안정성을 신경 쓰지 않고, 또한 항생제를 사용하지 않고도 대용량 발효를 할 수 있는 균주의 개발에 대한 연구가 필요할 것으로 생각된다.
감사
본 출판은 (재)오뚜기함태호재단의 연구 및 출판지원사업에 의해 지원받았다.
참고문헌
1. Song, J.-W., E.-Y. Jeon, D.-H. Song, H.-Y. Jang, U. T. Bornscheuer, D.-K. Oh, and J.-B. Park (2013) Multistep enzymatic synthesis of long-chain a,w-dicarboxylic and w-hydroxycarboxylic acids from renewable fatty acids and plant oils. Angew. Chem. Int. Ed. Engl. 52: 2534-2537.
2. Jeon, E.-Y., J.-H. Seo, W.-R. Kang, M.-J. Kim, J.-H. Lee, D.-K. Oh, and J.-B. Park (2016) Simultaneous enzyme/whole-cell biotransformation of plant oils into C9 carboxylic acids. ACS Catal. 6: 7547-7553.
3. Islam, M. A., K. Heimann, and R. J. Brown (2017) Microalgae biodiesel: current status and future needs for engine performance and emissions. Renew. Sust. Energ. Rev. 79: 1160-1170.
4. Otles, S., and R. Pire (2001) Fatty acid composition of Chlorella and Spirulina microalgae species. J. AOAC Int. 84: 1708-1714.
5. Oh, H.-J., S.-U. Kim, J.-W. Song, J.-H. Lee, W.-R. Kang, Y.-S. Jo, K.-R. Kim, U. T. Bornscheuer, D.-K. Oh, and J.-B. Park (2015) Biotransformation of linoleic acid into hydroxy fatty acids and carboxylic acids using a linoleate double bond hydratase as key enzyme. Adv. Synth. Catal. 357: 408-416.
6. Seo, J.-H., H.-H. Kim, E.-Y. Jeon, Y.-H. Song, C.-S. Shin, and J.-B. Park (2016) Engineering of Baeyer-Villiger monooxygenase-based Escherichia coli biocatalyst for large scale biotransformation of ricinoleic acid into (Z)-11-(heptanoyloxy) undec-9-enoic acid. Sci. Rep. 6: 28223.
7. Woo, J.-M., E.-Y. Jeon, E.-J. Seo, J.-H. Seo, D.-Y. Lee, Y. J. Yeon, and J.-B. Park (2018) Improving catalytic activity of the Baeyer-Villiger monooxygenase-based Escherichia coli biocatalysts for the overproduction of (Z)-11-(heptanoyloxy)undec-9-enoic acid from ricinoleic acid. Sci. Rep. 8: 10280.
8. Seo, J.-H., Min, W.-K., Lee, J.-H., Lee, S.-M., Lee, C.-G. and Park, J.-B. (2018) Whole-cell biotransformation of Chlorella oil hydrolysates into medium chain fatty acids. J. Mar. Biosci. Biotechnol. 10: 44-52.
9. Seo, E.-J., Y. J. Yeon, J.-H. Seo, J.-H. Lee, J. P. Bongol, Y. Oh, J. M. Park, S.-M. Lim, C.-G. Lee, and J.-B. Park (2018) Enzyme/whole-cell biotransformation of plant oils, yeast derived oils, and microalgae fatty acid methyl esters into n-nonanoic acid, 9-hydroxynonanoic acid, and 1,9-nonanedioic acid. Bioresour. Technol. 251: 288-294.
10. Seo, J.-H., S.-W. Baek, J. Lee, and J.-B. Park (2017) Engineering Escherichia coli BL21 genome to improve the heptanoic acid tolerance by using CRISPR-Cas9 system. Biotechnol. Bioprocess Eng. 22: 231-238.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
