| 질병의 치료를 위한 유전자 조작 미생물 의약품 개발 동향 | |
|---|---|
| Date 2023-04-13 00:49:59 |
|

한국외국어대학교 생명공학과
songm@hufs.ac.kr
1. 서론
유전자 조작 미생물 의약품(genetically engineered microbial medicines)은 질병의 진단 혹은 치료를 위해 유전자 조작을 통해 의약품으로서 개발된 미생물을 일컬으며, 이는 살아있으면서 생체내 특정한 위치에서 외부 환경에 대한 인식과 반응을 통해 치료물질을 전달할 수 있다. 따라서, 이른바 생균제(Live Biotherapeutics products: LBPs)에 해당하는 치료제로 분류될 수 있다. 생균제에 대한 미국 FDA의 정의에서 해당 미생물은 세균과 같은 살아있는 개체로서 여과 가능한 바이러스, 종양 용해성 세균 또는 유전자 치료제로 의도된 제품이 아닌 것으로 명시되어 있으며 특정한 치료 기능을 수행 한다는 점에서 단순한 프로바이오틱스 보충제와는 구별된다. 현재까지 승인을 받은 LBP 제품은 0건에 해당하지만 개발된 많은 종류의 생균제가 암, 염증질환, 대사 및 희귀 질환 치료제로서 임상시험 단계에 있다. 이는 이러한 유전자 조작 미생물 의약품의 잠재력이 확대될 수 있음을 시사한다. 본론에서는 다양한 질환 치료에 활용될 수 있는 유전자 조작 세균 기반 의약품 개발 현황과 전망에 대해서 소개하고자 한다.
2. 본론
기존의 치료제와는 달리 살아있는 미생물을 이용한 의약품은 체내에서 증식하며 숙주와 끊임없이 상호작용함으로써 면역 반응을 자극하고 아울러 기존에 존재하는 체내 미생물(microbiota) 및 감염 병원체와 공생/경쟁관계에 있음으로써 치료 효과를 증대 할 수 있다는 장점이 있다 [1]. 특히, 장내미생물은 다양한 대사, 면역 질환 발병과의 직접적인 상관관계에 있어 인체 전반에 미치는 영향이 매우 높아 이들과의 상호작용 및 경쟁관계를 확립함으로써 치료 효과를 확립할 수 있다 [2]. 따라서, 미생물 의약품은 개별 숙주의 미세한 반응에 상응하여 치료가 이루어질 수 있어 환자 맞춤형 정밀 의료 구현을 가능하게 할 수 있다.
2.1. 의약품 개발 대상 세균(Bacterial chassis) 선정
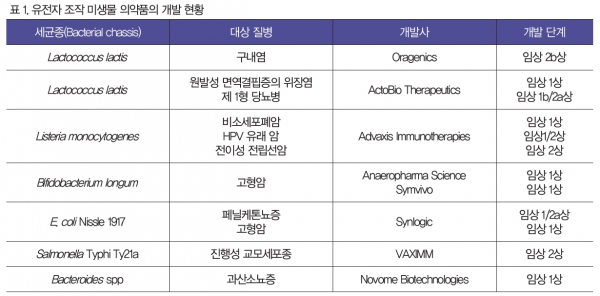
고도화된 유전자 조작 기법, 정밀한 유전자 발현 조작용 부품들의 갖춤 외에도 생체내 작용 부위내 성장 가능성, 투여 경로에 따른 생존 가능성 등을 고려한 균주 선택이 반드시 필요하다. 아울러 산업적 배양 조건에서 대량 생산, 정제, 공급이 가능한지의 여부 또한 균주 선정에 고려되어야 한다 [1-3]. 니슬 대장균(E. coli Nissle 1917; EcN)은 프로바이오틱스 균주로서 100년 이상 사용되어오고 있으며 유전자 조작을 통해 고형암, 페닐케톤뇨증(Phenylketonuria; PKU) 등의 질병 치료제로 개발되어 임상시험 단계에 있다(Synlogic; 표1). Lactobacillus와 Lactococcus와 같은 프로바이오틱스 균주들 또한 대상 세균으로 선정되어 개발되고 있는데 이들 세균들은 특히 장내 정착·서식 특성이 있지 않아 약동학적 분석과 예측이 어느 정도 가능하며 구강 경로를 통해 도입되었을 경우 위, 소장, 대장과 같은 생체 여러 기관에서 높은 생존률과 효능을 보인다 [4,5]. Salmonella, Listeria와 같은 병원성 세균 또한 약독화 및 치료물질 발현 전달을 위해 유전자 조작되어 암치료체, 면역치료제로의 가능성을 검증받고 있다 [6,7]. 아울러, Bacteroides 종과 같은 장내 정착 세균(GItract colonizing bacteria)을 이용하여 만성질환을 치료하는 연구가 임상 단계에 있다(Novome Biotechnologies; 표1).
2.2. 질병의 진단과 치료를 위한 유전자 조작 미생물 설계
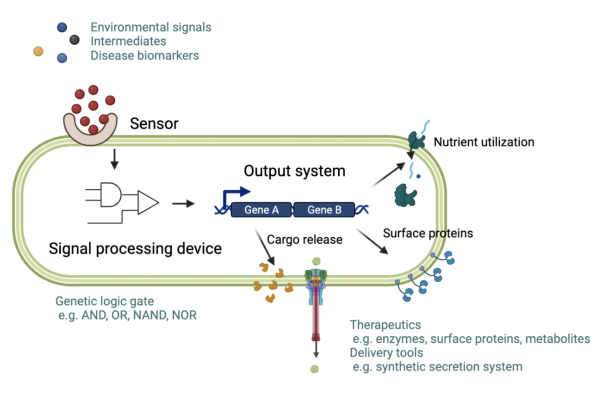
대사 질환이나 암과 같은 질병의 발생에는 정상세포의 활성과는 다른 변화가 따른다. 따라서 이러한 변화를 감지(sense)하여 반응(respond) 할 수 있는 진단 및 치료 장치를 갖춘 미생물을 설계하여 진단·치료에 활용한다. 선정된 세균종에 도입되는 유전자 구조물들의 구성은 먼저 pH, 산소농도, 정족수 감지 신호(quorum signal)등 생체내 환경에서 감지될 수 있는 신호 및 대사 중간 산물, 질병 바이오마커(biomarker)등을 감지할 수 있는 센서(sensor)이며 다음으로 이들 감지된 신호(signal)들을 프로세스 하는 유전자 장치로서 다양한 생명체에서 유래한 전사 조절인자 등으로 이루어진 인공유전자회로(Synthetic genetic circuit)들이 있으며 이때 질병의 명확한 진단에 따른 치료를 위해 여러 신호들을 복합적으로 처리할 수 있는 AND, NAND, OR 및 NOR와 같은 논리회로를 설계하여 활용한다. 마지막으로 이러한 신호 처리 과정을 통해 실질적으로 치료 효능을 지니는 물질의 인공 합성 경로(synthetic metabolic pathway)가 가동되거나 효소와 같은 치료 효능 단백질(들)이 발현되어 배출되거나 또는 암호화된 인공 분비 장치(synthetic secretion system)가 [8] 형성되어 이들의 전달을 가능하게 하는 산출 시스템(output system)으로 이루어져 있다 (그림 1).
예를 들어, 암의 발생에 있어 암미세환경(tumor microenvironment)의 특성을 이용하여 바이오센서를 제작할 경우 암 조직내에서 이들 바이오센서와 연결된 인공유전자회로를 가동시킴으로써 치료물질의 발현 또는 생산을 유도하게 되어 종양 특이적 치료가 구현된다 [9]. 이는 Salmonella, Listeria, E. coli종 등이 가진 뛰어난 암 표적 효율을 최대로 활용함과 아울러 종양 특이적 치료제 전달에 따른 정상 세포에 대한 치료물질의 영향을 최소화할 수 있다는 점에서 부작용을 줄일 수 있다. 만성 염증성 질환의 경우에는 염증 연관 물질의 감지에 따른 인공유전자회로가 개발되어 있고 이 회로에 의해 항염증 물질의 전달이 이루어지게 하여 과민성 대장 증후군을 치료하고자 하는 시도가 있다 [10].
2.3. 유전자 조작 미생물의 제형
진단·치료 효능을 가진 유전자 조작 미생물의 생체 적합성 및 안정성을 높이고 이들을 효율적으로 작용 위치에 전달하기 위한 제약학적 방법 및 유전자 조작 방식이 있으며 이들을 융합한 형태 또한 응용될 수 있다. 약제 제형법을 이용한 방법에는 낮은 pH, 항균제, 소화 효소 등에 대한 보호력을 높이기 위해 생체 적합성 지질 성분으로 된 막(membrane)으로 코팅을 하거나 [11], 생체 특정 위치로의 결합력을 증대 시킬 수 있는 인자를 이용하는 방법이 있다. 예를 들어streptavidin과 결합한 anti-MUC2 항체를 화학적 결합에 의해 biotin을 표면에 장식하고 있는 세균에 연결함으로써 이를통해 점막 부착력을 증가시킨 사례가 있다 [12]. 이외에도 다양한 생체 물질들을 기반으로 유전자 조작 미생물을 캡슐로 감싸 생체 도입 후 정착 효율 증가나 생체 잔류 시간 등을 증대시키는 방법들이 시도되고 있다 [13,14]. 대상 미생물을 감싸 이를 보호하고 생체내 안정성을 꾀하는 데에는 유전 공학적 방법 또한 적용될 수 있다. 예를 들어 생물막(biofilm)을 모사하여 점막 부착력이 증대될 수 있도록 세균에서 curli fiber 구성 단백질을 발현하여 분비하게 할 경우 대상 세균을 하이드로젤처럼 감싸게 되어 보호해 줄 수 있으며 [15] 이때, curli fiber에 trefoil factor를 접합할 경우 점막 치료 효과까지 유도할 수 있음이 보고되었다 [16]. 세균의 표면에 숙주 세포의 인자와 결합할 수 있는 리간드를 발현시켜 부착력을 증가시키는 시도로서 점막 결합 단백질을 이용한 경우가 있다 [17]. 뿐만 아니라, 햄스터와 피그렛 감염 모델에서 Clostridium difficile adhesion 단백질인 SlpA를 표면에 발현하고 있는 젖산균을 이용하였을 때 이 젖산균이 C.difficile의 정착을 방해하여 감염을 억제할 수 있음이 증명된 바 있다 [18]. 이는 표면 발현 인자의 선택에 따라 체내에서 경쟁관계에 있는 감염균을 억제하는 데에도 유전자 조작 미생물이 활용될 수 있음을 의미한다. 마지막으로, 세균성 셀룰로스(cellulose)는 생체내에서 분해가 용이하며, 일종의 보호벽으로서 기능할 수 있는 특성이 있어 이를 많이 분비하는 Glucoacetobacter hansenii와 유전자 조작된 니슬 균주를 공배양하여 하이브리드 캡슐에 둘러싸인 니슬 균주를 제작함으로써 기능성을 저해하지 않으면서 생체 적응성을 증대시킨 융합형 제형의 예가 있다 [19].
2.4. 유전자 조작 미생물의 유해성 최소화를 위한 안전 시스템
유전자 조작 미생물 의약품은 생체 안전성을 고려한 대상 미생물 종을 선정하고, 적확한 기능 수행을 위한 정밀 유전자 조작을 통해 개발되어지나, 살아있는 생물을 이용하게 되므로 의약품으로 도입된 유전자 조작 미생물들의 생물학적 봉쇄(biocontainment)가 반드시 함께 고려되어 개발되어야 한다. 생물학적 봉쇄를 위해 먼저 영양요구성(nutritional auxotrophy)을 사용할 수 있는데, 이는 선정 미생물종의 염색체에서 필수 영양소 대사 경로에 작동하는 유전자를 제거하고 해당 영양소를 별도로 공급함으로써 선정 미생물의 증식을 제어하는 방식으로 이루어진다. 두 번째, 인공 아미노산을 필요로 하는 영양 요구 균주를 제작하여 별도로 도입하는 인공 아미노산의 공급이 있을 경우에만 증식이 가능하게 하는 방식을 이용할 수 있으며 [20], 같은 맥락으로 chlorouracil과 같은 인공 핵산에 대한 영양 요구 균주 [21]를 제작하여 이용할 수 있다. 마지막으로 사멸 스위치(kill switch)와 같은 인공유전자 회로 [22]를 도입하여 증식이 필요하지 않을 경우 미생물의 사멸을 꾀하여 안전성을 확보할 수 있다. 끝으로, 많은 연구에서 유전자 조작 과정에서의 효율로 인해 플라스미드 기반의 유전자 구조물을 사용하고 있으나 상대적으로 낮은 플라스미드 유지 효율과 아울러 항생제 저항성 유전자를 이용한 선별 마커의 사용은 생체내 효능 증대와 항생제 저항성 유전자의 전파를 막기 위해 의약품용 미생물제작에는 사용이 지양되어야 한다.
3. 결론
합성생물학의 빠른 발전에 따른 정교한 유전자 조작 기술은 진단과 치료를 수행할 수 있는 인공 미생물의 개발로 이어지고 있으며, 일부 개발된 미생물은 난치성 질병의 치료를 위한 의약품으로서 임상시험 단계에 있다. 그러나, 살아있는 미생물의 적용에 따른 생체의 변화에 대한 연구는 시작 단계에 있다. 유전자 조작 미생물의 인체 적용에 따른 대사 흐름분석(metabolic flux analysis), 네트워크 모델링, 그리고 생리학적 모델링을 통해 환자 맞춤형 유전자 조작 미생물을 개발할 수 있는 기반을 쌓아야 한다. 이를 바탕으로 차세대 유전자 조작 미생물 의약품은 생체 적합성이 개선되고, 질병 특이성이 증대되고 부작용이 최소화 될 수 있도록 개발되어야 한다.
참고문헌
1. Heavey MK, Durmusoglu D, Crook N, Anselmo AC. Discovery and delivery strategies for engineered live biotherapeutic products.Trends Biotechnol. 2022 Mar 1;40(3):354–69.
2. Brennan AM. Development of synthetic biotics as treatment for human diseases. Synth Biol Oxf Engl. 2021;7(1):ysac001.
3. Charbonneau MR, Isabella VM, Li N, Kurtz CB. Developing a new class of engineered live bacterial therapeutics to treat human diseases. Nat Commun. 2020 Apr 8;11(1):1738.
4. Song AAL, In LLA, Lim SHE, Rahim RA. A review on Lactococcus lactis: from food to factory. Microb Cell Factories. 2017 Apr 4;16(1):55.
5. Vesa T, Pochart P, Marteau P. Pharmacokinetics of Lactobacillus plantarum NCIMB 8826, Lactobacillus fermentum KLD, and Lactococcus lactis MG 1363 in the human gastrointestinal tract. Aliment Pharmacol Ther. 2000 Jun;14(6):823–8.
6. Zheng JH, Nguyen VH, Jiang SN, Park SH, Tan W, Hong SH, et al. Two-step enhanced cancer immunotherapy with engineered Salmonella typhimurium secreting heterologous flagellin. Sci Transl Med. 2017 Feb 8;9(376):eaak9537.
7. Selvanesan BC, Chandra D, Quispe-Tintaya W, Jahangir A, Patel A, Meena K, et al. Listeria delivers tetanus toxoid protein to pancreatic tumors and induces cancer cell death in mice. Sci Transl Med. 2022 Mar 23;14(637):eabc1600.
8. Lim D, Jung Wch, Jeong J-H, Song M. Targeted Delivery of the Mitochondrial Target Domain of Noxa to Tumor Tissue via Synthetic Secretion System in E. coli. Front Bioeng Biotechnol. 2020 Jul 17 ;8;article840
9. Omer R, Mohsin MZ, Mohsin A, Mushtaq BS, Huang X, Guo M, et al. Engineered Bacteria-Based Living Materials for Biotherapeutic Applications. Front Bioeng Biotechnol. 2022 Apr 28;10;article870675
10. McKay R, Ghodasra M, Schardt J, Quan D, Pottash AE, Shang W, et al. A platform of genetically engineered bacteria as vehicles for localized delivery of therapeutics: Toward applications for Crohn’s disease. Bioeng Transl Med. 2018 Sep;3(3):209–21.
11. Cao Z, Wang X, Pang Y, Cheng S, Liu J. Biointerfacial self-assembly generates lipid membrane coated bacteria for enhanced oral delivery and treatment. Nat Commun. 2019 Dec 19;10(1):5783.
12. Vargason AM, Santhosh S, Anselmo AC. Surface Modifications for Improved Delivery and Function of Therapeutic Bacteria. Small 2020 Jun;16(25):e2001705.
13. Park BW, Zhuang J, Yasa O, Sitti M. Multifunctional Bacteria-Driven Microswimmers for Targeted Active Drug Delivery. ACS Nano. 2017 Sep 26;11(9):8910–23.
14. A pH-Responsive Gel Macrosphere Based on Sodium Alginate and Cellulose Nanofiber for Potential Intestinal Delivery of Probiotics | ACS Sustainable Chem. Eng. 2018, 6, 13924-931
15. Duraj-Thatte AM, Courchesne NMD, Praveschotinunt P, Rutledge J, Lee Y, Karp JM, et al. Genetically Programmable Self-Regenerating Bacterial Hydrogels. Adv Mater Deerfield Beach Fla. 2019 Oct;31(40):e1901826.
16. Praveschotinunt P, Duraj-Thatte AM, Gelfat I, Bahl F, Chou DB, Joshi NS. Engineered E. coli Nissle 1917 for the delivery of matrix-tethered therapeutic domains to the gut. Nat Commun. 2019 Dec 6;10(1):5580.
17. Mays ZJS, Chappell TC, Nair NU. Quantifying and Engineering Mucus Adhesion of Probiotics. ACS Synth Biol. 2020 Feb 21;9(2):356–67.
18. Vedantam G, Kochanowsky J, Lindsey J, Mallozzi M, Roxas JL, Adamson C, et al. An Engineered Synthetic Biologic Protects Against Clostridium difficile Infection. Front Microbiol. 2018;9:2080.
19. Birnbaum DP, Manjula-Basavanna A, Kan A, Tardy BL, Joshi NS. Hybrid Living Capsules Autonomously Produced by Engineered Bacteria. Adv Sci. 2021;8(11):2004699.
20. Lee JW, Chan CTY, Slomovic S, Collins JJ. Next-generation biocontainment systems for engineered organisms. Nat Chem Biol. 2018 Jun;14(6):530–7.
21. Marlière P, Patrouix J, Döring V, Herdewijn P, Tricot S, Cruveiller S, et al. Chemical evolution of a bacterium’s genome. Angew Chem Int Ed Engl. 2011 Jul 25;50(31):7109-14.
22. Chan CTY, Lee JW, Cameron DE, Bashor CJ, Collins JJ. “Deadman” and “Passcode” microbial kill switches for bacterial containment. Nat Chem Biol. 2016 Feb;12(2):82-6.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update