| mRNA 백신의 열적안정성 확보를위한 최신 연구동향 | |
|---|---|
| Date 2023-04-13 01:10:05 |
|

1. 서론
유례없는 코로나19 바이러스의 창궐로 인해 6.75억명 이상의 사람들이 감염되고 687만명의 사람이 사망하였다 [1]. 일반적으로 하나의 백신 개발을 위해서는 10년 이상의 기간동안 천 억 이상을 투자해야 한다고 하지만 [2], 급속도의 전염성과 사망률로 인해 코로나19 바이러스 백신도 놀라운 속도로 개발되었다. 최초의 코로나19 바이러스 유전체 공개부터 백신 염기서열을 확정하는 데 단 이틀, Moderna에서 개발한 mRNA 백신은 첫 번째 접종물을 제조하는 데 25일, 임상 1상 연구(NCT04283461)에서 첫 번째 참가자에게 투여되기까지 63일이 걸렸다고 보고되었다 [3]. 이렇게 짧은 기간 동안 mRNA 기반의 백신 기술이 엄청난 발전을 이뤘고, Moderna, Pfizer/BioNTech의 코로나 백신이 94.5% 이상의 높은 접종효과를 얻었다. 하지만 금방 잠잠할 것 같았던 코로나19는 오미크론 BA.4와 BA.5 등의 변종의 확산으로 인해 사회적 거리두기 조치가 2022년 4월 18일까지 유지되었고, 2023년 현재에도 코로나19 감염자가 발생하고 있다. 또한, 21세기 이후 5-7년을 주기로 코로나19를 포함한 에볼라(Ebola), 지카(Zika) 바이러스 등 인수공통성을 가지는 RNA 바이러스가 주기적으로 유행하고 있어mRNA 백신은 차세대 치료제로 그 개발에 대한 수요가 증가하고 있다.
코로나19 백신의 개발과 발 빠른 보급으로 전세계적으로 120백만 건 이상이 투여되었지만, 저소득 층의 국가에서는 오직 21%의 사람들에게만 백신이 접종되었는데 그이유는 mRNA 백신 자체의 불안정한 특성과 까다로운 보관 및 운송 조건 때문이다[4]. 현재 mRNA 치료제는 지질나노입자(Lipid nanoparticle, LNP) 기반의 제형이 가장 안정적인 것으로 보고되고 있고, Moderna와 Pfizer/BioNTech의 mRNA 백신도 LNP기반으로 상용화되었다 [5]. 하지만 mRNA-LNP의 실온 불안정성으로 인해 현재 승인된 개방되지 않은 mRNA-LNP 백신의 보관조건은 9개월 보관 시 Moderna 백신(mRNA-1273)의 경우 영하 15~25°C, Pfizer/BioNTech 백신(BNT162b2)의 경우 영하 60~90°C이다. 또한, 냉장상태(2~8°C) 에서는 한 달, 상온에서는 4~24시간 동안만 안정한 것으로 보고되어 매우 까다로운 저장 조건을 가지고 있다[6]. 따라서 mRNA 백신은 보관 및 운송에 콜드체인(cold-chain)을 반드시 필요로 하는데, 이는 백신의 가격을 대폭 상승시키고 보급 및 보관에 제약을 가져오게 된다. 이를 극복하기 위해 mRNA-LNP 백신 및 치료제의 열적 안정성을 증가시키기 위한 연구가 활발히 진행되고 있지만 [7], 쉽게 분해되는 mRNA의 특성과 복잡한 LNP 시스템 등의 이유로 인해 비냉동 상태의 mRNA 백신 제품은 아직까지 상용화되지 않았다. 따라서 주기적으로 발생하는 인수공통성 감염병으로 인한 인적, 경제, 사회적 피해를 예방하고, 효과적인 백신을 지역에 상관없이 전세계적으로 원활하게 공급하기 위해서는 콜드체인 시스템이 필요 없고, 생산이 빠르고 간편하며, 오랜 기간동안 안정하고 다양한 면역원성을 갖는 차세대 mRNA 백신의 개발이 필요하다. 물론 mRNA의 안정화를 위해 자체의 분해 메커니즘을 분석하고 이를 통해 안정성을 확보하는 방향도 있지만, 본 기고문에서는 mRNA 백신에 관한 연구 동향 중 열적 안정성을 갖는 mRNA 백신 제형의 개발에 대한 최신 연구 동향에 대해 소개하고자 한다.
2. 본론
2.1. 동결보호제를 이용한 mRNA 백신 안정화
mRNA 백신을 동결건조제형으로 개발하는 것이 백신의 상온 안정화를 위해 가장 기본적이고 활발히 진행되고 있는 연구 중 하나이다. 그동안 최적의 LNP 동결 조건을 찾기 위해 다양한 연구가 수행되었고, LNP를 동결시키기 위해서는 mRNA-LNP 제형 후 sucrose 또는 trehalose와 같은 동결보호제를 첨가해야 한다는 연구결과들이 보고되었다 [8]. 예시로 Moderna 거대세포바이러스(CMV)의 mRNA-LNP 백신(mRNA-1647)의 임상 2상 연구에서 동결건조제형이 5°C에서 최소 18개월 동안 안정성을 갖는 것으로 보고되었다 [9]. 한편, 상용화된 코로나19 백신 Moderna와 Pfizer/BioNTech은 모두 최종 농도 10%의 sucrose를 포함하지만, 두 개의 코로나19 mRNA 백신의 초기 보관온도는 Moderna가 영하 15~20°C, Pfizer/BioNTech가 영하 60~80°C로 차이가 있다 [10]. 최근의 안정성 데이터 확보로 유럽 의약품청(EMA)은 Pfizer/BioNTech 백신도 역시 영하 15~25°C에서 2주 동안 보관하도록 승인했다 [11].
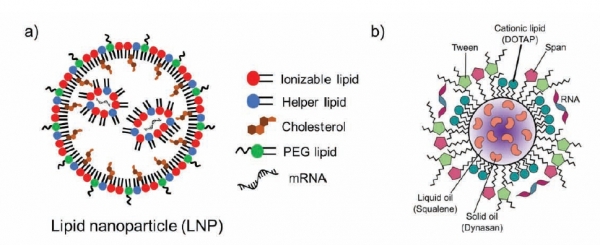
현재 mRNA-LNP를 동결하는 것이 LNP 안정성도 중요하지만 내부의 mRNA를 보호하기 위함으로 보고되고 있다[12]. LNP는 이온화 지질, polyethylene glycol (PEG) 지질, cholesterol, helper 지질로 구성되며 이들의 적절한 구성비에 의해 안정성을 유지한다 (그림 1a). mRNA는 주로 핵산의 phosphodiester backbone의 가수분해에 의해 빠르게 분해되는데, 이것이 LNP의 분해보다 빠르고 민감하여 mRNA-LNP의 전체적인 보관 온도와 시간을 결정한다. siRNA와 같이 작은 분자를 캡슐화하는 LNP는 내부에 물을 거의 포함하지 않은 상태로 촘촘하게 제형화가 가능하지만, 이보다 훨씬 긴 mRNA는 LNP 내부에 물이 최대 24%까지 구성되어 mRNA 안정성에 영향을 줄 수 있다고 한다 [13]. 실제로 FDA 승인된 siRNA-LNP (ONPATTRO®) 의약품이 2~8°C에서 24개월 동안 보관이 가능한 반면, mRNA-LNP 코로나19 백신은 안정성이 한 달이 되지 않는 것은 LNP 내부의 물이 mRNA의 안정성에 큰 영향을 주는 것을 알 수 있다 [14]. 따라서 Shenzhen Rhegen Biotechnology의 Hu 연구팀은 동결건조조건을 최적화하여 LNP 내부의 수분을 최소화하기 위한 연구를 수행함으로써 mRNA 상온 안정성을 확보하기 위한 연구를 수행하였다 [15]. 그 결과 동결건조된 백신제형이 25°C 에서 6개월 간 변형되지 않고 기능을 유지했다고 보고하였다.
mRNA-LNP의 장기 보관 및 안정성은 제제 설계에서 주요 고려 사항이며 임상 관련성이 높고 백신 배포 및 가격에 미치는 영향이 크다. 따라서 mRNA 백신의 개발이 얼마되지 않은 상황에서 sucrose와 같은 동결보호제로 제형화된 것이 가장 효과적인 백신이라고 할 수 있다. 하지만 동결건조 역시 비용이 많이 들고 시간이 많이 걸리기 때문에, 궁극적으로는 mRNA 구조 및 변형의 알고리즘 최적화를 통해 mRNA 자체의 안정성을 향상시킬 수 있는 연구가 필요하며, 동결되지 않은 온도에서 LNP 안정성을 위한 새로운 솔루션이 여전히 요구되고 있다.
2.2. 지질 구성 변경을 통한 mRNA의 상온 안정성 연구
mRNA의 안정성을 증가시키기 위하여 다양한 지질 구성을 통해 안정성을 증가시키려는 연구도 이루어지고 있다. Access to Advanced Health Institute (AAHI) 연구소의 Voigt 연구팀은 nanostructured lipid carrier (NLC)를 mRNA 백신 제형화에 사용함으로써 상온에서 6개월, 냉장조건에서 10개월 이상의 mRNA 안정성을 확보하였다 [16]. LNP가 위에 언급했듯이 내부에 mRNA와 동시에 물을 포함하는 구조이기 때문에 mRNA의 가수분해에 의해 안정성이 떨어진다고 보고되었다. 그렇기 때문에 동결건조시 mRNA와 물의 접촉을 최소화하기 위해 mRNA와 결합성이 있는 지질을 사용하였고, RNase로 인한 분해를 막았다. 또한 mRNA가 캐리어 내부가 아닌 외부에 결합하도록 하여 동결건조시 수분접촉을 최소화하여 자체적인 분해를 막도록 설계하였다 (그림 1b). 그 외에도 mRNA의 면역효과를 향상시키기 위해 squalene과 자체증폭가능한 saRNA (self-amplifying RNA)를 도입하여 안정성을 향상시켰다. 본 제형은 특별한 lipid나 mRNA의 pseudouridine 변형을 하지 않아도 높은 백신효율을 보였고 적은 제형으로도 효과적으로 항원을 발현시켰다.
또한 Ohio State University의 Dong 연구팀은 지질 유사 나노 입자 (lipid-like nanoparticle, LLN)을 합성하여 mRNA의 장기 저장 조건을 연구했다. 액체 질소에 보관된 LLNs-mRNA 제제에 5% sucrose 또는 trehalose를 첨가하여 입자의 물리화학적 특성을 보존하고 3개월 동안 생체 내 전달 효능이 유지되었다고 보고되었다 [17].
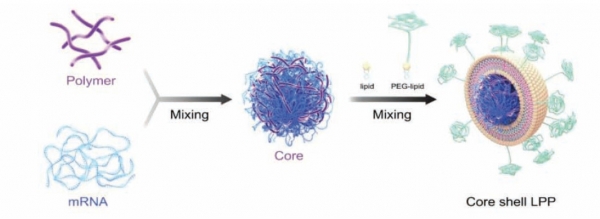
Chinese Center for Disease Control and Prevention의 Tan 연구그룹은 core-shell 구조의 지질나노입자 복합체를 합성하여 코로나19 mRNA 백신을 캡슐화하는 연구를 수행하였다 (그림 2) [18]. 본 제형은 마이크로플루이딕 시스템을 통해 대용량으로 제조되었고 안정한 분산성을 나타내었다. 또한 코로나19 및 변이 바이러스에도 강한 면역효과를 나타내었고, 코어에 포함된 mRNA는 고분자와 안정적인 결합을 통해 4°C에 보관 및 운송이 가능하다고 보고하였다.
3. 결론
본 기고문에서는 mRNA 백신의 상온안정성 확보를 위한 제형연구에 관한 연구 동향을 소개하였다. 하지만 아직까지 mRNA 치료제의 상온 안정화를 위해 대부분 동결건조방식을 이용하고 있고, 궁극적인 mRNA 분해에 대한 정확한 메커니즘은 밝혀지지 않은 상황이다. 물론 동결건조는 생체분자의 상온 안정성을 부여할 수 있는 효과적인 방안이지만, 공정의 기간이 길고 비용이 비싸기 때문에, 얼지 않는 온도에서 안정성을 개선하기 위한 생명 공학 기술 개발은 여전히 필요한 실정이다.
10년 이상을 투자해도 신약을 개발하기 어려운 시대에서 수많은 노력을 통해 불과 수개월 만에 얻어낸 코로나19 백신은 짧은 개발기간에도 높은 면역효과를 나타내어 코로나19도 어느덧 잠식되어가고 있다. 지금까지는 코로나19로 인한 국가적 피해를 당장이라도 줄이고, 백신의 보관 및 보급을 원활하게 하기 위해 콜드체인 시스템으로 엔지니어링 관점에서 유통 및 보관 요구 사항들을 해결해왔다. 하지만 이는 어디까지나 임시방편일 뿐, 다음 번 다가올지도 모르는 전염병을 맞이할 때는 현재의 궁극적인 한계점을 해결한 상태여야 한다. 다행히도 코로나19 창궐로 인해 mRNA 치료제에 대한 기술이 급속도로 발전하였고, 본 기술은 백신뿐아니라 다양한 치료제로 적용 영역이 확장되고 있어 현재의 한계점을 계속해서 해결해줄 것이라고 확신한다.
참고문헌
[1] COVID-19 Data Explore, Our World In Data, https://ourworldindata.org/explorers/coronavirus-data-explorer
[2] 방은경, K-mRNA 백신을 위한 기술의 융합, 한국과학기술연구원, 융합연구리뷰, 2022-03, 8(3), 27-54
[3] Moderna: Moderna’s Work on our COVID-19 Vaccine. 2021.
[4] Rappaport, A. R. et al. Low-dose self-amplifying mRNA COVID-19 vaccine drives strong protective immunity in non-human primates against SARS-CoV-2 infection. Nat. Commun. 13, 3289, 2022.
[5] Dong, E., Du, H. and Gardner, L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Infect. Dis. 20, 533–534, 2020.
[6] Corbett, K. S. et al. SARS-CoV-2 mRNA vaccine design enabled by prototype pathogen preparedness. Nature 586, 567–571, 2020.[7] Muramatsu, H. et al. Lyophilization provides long-term stability for a lipid nanoparticle-formulated, nucleoside-modified mRNA vaccine. Mol. Ther. 30, 1941–1951, 2022.
[8] Ball, R.L., Bajaj, P., and Whitehead, K.A. Achieving long-term stability of lipid nanoparticles: examining the effect of pH, temperature, and lyophilization. Int. J. Nanomedicine 12, 305-315, 2017.
[9] Karve, S. Process of Preparing mRNA - Loaded Lipid Nanoparticles, 2018, vol. 1.
[10] Schoenmaker, L., Witzigmann, D., Kulkarni, J.A., Verbeke, R., Kersten, G., Jiskoot, W., Crommelin, D.J.A. mRNA-lipid nanoparticle COVID-19 vaccines: structure and stability. Int. J. Pharm. 601, 120586, 2021.
[11] Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nat. Rev. Mater. 0123456789, 2021.
[12] Kon, E., Elia, U., and Peer, D. Principles for designing an optimal mRNA lipid nanoparticle vaccine. Curr. Opin. Biotechnol. 73, 329–336, 2022.
[13] Arteta, M.Y. et al., Successful reprogramming of cellular protein production through mRNA delivered by functionalized lipid nanoparticles. Proc. Natl. Acad. Sci. USA 115, E3351-E3360, 2018.
[14] CDER: Product Quality Review (S) NDA 210922 ONPATTRO(Patisiran) Lipid Complex Injection Addendum to Drug Product Quality Review. 2017.
[15] Ai, L. et al., Lyophilized mRNA-lipid nanoparticle vaccines with long-term stability and high antigenicity against SARS-CoV-2. Cell Discov. 9, 9, 2023.
[16] Voigt, E.A. et al., A self-amplifying RNA vaccine against COVID-19 with long-term room-temperature stability. npj Vaccines 7, 136, 2022.
[17] Zhao, P., Hou, X., Yan, J., Du, S., Xue, Y., Li, W., Xiang, G., Dong, Y., Long-term storage of lipid-like nanoparticles for mRNA delivery, Bioact. Mater. 5(2), 358–363, 2020.
[18] Yang, R. et al., A core-shell structured COVID-19 mRNA vaccine with favorable biodistribution pattern and promising immunity, Signal Transduct Target Ther. 6, 213, 2021.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update