| 단일도메인 항체 치료제 및 적용 기술에 활용되는 in silico 플랫폼, 그리고 이를 지원하는 오송첨단의료산업진흥재단 | |
|---|---|
| Date 2023-10-12 23:42:48 |
|

책임연구원
오송첨단의료산업진흥재단 신약개발지원센터 인공지능구조설계팀
gre7@kbiohealth.kr
1. 서론
Evaluate Pharma World Preview 2020, Outlook to 2026 (2020.7)를 인용하면 글로벌 100대 의약품 중 바이오의약품 시장 규모는 2026년 505 billion dollar 현재 환율로 대략 바꾸면 658조억원 정도이다. 또한 글로벌 100대 의약품 중 바이오의약품과 합성(및 기타)의약품의 비중 및 전망을 보았을 때 바이오의약품은 2026년 55%를 차지할 것으로 전망하고 있다 (그림 1). 이는 바이오의약품의 중요성을 잘 나타낸 하나의 예로 볼 수 있으며 우리나라 정부는 이러한 앞으로의 전망을 대비하기 위해 본 저자가 속해 있는 오송첨단의료산업진흥재단을 2005년 10월 의료산업선진화위원회를 통해 준비한 이유이기도 하다.
이렇게 큰 중요성, 특히 우리나라 국부의 창출에 크게 이바지할 수 있을 이 가능성에 대해 이야기에 앞서 도대체 바이오의약품이 무엇인지에 대해 간략히 짚고 넘어가야 할 것이다.
Chat GPT 와 같은 생성형 인공지능이 유행인 요즘, 본 저자도 바이오의약품 (biopharmaceubi, biodrugs)의 정의에 대해 한번 질문을 해 보았고 그 답을 다음과 같이 받았다.
“바이오의약품 은 사람이나 다른 생물체에서 유래된 원료를 이용해 제조한 의약품을 일컬으며 보통 유전자재조합기술 (genetic recombination technology)과 세포배양기술 (cell culture technology) 등의 생물공학 방식을 적용해 만들며 대표적인 형태로는 인슐린 (insulin), 항체 (antibody), 백신 (vaccine) 등의 현태로 존재한다. 이러한 바이오의약품의 장점은 합성의약품들에 비해 독성이 낮고, 부작용이 적으며, 희귀성 난치성 질환 등 특정 질병을 표적 치료하는 데 효과적이다. “이 Chat GPT에서 생성된 답변에서도 볼 수 있는 것처럼 바이오의약품의 한 축을 항체의약품이 차지하고 있는데, 본 저자는 이 항체에 대한 이야기를 본인이 속해 있는 기관과 기술 및 플랫폼을 중심으로 써 보고자 한다.
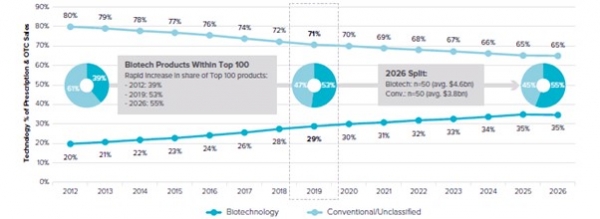
그림 1. 바이오의약품 및 합성의약품 매출액 비중의 비교 및 예상치.
2. 본론
2.1. 항체 (antibody)
항체는 우리 몸을 구성하는 단백질로 이루어져 있으며 생명체가 만들어진 것으로 추정되는 약 38억년 전부터 진화과정을 통해 차근차근 만들어진 방어 메커니즘의 주력 무기라고 볼 수 있다. 이러한 항체의 특징 중 그 기원이 생체내 물질이라는 점, 그리고 구조적인 특징, 즉 견고하고(열을 포함한 환경에 대한 안정성) 공격대상을 아주 특별하고 강하게 인지, 무력화시킨다는 점 등을 통해 일찍이 치료제로서의 가능성을 보고 많은 연구자들과 글로벌 제약사가 항체를 활용한 의약품 개발에 힘쓰고 있는 것이다. 그림 2에서 보는 것처럼 바이오의약품은 점점 더 커지고 복잡해지고 있다. 특히 항체를 중심으로 하는 바이오의약품의 개발은 항체의 특성을 가져오게 하는 부위, 즉 항원 특이성과 관련된 Fab 영역과 항체의 혈중 지속시간과 관련된 Fc 영역을 보다 다양한 기술을 접목해 개발하면서 그 적응증과 활용성이 확대되고 있는 상황이다. 위에서 간략히 언급한 것처럼 항체는 기본적으로 항체를 이루는 각 도메인을 별도로 개선을 통한 활용이 가능하다. 특히 우리나라는 Fc 도메인의 엔지니어링을 통한 혈중 농도를 유지하고 시간을 증대시키는 소위 PK 개선에 대한 성과와 능력이 글로벌 수준에 와 있다. 이와 함께 항체의 가장 중요한 덕목인 항원 특이적 인식과 관련한 Fab 영역에 대한 선별법과 엔지니어링은 여전히 치열한 각축을 벌이고 있는 분야로 본인이 속한 오송첨단의료산업진흥재단 신약개발지원센터 역시 다양한 항원에 대응 가능한 후보물질의 확보를 돕기 위한 Fab 형태와 scFv 형태의 인간항체 라이브러리 선별 플랫폼을 구축하고 서비스하고 있다.
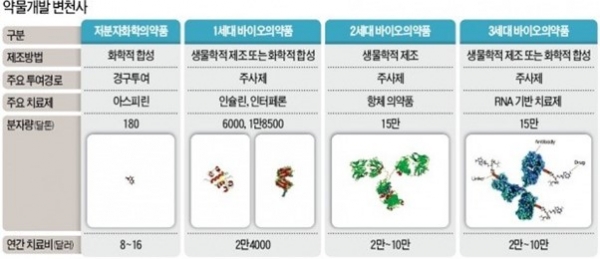
그림 2. 항체를 포함한 약물개발 변천사 (한국경제, 2018).
2.2. 단일도메인항체
하지만 기존 IgG 형태의 항체에 대한 활용은, 물론 충분한 이유와 장점이 있지만, 좀 더 다양한 활용 및 적용을 위한 수요와 기대가 커지게 되었고 이를 충족시키기 위해 고안된 다양한 방법 중의 하나가 바로 단일도메인 항체 (single domain antibody)이다.
단일도메인 항체는 그 단어 그 뜻대로 “하나의 도메인으로 이루어진 항체”라는 의미로 항원을 인지하는 능력을 가진 단일 펩타이드 (peptide)로 구성되어 있는 단백질이다. 일종의 항체 개발의 미니멀리즘 (minimalism)으로 표현할 수 있는데 이는 기존 항체 (IgG를 예를 들 때)가 150 kDa이라고 하는 단백질 치고는 작지 않은 분자량(크기)을 가지고 있고 구조적으로도 상당히 복잡한 (중쇄와 경쇄가 복합체를 이루고 있는) 단백질이라 생산에 대한 어려움과 비용이 소비된다는 점에 대한 일종의 개선을 이루고자 하는 연구자들의 고민에 대한 선택 중의 하나라고 볼 수 있다. 더더군다나 우리와 친근한 낙타 (포유류), 상어 (연골어류), 먹장어 (무악류)와 같은 생물체의 일부는 현재도 단일도메인 항체를 활용하거나 그 흔적 (항원 인식 수용체)을 가지고 있고 과학자들은 그것들을 활용 안 할 이유가 없는 것이다 (그림 3).
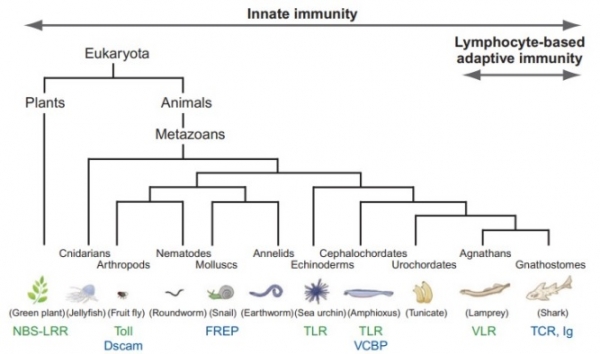
그림 3. 진화과정을 통해 갖게 된 선천 면역과 적응 면역, 그리고 여기에 사용되는 단백질 및 수용체. 림프구 기반 적응 면역에 사용된 VLR과 Ig(NAR)를 눈 여겨 볼 필요가 있다. (Advances in Immunology, 2011)
또한 이러한 단일도메인 항체들은 기존의 면역글로불린 (immunoglobulin) 기반의 항체와 함께 이중항체, 다중항체, 키메라 항원수용체 (CAR-X), 항체-약물 접합체 (ADC, antibody-drug conjugate), 단백질 분해 키메라 (PROTAC, Proteolysis-targeting chimera)에 활용 뿐만 아니라 다양한 진단 기법에도 적용 가능하기 때문에 그 활용은 무궁무진할 것이다 (그림 4).
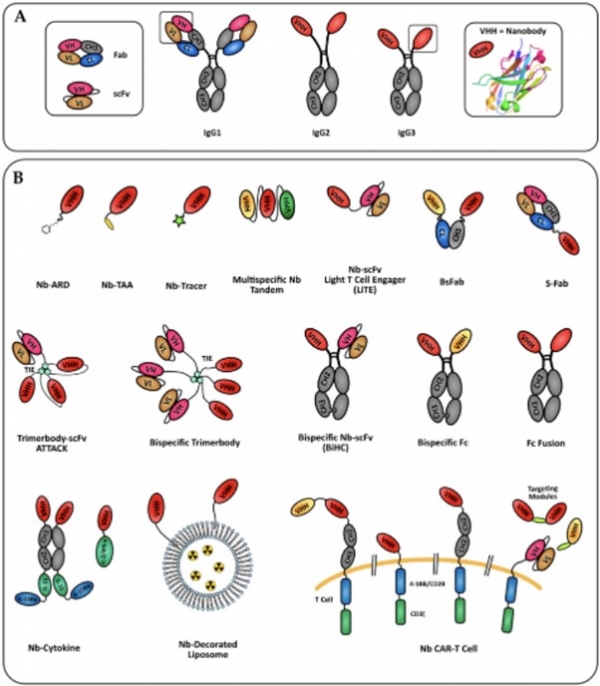
그림 4. 단일도메인항체의 다양한 용도로의 활용. (Antibodies 2019)
이러한 항체 개발에 활용 가능한 유전자원 및 물질에 대한 확보를 위해 본 재단 신약개발지원센터는 2019년부터 과기부 재원을 활용한 기반기술구축사업을 통해 우리나라 연골어류 자원의 최고 전문가 중의 한 분인 국립부경대학교 김진구 교수의 도움으로 연골어류 유래 단일도메인항체 선별과 관련한 네트워크를 구축하고 다양한 종의 유전자원 (VNAR, Variable New Antigen Receptor)을 확보해 놓고 일반 연구자들의 니즈를 소화하고 있다. 또한 낙타류 유래 단일도메인항체인 항체인 일명 나노바디(VHH, variable domain of heavy chain only antibody)에 대한 수요를 충족시키고 지원하고자 2022년부터 상지대학교 동물생리활성 물질자원거점은행 (안미정, 나정현 교수)과의 협력을 심화하고 있다. 그리고 이러한 노력과 함께 2021년 식품의약품안전처의 위탁과제수행을 통해 “감염병 등의 항체 치료제로서 나노바디의 가능성 탐색 연구(21172생물안724)” 보고서를 생산하고 덧붙여 “단일도메인항체 의약품 연구·개발 가이드(2022)”를 배포해 단일도메인항체분야의 영역을 확대하고 지원하기 위해 노력하고 있다. 그리고 2023년 과기부 “차세대 유사항체의 발굴, 엔지니어링 및 생산 통합시스템 기술개발”과제 (총괄 경상국립대학교, 정태성 교수)에 위탁 참여, VLR (variable lymphocyte receptor) 단일도메인항체 개발 및 지원에 힘쓰고 있다. 그 밖에도 저자가 속해 있는 오송첨단의료산업진흥재단 신약개발지원센터는 단일도메인 항체 영역에 대한 총체적 기술 개발 및 지원을 위한 플랫폼 구축을 꾸준히 진행하고 있다.

그림 5. 단일도메인항체 의약품 연구·개발 가이드 표지 (2022)
2.3. 인실리코 기술
인실리코 (in silico)라는 단어는 어쩌면 생소하게 보일 수 있는데, 연구자들에게는 친숙한 in vitro (시험관 내에서 벌어지는 실험), in vivo (생물체 내에서 일어나는 실험)와 같이 컴퓨터나 계산을 통해 라는 뜻으로 이해하면 편할 수 있다. 인실리코 기술이 이러한 단일도메인항체를 포함한 바이오의약품 개발에 도움이 되는 이유는 바로 바이오의약품의 대상이 되는 단일도메인항체는 생체고분자물질로 이를 구성하는 구성물질의 크기가 상대적으로 크고 이는 해당 정보도 크다는 의미이며 그렇기 때문에 그 분석과 응용 및 개선을 종이와 노트로 진행하는 데에는 어려움이 있고, 우리가 잘 활용할 줄 아는 계산기 즉 컴퓨터를 이용하는 것은 당연히 자연스럽고 효율적이기 때문이다. 현재 신약개발에 활용되는 in silico tool은 기본적으로 웹 (web)을 통해 공개된 코드 (code), 프로그램, 엡들이 있을 수 있고, 상당한 고가의 상용화 웹 서비스, 프로그램 등으로 나눌 수 있다. 여기서 강조하고 싶은 부분은 이러한 단일도메인 항체를 포함한 항체 의약품 및 이를 활용한 접근법에 있어서 그 중심에는 해당물질이 단백질로 이루어져 있고, 그 물질의 생김새 즉 구조 (structure)를 이해하는 것이 그 시작이며 대부분을 차지하는 동시에 가장 중요하다는 것에 있다. 사실 이러한 단백질의 구조를 해석하는 방법은 방사광가속기를 활용하는 X-선 단백질 결정학, NMR, 그리고 최근 상당히 뜨거운 분야이기도 한 초저온 전자현미경 (cryo-EM)이 대표적이나 아쉽게도 해당 분야의 연구는 거대 분석 장비나 연구시설이 필요하기 때문에 상당히 접근이 어려운 분야이기도 했다. 하지만 대표 인공지능 기업인 구글 딥마인드에서 개발한 알파폴드 (AlphaFold)가 2018년과 2020년 있었던 단백질 구조 예측 학술대회인 CASP에서 1-2위를 차지하는 성과를 보이고 단백질의 모델링이 거의 실제 구조를 따라가는 수준의 기술력을 보이며 많은 연구자들에게 큰 도움을 주고 있다. 그리고 이러한 모델링 기법은 이미 단백질 연구에 있어서 대표적인 웹 데이터베이스 서비스인 UniProt (https://www.uniprot.org/)에 연동되어 서비스되고 있다. 다시 정리하자면 항체의 약품 및 항체를 기반으로 하는 어떤 물질을 개발하는데 있어 항체의 모델링은 중요한 부분이다. 하지만 이 제한된 지면을 통해 수없이 많은 관련 tool이나 웹 서비스를 나열하는 데에는 한계가 있어 최근 저명 저널에 기술된 방법을 아래 소개하고자 한다 (그림 6).

그림 6. 대표적인 항체 구조 모델링 방법. (Trends in Pharmacological Sciences, 2023)
본 글의 중심 키워드이기도 한 단일도메인항체의 연구와 관련해 빠뜨릴 수 없는 중요한 정보가 모여 있는 공개 데이터베이스를 소개하고자 한다. 캐나다의 University of Lethbridge 연구진이 제공하는 단일도메인항체 데이터베이스인 sdab (http://www.sdab-db.ca/)은 2023년 8월 현재 1452종의 단일도메인항체의 서열 중보와 195종의 PDB 3차구조, 그리고 NCBI (National center for Biotechnology Information)에 등재된 단백질 중 489종이 연동되어 있다 (그림 7).
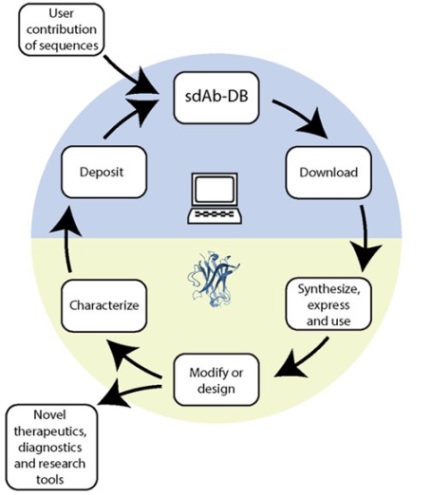
그림 7. sdAb-DB의 운용과 활용에 대한 도해. (ACS Synthetic Biology 2018)
참고로 본 인공지능구조설계팀은 2016년부터 프랑스 DASSULT사의 Discovery studio와 Pipeline pilot 그리고 QIAGEN사의 Ingenuity Pathway Analysis 플랫폼을 통해 구조 및 빅데이터 기반 신약개발을 지원중에 있다.
2.4. 인공지능의 활용
인공지능 (Artificial intelligence)은 이제 소수 과학자들의 연구영역에서 벗어나 일반 대중들에게 손쉽게 다가가고 활용되는 생활속의 기술이 되었다. 물론 단일도메인 항체를 포함한 항체의약품 개발에 있어서도 이미 인공지능을 활용한 엔지니어링은 진행되고 있고 본인이 속한 이곳에서도 관련 플랫폼을 개발 진행중에 있다. 인공지능을 활용하기 위해서는 무엇보다 선행되어야 할 것들 중의 하나가 바로 학습에 필요한 충분한 정보의 양이다. 물론 그 정보는 정확하거나 실험을 통해 도출된 것일수록 그 가치는 더더욱 빛날 것이다. 안타깝게도 항체와 관련한 구조 모델링, 인공지능의 활용 등은 상대적으로 어려움이 있다. 특히 항체의 모델 구축에 있어서 가장 중요한 부분이 바로 항체를 인식하는 상보성 결정 부위 (CDR, Complementarity-determining region) 영역인데 이 영역은 잘 알려져 있듯이 중쇄의 loop 3개와 경쇄의 loop 3개가 함께 공간을 차지하는 상당히 가변적이며 복잡한 구조 영역이기 때문이고 이러한 이유로 모델링을 포함하는 인실리코, 인공지능 기술의 적용이 아직은 충분치 않다 (물론 조만간 해결될 것이다.). 현재 개발되거나 활용되는 인공지능 기술을 적용한 항체 엔지니어링 방법은 다음과 같은 카테고리 내에서 진행된다고 볼 수 있다 (그림 8).
본 인공지능구조설계팀도 바이오의약품 개발과 관련한 기술 지원을 위해 2022년부터 과기부 산학연계 신약개발지원사업 “단백질 신약 개발을 위한 AI 플랫폼 개발” 과제를 통해 인공지능 신약개발 전문 기업인 ㈜아론티어 (대표, 고준수 박사)의 기술지원 및 협업으로 단백질 의약품 및 항체 의약품 개발을 돕는 인공지능 플랫폼을 개발 중에 있으며 2023년 초에 서비스를 개시할 계획이다 (그림 9). 본 플랫폼은 항체를 포함한 단백질의 모델링, 그리고 그 모델을 기반하는 상호작용 예측 및 분석, 그리고 이를 활용한 엔지니어링, 바이오의약품 개발 중 안전성에 대한 큰 issue인 면역원성 예측, 그리고 해당 단백질의 생산에 중요한 정보 중 하나인 코돈 (codon)의 최적화 기능을 탑재 운영할 계획이다.
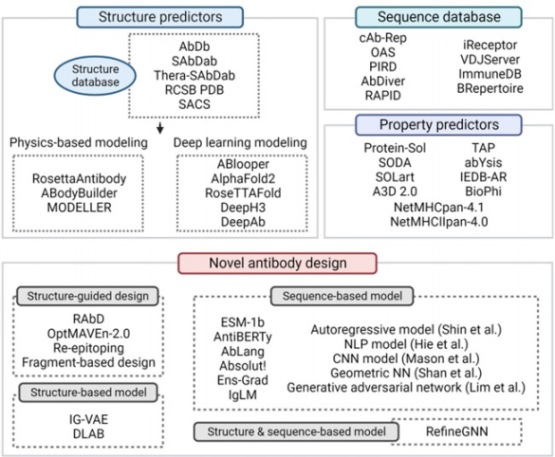
그림 8. 최근 개발되고 있는 in silico 항체 디자인 기법들. (Trends in Pharmacological Sciences, 2023)

그림 9. 2024년 서비스를 개시할 인공지능 단백질 및 항체 의약품 지원 플랫폼 (초기화면)
3. 결론
컴퓨터라는 하드웨어와 알고리즘 또는 프로그램이라고 (또는 코딩이라고) 부를 수 있는 소프트웨어의 발달, 발전은 그냥 뒤를 쫓아가는 것도 힘들 정도로 빠르게 진행된다. 분명 이러한 접근법은 한계가 있고, 아직 쓸만하지 못하다는 연구자들도 상당수 있는 것이 현실이다. 하지만 미지의 단백질 구조를 예측하기 위해 1994년부터 CASP 경쟁 대회가 열려 지금까지 진행되어 왔고, 그 기간동안 단백질 구조 예측은 homology modelling, energy calculations를 거쳐 인공지능을 활용한 AlphaFold가 개발되어 그동안 소위 아무도 믿지 않았던 계산을 통한 단백질 구조 예측이 이제는 누구나 참고하는 데이터가 되었다. 인공지능을 활용한 구조예측에 신경망 학습이니 언어 모델이니 하는 전혀 관련 없어 보였던 이론이나 기술도 이제는 충분히 납득할 만한 결과들을 생산하고 있다. 이러한 환경과 함께, 단일도메인항체는 그 구조가 상대적으로 덜 복잡하고 안정되어 있으며 많은 연구자들이 염려하는 만큼 면역원성이 높지도 않다는 것을 확인했다. 삼면이 바다로 되어 있고 수십 여종의 연골어류가 살고 있어 다양한 유전자원의 확보가 가능하다는 천혜의 장점을 살릴 수 있다는 점 (나고야 의정서와 관련한 앞으로의 여러 허들들을 극복할 수 있다는), 기존 immunoglobulin의 항원 인지 부위인 6개의 loop로 구성된 CDR 보다 훨씬 간단한 1-2개로 구성되어 있어 인공지능의 적용에 있어서도 훨씬 개발 및 적용 가능성이 높다는 점 등도 중요하다. 여기에 본론에서도 언급했지만 다양한 형태의 바이오의약품 개발에 활용될 수 있는 무궁무진한 가능성을 갖고 있는 항체이자 단백질이다. 또한 작고 튼튼하고(열이나 환경에서) 그로 인해 포유동물 유래 세포부터 박테리아까지 대부분의 단백질 발현 시스템의 적용이 가능 하는 특성을 갖고 있어 바이오신약개발 및 생산에 있어 큰 장점이 된다.
단일도메인항체는 생명현상을 조절하고 질병을 알아내고 치료하는 수단으로 그 가능성은 충분하다. 이미 글로벌 제약사들은 mRNA 전달체를 활용한 접근법, 세포치료제의 활용, 엑소좀 (exosome)의 적용 등을 진행하고 있다. 무언가를 목표 (targeting)하고 무언가와 결합 (binding)하고 무언가의 기능을 조절(regulation)할 수 있는 이 물질의 가능성에 대해 우리는 관심을 갖고 집중해야 할 이유가 될 것이다.
4. 마치며……
“단일도메인 항체 치료제 및 적용 기술에 활용되는 in silico 플랫폼”과 관련한 많은 정보를 드리고자 글을 쓰기 시작했지만 생각만큼 많은 정보를 독자들에게 전달하지 못했다는 아쉬움이 먼저 든다. 부디 이 글을 통해 시작된 작은 인연이 앞으로 단일도메인항체를 활용한 여러 좋은 일들을 하실 독자분들과 협업하는데 그 시작이 되었으면 하는 바람이다.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
