| 연속 바이오의약품 생산 공정을 위한 분리정제 기술 최신 연구동향 | |
|---|---|
| Date 2023-10-17 00:10:02 |
|

교수/대학원
생명공학과,바이오시스템융합학과/인하대학교 바이오시스템융합학과
ybbaek@inha.ac.kr/h1pp131930@inha.edu
1. 서론
연속 공정(continuous process)은 화학, 식품 및 제약 등 다양한 산업 분야에서 사용되고 있으며 최근에는 항체, 백신, 유전자 치료제를 포함한 바이오의약품의 연속 생산 공정에 대한 관심이 높아지고 있다. 현재 대부분의 바이오의약품 공정은 배치(batch)생산으로 수행되며, 일반적인 공정은 생물반응기에서 최종 제형 제품까지 50일 이상이 소요된다. 반면에, 연속 공정은 저장탱크 불필요 및 소규모 장비 사용으로 인해 자본 비용이 절감되고, 세척 및 밸리데이션(validation) 공정을 제외함으로써 생산성이 향상될 수 있으며, 공정 중 짧은 체류시간으로 인한 낮은 응집(aggregation) 생성 및 제품 분해(degradation)로 품질을 개선시킬 수 있는 등의 이점을 지니고 있다 [1-3].
연속 공정 개발을 위한 업스트림(upstream) 공정 기술로는 높은 역가(titer)의 바이오 의약품을 지속적으로 생산하기 위한 관류 세포 배양 공정(perfusion reactor)이 있으며,효과적으로 세포를 분리·회수할 수 있는 연속 원심분리 [4], 교대 접선 흐름 여과 (alternating tangential flow filtration, ATF) [5] 및 음파 분리(acoustic wave separation)[6] 등이 개발되었다. 지난 수십 년간 유전공학 및 대사공학의 발전과 더불어 perfusionreactor 개발로 업스트림 공정에서 높은 생산성을 달성할 수 있었으나, 다운스트림(downstream) 공정에서는 병목 현상(bottleneck)으로 인해 최대 효율을 얻는데 어려움을 겪고 있으며 이를 연속 다운스트림 공정으로 해결하고자 하는 노력이 지속되고 있다. 본 기고문에서는 연속 바이오의약품 생산 공정을 위한 분리정제 기술로 크로마토 그래피와 분리막/필터에 관한 연구동향을 소개하고자 한다.
2. 본론
2.1 연속 공정용 크로마토그래피
크로마토그래피는 불순물을 효과적으로 제거하고 처리부피를 감소시켜 downstream 공정에 주요하게 사용된다 [7]. 연속공정을 위해 개발된 다중 컬럼(multicolumn) 크로마토그래피 기술은 상호 연결된 여러 개의 컬럼을 사용하여 과부하(overloading)를 제어함으로써 수지 결합 용량(resin binding capacity)을 극대화하고, 이에 따라 장비 설치 공간, 버퍼소비량 및 수지 부피를 줄일 수 있다 [8]. 최근에 개발된 다양한 연속 크로마토그래피 시스템과 운전 조건을 표 1에 나타내었다.
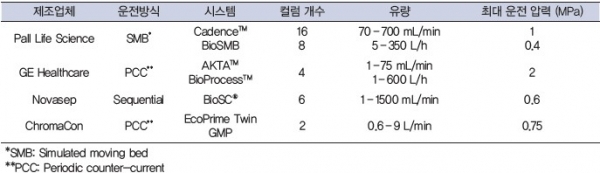
표1. 상용 연속 크로마토그래피 시스템
SMB (simulated moving bed)는 효율적인 분리를 위해 향류흐름(counter-current flow)을 이용하는 TMB (true moving bed)를 모사한 공정으로, 수지를 실제로 이동시키지 않으면서도 컬럼에 연결된 밸브의 흐름을 이동상의 흐름 방향에 맞추어 주기적으로 바꾸어 줌으로써 비슷한 효과를 얻을 수 있으며 사용되는 수지와 손실되는 제품의 양을 줄일 수 있다는 장점이 있다. 여러 개의 컬럼이 직렬로 연결된 형태로 분리된 시료는 해당되는 컬럼의 연결부에 장착된 밸브를 통해 회수된다 [9]. PCC (periodic counter-current chromatography)는 컬럼의 원수 주입, 세척 및 용출의 단계를 전환하여 사용할 수 있도록 하는 직렬로 구성되며 다음과 같이 운전된다. (1) 세포배양액이 컬럼1로 공급되고 포화상태에 이르면 컬럼2로 주입되어 컬럼1로부터 투과된 용액이 컬럼2에 포획되며, 컬럼1은 버퍼로 세척된다. 이때 세척액은 잔류 제품의 손실을 막기 위해 컬럼3을 통과한다. 세척이 완료되면 적합한 용출버퍼를 사용해 컬럼1의 제품을 용출시키고 컬럼2,컬럼3에 연결하여 투과되는 제품을 포획한다. 이후 컬럼1이 재생되고 평형 상태에 다다르면 위의 과정을 반복함으로써 연속 공정을 진행한다 [10]. 이러한 연속 크로마토그래피를 사용하여 단백질 A 포획, 바이러스 비활성화, 음이온 교환 및 양이온 교환을 두 대의 Cadence BioSMB PD 시스템에 통합하여 배치 공정과 비교한 결과 생산성이 3 – 5 배 증가하였으며 레진 부피는 95% 감소하고 버퍼 사용률은 44% 감소했다 [11].
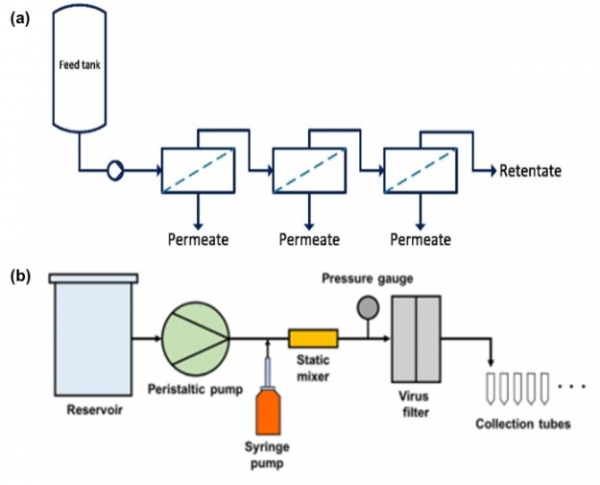
그림 1. (a) Single-pass tangential flow filtration (SPTFF) 시스템 모식도 [17], (b) 바이러스 제거성능 평가를 위한 transient inline spiking 시스템 모식도 [18].
한외여과/정용여과(ultrafiltration/diafiltration, UF/DF) 기술은 각각 제품의 농축과 버퍼 교환을 통한 제제(formulation)의 목적으로 사용되며, 주로 접선여과흐름(tangential flow filtration, TFF) 시스템을 이용하여 운전된다. TFF는 임계치 아래의 일정한 유량으로 운전하기 때문에 연속 공정으로의 도입이 쉬운 편이며 유의미한 fouling이 일어나지 않는다는 것이 특징이다. 기존 배치 UF/DF 기술을 대체하기 위한 연속 공정용 기술로는 single-pass TFF (SPTFF)가 있다 (그림1a). SPTFF 모듈은 단일 모듈에 여러개의 TFF 분리막을 포함하도록 설계되어 전체 경로 길이가 비교적 증한다는 특징이 있다. 따라서 단일 패스로도 단백질 농축이 가능하며, 재순환 탱크가 필요하지 않으므로 여과 시스템 내의 체류량이 감소하여 제품 회수가 개선 된다는 장점을 지닌다 [12,13]. SPTFF를 이용할 시 3-5배 정도의 농축이 가능하기 때문에 단위 작업 사이에 공정량을 줄이기 위한 용도, 또는 최종 제제화 단계에서 원하는 농도로 농축하기 위한 용도로 사용된다. Pall CadenceTM 시스템을 사용하여 45 g/L의 혈청 IgG를 200 g/L 이상으로 농축하였을 때, 제품 회수율이 95% 이상인 것으로 보고되었다 [14]. 최근에는 근적외선 분광법(near-infrared ray spectroscopy)을 활용하여 용액 공급 및 농축액의 농도를 제어하는 공정 분석 기술(process analytical technique, PAT)을 적용함으로써 SPTFF의 성능을 제어하고, 이를 통해 연속 공정을 개선하는 연구가 활발히 진행 중이다 [15]. 실제로 Millipore Pellicon® SPTFF 장비와 음이온교환 크로마토그래피(AEX)를 연속적으로 진행하며 용액 농도를 조절하여 필요 수지량 및 버퍼량을 감소시켜 전반적인 공정을 개선하고 제조 유연성을높였다는 보고가 있었다 [16].
바이오의약품 생산에 있어 바이러스 제거(viral clearance)는 산처리 및 계면활성제 등을 사용한 바이러스 불활성화(virus inactivation)와 분리막을 활용한 바이러스 여과(virus filtration)를 통해 이루어지고, 이 두 가지 공정은 모두 GMP 생산시설에 필수적으로 포함된다 [19]. 연속 공정에서의 바이러스 제거 성능 평가를 위해 버퍼와 단백질을 포함한 공급액을 일정한 유량으로 공급하면서 실린지 펌프를 이용하여 바이러스를 공급액에 투입해 주고, 정적 혼합기(static mixer)로 공급액과 바이러스가 잘 섞일 수 있게 하는 transient inline spiking system이 고안되었다 (그림1(b)) [18]. 해당 시스템은 짧은 시간 동안 바이러스를 주입하여 원하는 시점에서의 바이러스 제거 성능을 평가할 수 있다는 장점이 있다. 또한, 공급액의 바이러스가 분리막에 지속적으로 축적됨으로써 제거율의 감소를 초래하는 기존 방법에 비해, 이 시스템은 바이러스가 시스템에 잔류하는 시간을 최소화하여 연속 공정 성능 평가에 유리하다.
반면에 바이러스 제거 공정을 연속 공정에 접목하기 위해서는 고려해야 할 문제들이 있다. 먼저 연속 공정은 운전시간이 길어 압력 감소(pressure release)에 의한 바이러스 투과(virus breakthrough)가 일어날 가능성이 있고, 단백질 막오염에 따라 유량이 감소하면서 바이러스가 확산 현상에 의해 분리막을 투과하는 문제가 해결되어야 한다. 이러한 문제를 해결하기 위해서는, 바이러스 제거 공정을 연속 공정에 적용하였을 때 제거능에 문제가 없는지에 대한 평가가 이루어져야 한다. 최근에는 연속 바이러스 여과를 가능하게 하는 새로운 전량여과(dead-end filtration) 시스템이 소개되었다 [20]. 이 시스템은 탁도 및 압력 센서와 함께 여러 개의 소형 필터로 구성되어 있어 탁도 또는 압력 차단 값이 실시간으로 감지되면 필터를 즉시 전환하여 예기치 못한 바이러스 투과를 방지할 수 있다.
바이러스 불활성화 공정은 과도한 응집은 피하면서 불활성화에 필요한 충분한 시간을 충족시켜야 하기 때문에 연속공정에 도입하기 위한 관형 비활성화 반응기(tubular inactivation reactors), 컬럼 기반 바이러스 불활성화(column-based virus inactivation), 다중 용기 시스템 (multivessel system) 사용 등 여러 가지 기술이 제안되었다. 최근에는 코일형 유동반전 반응기(coiled flow inversion reactor, CFIR)가 개발되어 배치 공정과 비교하여 비슷한 수준의 바이러스 감소를 보이며 연속 공정에 적용할 수 있는 가능성을 보였다 [21].
3. 결론 및 제언
바이오의약품 제조 공정은 제품의 특성 및 성능을 유지하면서 변동하는 시장 수요를 충족하고 경제적 이익을 달성해야 한다. 이러한 사항을 충족시키기 위해서는 연속 공정 기술 개발이 중요하다. 엔드투엔드(end-to-end) 연속 공정은 절차 간소화, 생산성 및 품질 향상 등 많은 장점을 제공함에도 불구하고, 단위 기술의 통합, 규제 개선 등 여전히 해결해야 할 장애물이 남아있다. 이러한 장애물들을 극복하기 위해서는 단일 기술만이 아닌 upstream, downstream 공정을 아우르는 통합 연속 공정 개발이 필요하며 이를 다양한 조건과 변수로 시험할 수 있는 초소형 스케일-다운(ultra scaledown) 시스템의 구축이 요구된다. 더욱이 PAT를 통해 수립할 수 있는 디지털 트윈(digital twin)은 공정 이상의 감지 및 실시간 중요 공정 매개변수 제어 등 연속 공정에서 바이오의약품의 품질을 보장하기 위해 필요하다. 따라서, 확장성이 확보된 초소형 유닛을 perfusion reactor 및 크로마토그래피, 여과 기술에 도입하며 PAT 기반 공정제어 기술이 병합된 플랫폼 기술 (그림 2)을 통해 당면하고 있는 연속 공정 적용으로의 문제점들을 해결할 수 있을 것으로 사료된다.
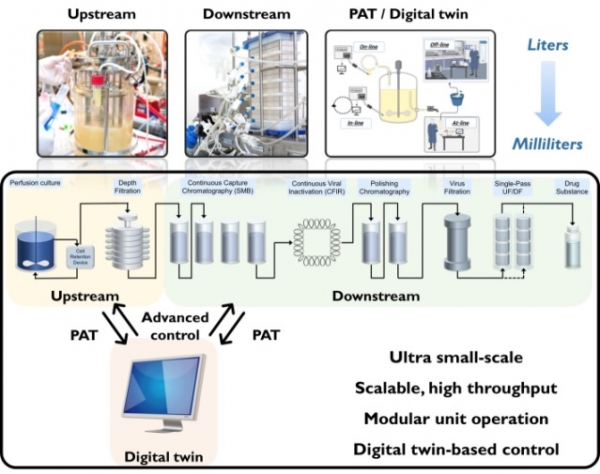
그림 2. 디지털 트윈 기반 초소형 연속 바이오제약 플랫폼 모식도.
참고문헌
1. Zydney, A. L. (2016) Continuous downstream processing for high value biological products: a review. Biotechnol. Bioeng. 113: 465-475.
2. Yang, O., S. Prabhu, and M. Ierapetritou (2019) Comparison between batch and continuous monoclonal antibody production and economic analysis. Ind. Eng. Chem. Res. 58: 5851-5863.
3. Gerstweiler, L., J. Bi, and A. P. J. Middelberg (2021) Continuous downstream bioprocessing for intensified manufacture of biopharmaceuticals and antibodies, Chem. Eng. Sci. 231: 116272.
4. Richardson, A. and J. Walker (2018) Continuous solids discharging centrifugation: a solution to the challenges of clarifying highcell-density mammalian cell cultures. Bioprocess Int. 16: 38-47.
5. Hadpe, S. R., A. K. Sharma, V. V. Mohite, and A.S. Rathore (2017) ATF for cell culture harvest clarification: mechanistic modelling and comparison with TFF. J. Chem. Technol. Biotechnol. 92: 732-740.
6. Hong, J. S., N. Azer, C. Agarabi, and E. J. Fratz-Berilla (2020) Primary clarification of CHO harvested cell culture fluid using an acoustic separator. J. Vis. Exp. 159: e61161.
7. Kelley, B. (2009) Industrialization of mAb production technology: the bioprocessing industry at a crossroads. mAbs 1: 443-452.
8. Godawat, R., K. Brower, S. Jain, K. Konstantinov, F. Riske, and V. Warikoo (2012) Periodic counter‐current chromatography–design and operational considerations for integrated and continuous purification of proteins. Biotechnol. J. 7: 1496-1508.
9. Oh, N. S., C.-H. Lee, J. I. Kim, and Y.-M. Koo (2005) Visual demonstration of simulated moving bed. Korean Chem. Eng. Res. 43: 360-365.
10. Bryntesson, M., M. Hall, and K. Lacki (2011) Chromatography method. US Patent 7,901, 581.
11. Gjoka, X., R. Gantier, and M. Schofield (2017) Transfer of a three step mAb chromatography process from batch to continuous: optimizing productivity to minimize consumable requirements. J. Biotechnol. 242: 11-18.
12. de los Reyes, G. and L. Mir (2006) Method and apparatus for the filtration of biological solutions, US Patent 7,384,549 B2.
13. Subramanian, G., A. Clutterbuck, P. Beckett, R. Lorenzi, F. Sengler, T. Bisschop, and J. Haas (2017) Single‐pass tangential flow filtration (SPTFF) in continuous biomanufacturing. pp. 423-456. In: G. Subramanian (ed.). Continuous Biomanufacturing: Innovative Technologies and Methods. Wiley‐VCH Verlag GmbH & Co.
14. Casey, C., T. Gallos, Y. Alekseev, E. Ayturk, and S. Pearl (2011) Protein concentration with single-pass tangential flow filtration (SPTFF). J. Membr. Sci. 384: 82-88.
15. Thakur, G., S. Thori, and A. S. Rathore (2020) Implementing PAT for single-pass tangential flow ultrafiltration for continuous manufacturing of monoclonal antibodies. J. Membr. Sci. 613: 118492.
16. Elich, T., E. Goodrich, H. Lutz, and U. Mehta (2019) Investigating the combination of single‐pass tangential flow filtration and anion exchange chromatography for intensified mAb polishing. Biotechnol. Prog. 35: e2862.
17. Madsen, E., J. Kaiser, U. Krühne, and M. Pinelo (2022) Single pass tangential flow filtration: Critical operational variables, fouling, and main current applications. Sep. Purif. Technol. 291: 120949.
18. Malakian, A., S. Y. Jung, M. A. Afzal, C. Carbrello, S. Giglia, M. Johnson, C. Miller, W. Rayfield, D. Boenitz, D. Cetlin, and A. L. Zydney (2022) Development of a transient inline spiking system for evaluating virus clearance in continuous bioprocessing—Proof of concept for virus filtration. Biotechnol. Bioeng. 119: 2134-2141.
19. ICH, Q5A (R2): Viral safety evaluation of biotechnology products derived from cell lines of human or animal origin. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use, in: Geneva, Switzerland., 2022.
20. Thakur, G., V. Hebbi, S. Parida, and A. S. Rathore (2020) Automation of dead end filtration: an enabler for continuous processing of biotherapeutics. Front. Bioeng. Biotechnol. 8: 758.
21. Parker, S. A., L. Amarikwa, K. Vehar, R. Orozco, S. Godfrey, J. Coffman, P. Shamlou, and C. L. Bardliving (2018) Design of a novel continuous flow reactor for low pH viral inactivation. Biotechnol. Bioeng. 115: 606-616.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update