| 환자 맞춤형 치료와 질병 모델링을 위한 차세대 오가노이드 (Organoid) 활용 기술 | |
|---|---|
| Date 2023-10-17 13:07:55 |
|

교수 / 대학원생
광주과학기술원 생명과학부
jinchoi@gist.ac.kr / autumn88@gm.gist.ac.kr
1. 서론
인류는 생명현상의 원리를 이해하기 위해서 다양한 조직들에서 유래한 세포들의 배양 기술과 초파리에서부터 마우스, 영장류에 이르는 다양한 종류의 동물 모델을 이용하여 왔다. 하지만, 실험실에서 2차원 형태로 배양되는 세포들은 실제 조직의 구조(hierarchical structure), 세포-세포와 세포-기질 간의 상호작용 등의 한계성으로 조직의 실제적인 세포기능과의 차이점이 존재한다. 특히, 동물 모델은 결국엔 인간과의 종 특이성으로 인한 차이로 인하여, 인간 질병의 발병 원인 및 개발되는 치료제의 효능과 독성을 평가하는 데 있어서 한계점을 지내고 있다. 최근 이런 문제점들을 근본적으로 해소할 수 있을 것이라 생각되는 3차원 체외 조직배양 (3D in vitro human organ culture)의 방법은 여러 방면에서 주목받고 있다. 오가노이드 (organoid)는 ‘미니 장기’로도 불리는 유사 생체 장기로써 ‘Organ (장기)’과 ‘Oid (유사한)’ 두 단어를 합성한 의미를 지니고 있다 [1]. 오가노이드는 줄기세포 (Stem cells)를 3차원 (3D)으로 배양하여 다양한 세포를 만들어 냄으로써 특정 장기를 모사하는 기관을 만들어 내는 방법이다. 줄기세포의 원료로서 분화된 체세포에서 역분화를시켜 만들어내는 “역분화 배아줄기세포 (Induced pluripotent stem cells, iPSCs)”나 특정 조직에 내재하는 “조직 내인성 줄기세포(Adult stem cells, AdSCs)”가 주로 이용된다[2] (그림 1). 이들 줄기세포를 3차원적으로 배양하게 되면 생체 내 장기 기능과 구조적으로 유사한 특징을 가지는 미니 장기를 만들어 낼 수 있다. 오가노이드의 조건은 타켓팅하는 장기를 이루는 다양한 세포로 구성되고 특정 장기와 유사한 구조 특이성을 갖추고 있으며, 특히 그 장기의 기능을 재현할 수 있어야 한다. 최근 연구들은 이런 오가노이드를 줄기세포의 분열과 분화 과정, 조직의 발생 과정, 그리고 조직의 재생 과정과 같은 기초연구와 더불어, 특정 일간 질병의 발병 기전 연구와 개인 맞춤형 치료제 개발을 위한 약물 개발 등에 활용하고 있다. 본 기고문에서는 오가노이드의 정의와 최신의 활용에 관한 최신 연구동향을 살펴보고자 한다.
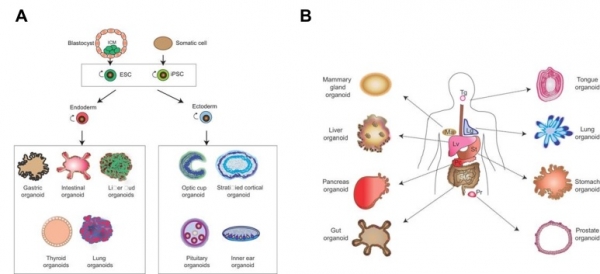
그림 1. 역분화줄기세포 (A) 또는 조직 내인성 줄기세포 (B)에서 유래한 오가노이드 배양 [2].
2. 본론
2.1 오가노이드 배양의 조건
오가노이드는 줄기세포를 3차원으로 배양하는 방법을 통하여 특정 장기를 구성하고 있는 다양한 세포들을 만들어내며, 실제 장기와 구조 및 기능적으로 유사한 미니장기를 만들어내는 배양 방법이다 [3] (그림 2). 오가노이드의 본격적인 발전은 네덜란드의 Hubrecht Institute의 Hans Clevers 그룹이 소장 (Instestine) 오가노이드를 만들 수 있다는 것을 보여주면서 시작되었다. 이 연구들은 줄기세포를 3차원으로 배양한 경우 체내 (in vivo)의 장기와 비슷한 세포를 만들어 내는 것은 물론 구조적으로도 유사한 형태의 구조물을 스스로 조직화하여 만들어 낼 수 있다는 것을 처음으로 보여주었다 [4,5] (그림 3). 이후 폐를 포함한 인간의 대부분의 장기에 대한 오가노이드가 구축되었다 (그림 4). 오가노이드를 배양하는 가장 기본적인 방법은 세포를 3차원 형태로 부착시키고 세포의 성장을 돕는 세포외기질 (Extracellular Matrix, ECM)을 이용하는 것이다 [6]. Engelbreth-Holm-swarm mouse sacroma에서 정제된 ECM인 ‘Matrigel’은 3D 오가노이드의 기반으로 가장 보편적으로 쓰이는 물질이다. 다른 방법은 3D 세포 응집체를 바닥에 붙이지 않고 떠있는 상태(suspension)로 배양하는 방법이다. 이는 optic cup, 대뇌, 소뇌, 해마 오가노이드를 만드는 데에 쓰이고 있다. 마지막으로 신장, 폐 오가노이드를 배양하는 방법 중 하나로 transwell과 같은 microporous membrane에 세포를 키우고 막 아래쪽에만 배지를 넣어주는 ‘Air-Liquid Interface’방법이 있다 [7].
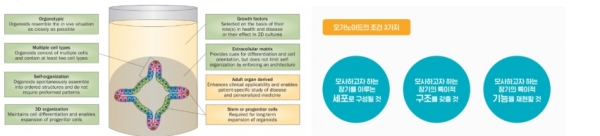
그림 2. 오가노이드 특징을 충족시키는 3가지 조건 [3].
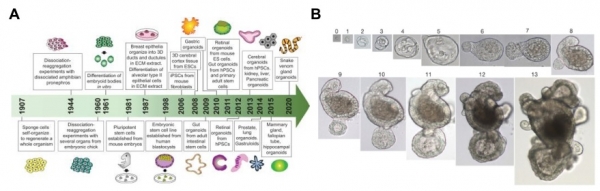
그림 3. 오가노이드 배양 기술의 역사 (A)와 장상피 줄기세포를 이용한 장오가노이드 (B) [4].
그림 4. 조직 내인성 폐 줄기세포 유래의 기도 오가노이드 (A)와 폐포 오가노이드 (B).
2.2 오가노이드를 이용한 다양한 활용 (그림 5)
2.2.1 조직의 발생에 관한 연구 (Development)
인간의 발생과 장기의 형성과정에 관한 연구는 인간 배아조직이나 태아 조직의 허용과 사용의 윤리적인 이슈로 매우 제한적이었지만 인간의 줄기세포 유래 오가노이드로 이를 가능케 하고 있다. 오가노이드는 줄기세포 배양을 통해 특정 장기가 만들어진다는 특징으로 인하여, 생체 내에서 일어나는 복잡한 과정인 발생 (development) 과정에서 줄기세포와 다양한 세포들 간의 상호작용 및 분자적 기전을 자세히 살펴볼 수 있는 기초 연구에 사용할 수 있는 장점을 지니고 있다. 예를 들어, 오가노이드 배양을 통하여 장의 상피에는 Lgr5 라는 유전자를 발현하는 상피세포가 장의 발생 및 조직의 손상 복구과정에서 매우 중요한 역할을 하는 줄기세포 (Intestinal stem cells, ISCs)이며 이는 옆에 존재하는 Paneth cell에서 발현하는 WNT ligand에 의존적임을 밝혀내었다 [1,8].
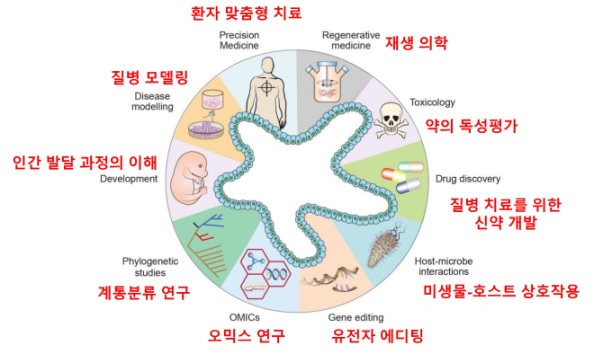
그림 5. 다양한 분야의 오가노이드 기술의 활용 [4].
2.2.2 질병 모델링 (Disease modeling)
오가노이드는 줄기세포 수준에서 유전자의 변형을 확인할 수 있고, 또는 특정 병원균 (Pathogen)을 오가노이드와 함께 공배양함으로써, 질병의 발병 (Pathogenesis)을 모사할 수 있는 특징을 가져, 생체 내에서 일어나는 복잡한 질병의 발병 과정을 직접 시험관에서 살펴볼 수 있는 질병 모델링에서 활용되고 있다. 특히, 이러한 오가노이드 기반 질병 모델링 연구는 유전적 변이에 의한 암을 포함한 유전적 질병과 host-pathogen의 상호작용에 의한 감염병에 관한 연구에 이르기까지 다양한 질병 모델링에 사용되고 있으며, 오가노이드가 병리학적인 특징을 잘 재현한다는 것이 여러 실험들을 통하여 증명되고 있다. 예를 들어, 헬리코박터 (Helicobacter pylori)균을 쥐에게 감염시켰을 때는 인간처럼 궤양이 생기거나 암으로 이어지지 않아 효과적인 모델로 사용할 수 없었다. 하지만, 사람의 줄기세포를 이용하여 위 (Stomach) 오가노이드를 형성한 후 헬리코박터 (Helicobacter pylori) 균을 microinjection을 통하여 감염시켰을 때, 효과적으로 위 오가노이드에 박테리아의 감염이 가능하며 이때 사람에게서 보이는 질병의 특징을 재현한다는 것이 증명되었다 [9,10]. 또한 뇌 오가노이드는 다양한 신경 발달 장애의 연구에 사용되고 있는데, CDK5RAP2 유전자의 돌연변이와 관련된 질병인 소두증은 마우스를 이용한 실험에서 재현하기 어려웠다. 하지만, 환자유래 (patient-derived)의 역분화줄기세포를 이용하여 만든 소뇌 (cerebral) 오가노이드의 경우, 질병의 특징을 재현한다는 것을 밝혀내었고, 이 과정에 관여하는 다양한 유전자들의 상호작용 및 그 기전을 밝혀 낼 수 있었다 [11-13]. 더 나아가서, 다운증후군, 알츠하이머, 파킨슨 병 등의 신경 장애들도 뇌 오가노이드로 연구되어 오고 있다. 암의 발생과 진행 과정을 이해하기 위하여 기존에는 마우스 동물 모델을 많이 활용하였다. 하지만, 동물 모델과 사람의 암은 특징적인 차이를 가지고 있음이 밝혀지고 있다. 2011년 대장암 환자에게서 유래한 오가노이드가 처음 확립된 이후, 다양한 조직에서 유래한 암 오가노이드 (Tumor Organoid) 구축이 급증하고 있다 [14]. 놀랍게도 이런 다양한 암 오가노이드 모델은 마우스 모델에서 부족했던 인간 종양의 유전형과 표현형을 보여주는 데에 아주 적합하다는 것이 밝혀지고 있다. 또한, 다양한 주변환경을 구성하고 있는 세포들과의 공배양 (co-culture)을 통하여 암세포와 주변의 미세 환경이 어떻게 상호작용하는지에 대한 연구가 활발히 진행되고 있다 [15,16]. 따라서, 이러한 오가노이드는 보다 많은 다양한 질병들과 더불어 난치성 질병의 원인 및 그 기전을 이해하는 데 있어서 중요한 도구로 활용될 수 있을 것이다.
2.2.3 환자 맞춤형 치료제 개발 (Personalized Medicine)
현재 인간 질병 치료를 위한 새로운 치료제 개발에서 가장 큰 한계는 환자 개개인의 다양한 반응성 및 약물의 독성에 관한 테스트가 불가능 하다는 점이다. 오가노이드가 인간의 병리학적인 측면을 보여주는 모델이라는 아이디어는 약물스크리닝 (drug screening)과정에서 매우 획기적으로 사용되고 있다. 그 예로 마우스 모델을 사용할 수 없었던 Zika 바이러스 감염을 치료하기 위해 대뇌피질 줄기세포 (cortical neural progenitor cells)에서 유래된 오가노이드를 활용하여 후보물질을 스크리닝 하였다 [17]. 또한 아주 드물게 발병하여 치료법을 몰랐던 CFTR (cystic fibrosis transmembrane conductance regulator)유전자의 돌연변이를 갖는 낭포성 섬유증치료를 위하여 환자 유래 줄기세포 유래의 장 오가노이드를 이용하였다. 장 오가노이드를 통하여 약물 스크리닝을 진행하였고, 기존에 개발된 다양한 종류의 약물 중 가장 효율이 높은 후보물질들이 도출되었다 [18]. 나아가 최근에는 다양한 병리학적 연구를 위한 오가노이드 바이오뱅크를 설립하는 데에도 여러 움직임이 있다 [19]. 이런 바이오뱅크는 전세계의 유전적 다양성을 스크리닝 할 수 있는 강력한 플랫폼이 될 수 있을 것이다. 덧붙여 오가노이드 기반 high-throughput screening (HTS)의 개발의 움직임도 활발하여 최근에는 인간 신장 오가노이드에서 자동화된 오가노이드의 생성과 약물 효과 평가가 이루어 지는 연구들도 진행중에 있다 [20].
2.2.4 재생의료 이식 치료제 개발 (Regenerative/transplantation therapy)
오가노이드는 재생의학에서 세포 치료를 위한 이식 가능한 조직으로 각광받고 있다. 장기 이식은 장기 부전 환자들을 치료할 수 있는 주요한 방법이지만 이식 거부 반응과 장기 기증 수의 부족이 가장 주된 문제점이다. 하지만, 개인에게서 유래한 무제한적으로 in vitro 상에서 배양 가능한 오가노이드를 이용한다면, 이식 거부가 없는 자가 이식 치료제(autologous transplantation therapy) 형태의 플랫폼으로 구축할 수 있을 것이다. 최근 연구에서는 역분화줄기세포 유래의 장 오가노이드가 마우스 실험을 통하여 이식된 후 정착하고 성숙되는 것을 확인했다 [21]. 또한 망막 오가노이드를 망막 변성의 마우스 모델에 이식한 경우, 이식된 오가노이드는 성숙한 photoreceptors와 경우에 따라서는 시냅스 연결을 형성하고 빛에 반응하며 시신경이 회복되는 것을 관찰하였다 [22].
재생 의약 분야에서 오가노이드의 활용은 in vitro 상의 유전자 correction을 통해 유전적 질병에 영향받는 조직의 autologous replacement를 가능하게 하는 방법 또한 시도되고 있다. 여기에는 높은 유전자 편집 효율성을 갖는 CRISPRCas9 매개 유전자 편집이 주로 이용된다. 최근 인간 CFTR mutation중 F508del이 CRISPR/Cas9 시스템을 활용하여 CFTR 기능이 수정되고 유전자의 기능이 회복되는 것을 입증함으로써, 낭포성 섬유증 환자에게 가능성 있는 유전자 치료방법을 제공할 수 있을 것이라고 기대되고 있다 [18]. 이런 CRISPR/Cas9 매게 homology dependent repair 시스템은 이중 가닥 절단을 일으킬 수 있다는 위험성을 갖고 있어서 좀 더 발전한 기술인 CRISPR-based adenine editing (ABE)가 개발되었다. 이 방법은 A-T 염기쌍을 G-C염기쌍으로 정확하게 변환하는 표적 염기 편집을 가능하게 하여 CFTR mutation에 의해 손상된 기능을 회복하는 것을 가능하게 하였다. 이러한 유전자 편집 기술은 점진적으로 환자 유래 오가노이드를 활용하여 유전적 돌연변이를 복구함으로써, 유전자 변형 관련 질병의 치료를 위한 임상 단계로 빠르게 추진할 수 있을 것이다.
3. 결론
오가노이드의 가장 큰 이점은 3R (Replacement, Reduction, and Refinement) 원칙에 따르는 동물실험을 줄일 수 있다는 점이다. 2023년 1월 미식품의약국(FDA)을 통해 신약 개발 과정에서 오가노이드가 동물실험을 대체할 수 있게 규제완화를 시작하였다. 따라서, 전 세계적으로 동물 모델을 활용한 임상 시험을 대신하여, 새로운 치료제의 효능 및 독성평가를 위하여 오가노이드가 대체할 가능성이 높아질 것이라고 생각된다. 또한, 최근 SARS-CoV-2 바이러스에 의한 COVID-19의 펜데믹은 치명적인 사망률을 보여주었고 COVID-19의 백신 및 치료제 개발은 시간을 다투는 일이었다. 마우스 모델의 경우 코로나 바이러스 감염이 이루어 지지 않아 실제 병리적 기전 및 치료제의 효과를 검증하는데 어려움이 있었다. 하지만, 놀랍게도 인간의 폐나 장에서 만들어진 오가노이드를 활용하여 코로나 바이러스의 침투 경로 및 병리적 기전, 그리고 특히 새로운 치료제의 효능에 관한 연구가 진행될 수 있었다 [23,24]. 이렇듯 오가노이드는 기초연구, 약물 개발 등의 연구에서 다방면으로 활용되고 있고, 앞으로도 오가노이드의 역할이 주목받을 것이라고 확신한다.
참고문헌
1. Sato, T. and H. Clevers (2013) Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science 340: 1190-1194.
2. Huch, M. and B.-K. Koo (2015) Modeling mouse and human development using organoid cultures. Development 142: 3113-3125.
3. Rookmaaker, M. B., F. Schutgens, M. C. Verhaar, and H. Clevers (2015) Development and application of human adult stem or progenitor cell organoids. Nat. Rev. Nephrol. 11: 546-554.
4. Corro, C., L. Novellasdemunt, and V. S. W. Li (2020) A brief history of organoids. Am. J. Physiol. Cell. Physiol. 319: C151-C165.
5. Sato, T., J. H. van Es, H. J. Snippert, D. E. Stange, R. G. Vries, M. van den Born, N. Barker, N. F. Shroyer, M. van de Wetering, and H. Clevers (2011) Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature 469: 415-418.
6. Orkin, R. W., P. Gehron, E. B. McGoodwin, G. R. Martin, T. Valentine, and R. Swarm (1977) A murine tumor producing a matrix of basement membrane. J. Exp. Med.. 145: 204-220.
7. Choi, J., E. Iich, and J. H. Lee (2016) Organogenesis of adult lung in a dish: Differentiation, disease and therapy. Dev. Biol. 420: 278-286.
8. Farin, H. F., I. Jordens, M. H. Mosa, O. Basak, J. Korving, D. V. F. Tauriello, K. de Punder, S. Angers, P. J. Peters, M. M. Maurice, and H. Clevers (2016) Visualization of a short-range Wnt gradient in the intestinal stem-cell niche. Nature 530: 340-343.
9. McCracken, K. W., E. M. Catá, C. M. Crawford, K. L. Sinagoga, M. Schumacher, B. E. Rockich, Y.-H. Tsai, C. N. Mayhew, J. R. Spence, Y. Zavros, and J. M. Wells (2014) Modelling human development and disease in pluripotent stem-cellderived gastric organoids. Nature 516: 400-404.
10. Bartfeld, S., T. Bayram, M. van de Wetering, M. Huch, H. Begthel, P. Kujala, R. Vries, P. J. Peters, and H. Clevers (2015) In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148: 126-136.e6.
11. Lancaster, M. A., M. Renner, C.-A. Martin, D. Wenzel, L. S. Bicknell, M. E. Hurles, T. Homfray, J. M. Penninger, A. P. Jackson, and J. A. Knoblich (2013) Cerebral organoids model human brain development and microcephaly. Nature 501: 373-379.
12. Miura, Y., M.-Y. Li, F. Birey, K. Ikeda, O. Revah, M. V. Thete, J.-Y. Park, A. Puno, S. H. Lee, M. H. Porteus, and S. P. Pașca (2020) Generation of human striatal organoids and cortico-striatal assembloids from human pluripotent stem cells. Nat. Biotechnol. 38: 1421-1430.
13. Khan, T. A., O. Revah, A. Gordon, S.-J. Yoon, A. K. Krawisz, C. Goold, Y. Sun, C. H. Kim, Y. Tian, M.-Y. Li, J. M. Schaepe, K. Ikeda, N. D. Amin, N. Sakai, M. Yazawa, L. Kushan, S. Nishino, M. H. Porteus, J. L. Rapoport, J. A. Bernstein, R. O’Hara, C. E. Bearden, J. F. Hallmayer, J. R. Huguenard, D. H. Geschwind, R. E. Dolmetsch, and S. P. Paşca (2020) Neuronal defects in a human cellular model of 22q11.2 deletion syndrome. Nat. Med. 26: 1888-1898.
14. Sato, T., D. E. Stange, M. Ferrante, R. G. J. Vries, J. H. Van Es, S. Van den Brink, W. J. Van Houdt, A. Pronk, J. Van Gorp, P. D. Siersema, and H. Clevers (2011) Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology 141: 1762-1772.
15. Cattaneo, C. M., K. K. Dijkstra, L. F. Fanchi, S. Kelderman, S. Kaing, N. van Rooij, S. van den Brink, T. N. Schumacher, and E. E. Voest (2020) Tumor organoid-T-cell coculture systems. Nat. Protoc. 15: 15-39.
16. Yuki, K., N. Cheng, M. Nakano, and C. J. Kuo (2020) Organoid Models of Tumor Immunology. Trends Immunol. 41: 652-664.
17. Zhou, T., L. Tan, G. Y. Cederquist, Y. Fan, B. J. Hartley, S. Mukherjee, M. Tomishima, K. J. Brennand, Q. Zhang, R. E. Schwartz, T. Evans, L. Studer, and S. Chen (2017) High-content screening in hPSC-neural progenitors identifies drug candidates that inhibit Zika Virus Infection in fetal-like organoids and adultbrain. Cell Stem Cell 21: 274-283.e5.
18. Schwank, G., B.-K. Koo, V. Sasselli, J. F. Dekkers, I. Heo, T. Demircan, N. Sasaki, S. Boymans, E. Cuppen, C. K. van der Ent, E. E. S. Nieuwenhuis, J. M. Beekman, and H. Clevers (2013) Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13: 653-658.
19. van de Wetering, M., H. E. Francies, J. M. Francis, G. Bounova, F. Iorio, A. Pronk, W. van Houdt, J. van Gorp, A. Taylor-Weiner, L. Kester, A. McLaren-Douglas, J. Blokker, S. Jaksani, S. Bartfeld, R. Volckman, P. van Sluis, V. S. W. Li, S. Seepo, C. S. Pedamallu, K. Cibulskis, S. L. Carter, A. McKenna, M. S. Lawrence, L. Lichtenstein, C. Stewart, J. Koster, R.
Versteeg, A. van Oudenaarden, J. Saez-Rodriguez, R. G. J. Vries, G. Getz, L. Wessels, M. R. Stratton, U. McDermott, M. Meyerson, M. J. Garnett, and H. Clevers (2015) Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell 161: 933-945.
20. Czerniecki, S. M., N. M. Cruz, J. L. Harder, R. Menon, J. Annis, E. A. Otto, R. E. Gulieva, L. V. Islas, Y. K. Kim, L. M. Tran, T. J. Martins, J. W. Pippin, H. Fu, M. Kretzler, S. J. Shankland, J. Himmelfarb, R. T. Moon, N. Paragas, and B. S. Freedman (2018) High-throughput screening enhances kidney organoid differentiation from human pluripotent stem cells and enables automated multidimensional phenotyping. Cell Stem Cell 22: 929-940.e4.
21. Watson, C. L., M. M. Mahe, J. Múnera, J. C. Howell, N. Sundaram, H. M. Poling, J. I. Schweitzer, J. E. Vallance, C. N. Mayhew, Y. Sun, G. Grabowski, S. R. Finkbeiner, J. R. Spence, N. F. Shroyer, J. M. Wells, and M. A. Helmrath (2014) An in vivo model of human small intestine using pluripotent stem cells. Nat. Med. 20: 1310-1314.
22. McLelland, B. T., B. Lin, A. Mathur, R. B. Aramant, B. B. Thomas, G. Nistor, H. S. Keirstead, and M. J. Seiler (2018) Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Invest. Ophthalmol. Vis. Sci. 59: 2586-2603.
23. Monteil, V., H. Kwon, P. Prado, A. Hagelkrüys, R. A. Wimmer, M. Stahl, A. Leopoldi, E. Garreta, C. H. Del Pozo, F. Prosper, J. P. Romero, G. Wirnsberger, H. Zhang, A. S. Slutsky, R. Conder, N. Montserrat, A. Mirazimi, and J. M. Penninger (2020) Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human
ACE2. Cell 181: 905-913.e7.
24. Lamers, M. M., J. Beumer, J. van der Vaart, K. Knoops, J. Puschhof, T. I. Breugem, R. B. G. Ravelli, J. P. van Schayck, A. Z. Mykytyn, H. Q. Duimel, E. van Donselaar, S. Riesebosch, H. J. H. Kuijpers, D. Schipper, W. J. van de Wetering, M. de Graaf, M. Koopmans, E. Cuppen, P. J. Peters, B. L. Haagmans, and H. Clevers (2020) SARS-CoV-2 productively infects human gut enterocytes. Science 369: 50-54.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
