| ELISA 및 Quenchbody를 이용한 면역측정법 | |
|---|---|
| Date 2020-07-30 19:00:29 |
|

석사과정 / 교수
홍익대학교 바이오화학공학과
ysksun7@naver.com / heejinjeong@hongik.ac.kr
1. 항체 및 재조합 항체 단편
항체는 생물체 내부에 침투한 세균, 바이러스 등의 외부 물질 (항원)에 대항하기 위해 생산되는 당단백질로, 항원이 체내로 침투하면 체내에서는 이를 감지하여 림프구의 B세포를 통해 항체를 생산하여 면역 기능을 수행한다.
항체 (IgG)는 기본적으로 Y자 형태의 대칭적 입체구조를 가지며, 항원과 결합하는 부위인 variable domain (가변 부위)과 항체 구조 및 안정성 유지 등의 기능을 갖는 constant domain (불변 부위)으로 나뉜다. 가변 부위는 항원에 따라 아미노산 배열이 변형되어 상이하기 때문에 항원 특이적 결합을 가능하게 한다. 그리고 불변 부위의 아미노산 배열은 동물의 종에 따라 다르며 같은 종의 경우 유사한 배열을 갖는다.
일반적으로 사람, 마우스, 토끼, 염소 등을 포함한 대부분의 동물에 존재하는 항체는 내측의 가변 부위와 3개의 도메인으로 연결된 불변 부위로 이루어진 Heavy chain과 외측의 가변 부위와 외측의 불변 부위로 이루어진 Light chain으로 구성된다. 즉, 가변영역은 VH와 VL로 구성되며 불변 부위는 CH1, CH2, CH3와 CL로 구성된다. 특이하게 알파카와 상어의 경우에는 Heavy chain으로만 이루어진 항체를 생성하는데, 그중 항원이 결합하는 부위인 가변 부위를 VHH라 하고, 불변 부위를 CH2와 CH3라 명명하여 VHH와 CH2, CH3가 연결된 대칭 구조를 나타낸다 (그림 1). 가변영역 중에서도 특히 아미노산 배열이 크게 변하는 부분을 Complementarity determining region (CDR) 이라 하며 VH와 VL에 각각 3개씩 존재하며 그 상이한 아미노산 배열에서부터 기인하는 108 이상의 다양성에 의해 항체는 항원을 특이적으로 인식하고 결합한다.
사람 및 동물에서 생성되는 항체를 의, 약, 공학 등의 측면에서 연구 및 실용적으로 사용하기 위해서는 대량으로 확보하는 것이 필요하다. 이때 사람 및 동물의 체내에 존재하는 항체 (자연 항체)를 대량으로 추출하여 사용하는 것에는 한계가 있기 때문에 자연 항체를 소량 추출하여 이를 증폭한 후 염기 배열을 분석하여 동물 세포 및 대장균 등을 이용하여 배양한 후 정제하는 재조합 항체 작성법이 개발 사용되고 있다. 예를 들어 A라는 항원에 결합하는 항체가 대량으로 필요할 경우, A를 마우스와 같은 면역동물의 복강에 주기적으로 주사한 다음에 항체를 생성하는 역할을 하는 B세포를 채취한다. 그리고 강한 증식력을 갖는 암세포와 융합하여 하이브리도마 세포를 생성하고 배양한다. 배양한 하이브리도마 세포로부터 RNA를 추출한 다음 역전사 PCR을 통하여 RNA로부터 cDNA를 얻고, 염기 배열 정보를 확보한다. 염기 배열을 동물 세포 또는 대장균 발현용으로 코돈 최적화한 후에 동물 세포 또는 대장균 발현 벡터에 삽입하는 유전자 클로닝 과정을 거쳐 최종적으로 A항원을 인식하는 항체 배열이 삽입된 plasmid DNA가 구축된다. 이를 동물 세포 또는 대장균에 삽입하여 발현시킨 후 정제함으로써 항체를 얻을 수 있고 이러한 항체를 재조합 항체라 칭한다. 하이브리도마 세포를 이용하는 방법 이외에도 phage display 법을 사용하여 자연 항체 중에서 강한 항원 결합력을 가지는 항체를 선별하여 확보할 수도 있다.
1990년대 후반부터 시작된 가변 부위만을 이용한 항체 제작을 시작으로 현재는 다양한 종류의 항체 단편이 제작되고 있다. 이는 가변 부위만으로 구성되는 항체 단편 (single chain scFv, scFv 또는 VHH)을 작성하여도 항원 결합력에 차이가 없으며, 작은 크기의 항체 단편을 생산하는 것이 전체항체 (Full-sized antibody)보다 생산효율 면에서 유리하기 때문이다. 그리고 작은 크기의 항체 단편의 경우에 고도로 밀집된 세포 사이를 침투하기 용이하다는 점도 밝혀진 바 있다. 반면에 체내에서의 항체의 안정성은 불변영역이 존재할 경우 scFv/VHH에 비해 증가하는 것을 고려하여 scFv/VHH 보다는 Fab (VH-CH, VL-CL이 이황결합으로 연결된 항체 단편) 또는 full-sized antibody가 필요로 될 경우가 있다 (그림 1).
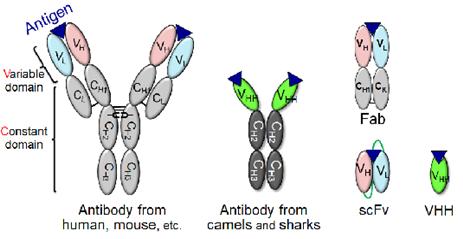
그림 1. 항체 및 항체 단편의 구조 및 명명법
2. 면역측정법
항체와 항원의 특이적 결합을 이용하는 면역측정은, 생체물질 및 비 생체물질에 상관없이 혼합물 중에 미량으로 존재하는 물질을 고감도이며 고선택적으로 검출, 정량할 수 있기 때문에 생물학의 기반연구에서부터 질병의 진단, 치료 등의 분야에서 폭넓게 이용되고 있으며 그 중요성은 점점 증가하고 있다. 면역측정법은, 항체-항원 복합체의 응집반응을 이용하는 응집면역측정법과 표지물질을 항원 또는 항체에 결합시킨 복합체를 이용하는 표지 면역측정법으로 분리할 수 있다. 표지 면역측정법은 항체-항원 반응에 영향을 미치지 않고 면역복합체의 생성량이 미량이어도 정확히 측정 가능하며, 그러한 방법의 예로 방사능 동위원소를 표지하는 방사선 면역측정법 (radio immunoassay, RIA), 형광발광물질을 표지에 이용하는 형광 면역측정법 (fluoro immunoassay, FIA), peroxidase와 같은 효소를 표지에 이용하는 효소 면역측정법 (Enzyme immunoassay, EIA)을 들 수 있다. 이 중에서도 EIA 법의 일종인 고정화효소 면역측정법 (Enzyme-linked immunosorbent assay, ELISA)이 가장 널리 사용되고 있다.
2.1. ELISA
ELISA의 특징은 방사성물질을 사용하지 않기 때문에 안전성이 높으며, 방사성물질 취급법에 의한 사용상의 제약이 없다는 점, 항원항체반응을 이용하기 때문에 높은 특이성을 갖는다는 점, 효소 반응을 바탕으로 한 발색 및 형광을 시그널에 이용하기 때문에 감도 및 정량성이 높다는 점을 들 수 있다. ELISA 법은 반응 사양에 따라 크게 직접법, 간접법, 경쟁법, 샌드위치법, 오픈샌드위치법으로 분류된다.
2.1.1. 직접 ELISA (Direct ELISA)
직접법은 HRP와 같은 효소가 결합되어 있는 항체를 항원과 반응하는 항체로 사용한다. 단백질과 같은 고분자 항원 또는 저분자 항원일 경우에는 BSA 또는 MBP 와 같은 고분자 단백질에 결합시켜 플레이트에 고정하고 블로킹한다. 그 다음 효소가 표지된 항원과 결합하는 항체를 넣고 반응시킨다. 이후 불순물 및 플레이트에 결합하지 않고 남은 항체를 세척하여 제거한다. 끝으로 기질을 첨가하였을 때 효소 반응에 의해 기질이 변화하는 생성물의 흡광도를 측정함으로써 항원의 양 및 항원-항체 결합성을 측정할 수 있다 (그림 2).
직접법은 가장 간단하게 이용할 수 있는 분석 방법으로 최소한의 과정으로 실험 진행이 가능해 시간이 매우 적게 걸린다. 하지만 특정 항원에 결합하는 효소표지항체가 시판되어 있지 않은 경우, 직접 항체를 효소로 표지하는 작업이 수반되어야 하므로 범용성이 부족하다. 그리고 다른 분석법에 비해 민감도와 특이도가 떨어진다는 단점을 갖고 있다.
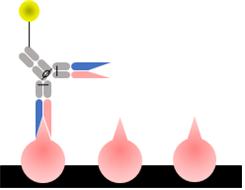
그림 2. Direct ELISA
2.1.2. 간접 ELISA (Indirect ELISA)
간접법은 항원과 결합하는 1차 항체와, 1차 항체와 결합하는 표지된 2차 항체를 사용하는 분석법이다. 구체적으로는 항원을 플레이트에 고정하고 블로킹한다. 그다음 1차 항체를 넣고 반응 시켜 항원과 결합시킨다. 이후 결합되지 않은 항체를 세척하여 제거한다. 마지막으로 효소가 결합된 2차 항체를 첨가해 1차 항체에 붙인 후 비결합 및 비특이적 결합을 세척한다. 이로써 기질 첨가 후의 효소에 의한 생성물의 흡광도를 측정할 수 있게 된다 (그림 3).
간접법은 1차 항체와 결합하는 2차 항체를 사용해 신호를 증폭시켜 미량의 시료도 감지할 수 있으며, 2차 항체에 사용되는 항체는 anti-IgG4 antibody 등과 같이 타깃에 범용성을 갖기 때문에 시판 중인 HRP표지 2차 항체를 입수하기 용이하다. 하지만 2단계로 항체를 사용함으로써 교차반응의 발생위험도가 증가하게 된다. 이러한 교차반응으로 인해 높은 background를 갖게 되어 전체적인 신호 강도 (signal to background ratio)가 감소할 수 있다. 그리고 추가적인 단계의 증가로 인해 실험 수행 시간이 증가한다는 단점을 갖고 있다.
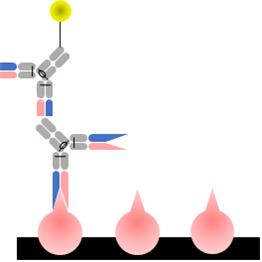
그림 3. Indirect ELISA
2.1.3. 경쟁 ELISA (Competitive ELISA)
경쟁 ELISA는 직접경쟁법과 간접경쟁법으로 구분할 수 있다. 직접경쟁법의 작동과정은 다음과 같다. 항체를 플레이트에 고정하고 블로킹한 후 효소를 표지해둔 항원 (표지 항원)과 표지하지 않은 항원 (경쟁 항원)을 첨가한다. 그다음 반응하지 않은 항원과 항체를 세척하여 제거한 다음 효소 활성을 측정함으로써 표지 항원의 양을 알 수 있다. 표지 항원의 양을 알고 있기 때문에 그중에서 항체와 결합한 비율을 구할 수 있어 경쟁 항원 (검체 중의 항원)의 양을 계산할 수 있다. 또한 항원을 플레이트에 고정화하고 일정 양의 항체에 대한 효소표지항원의 결합 비율로부터 검체 중의 항원의 양을 측정하는 간접경쟁법도 사용된다 (그림 4).
경쟁법은 저분의 측정이 가능하고, 반응과정 수가 적기 때문에 단시간에 측정이 가능하다. 하지만 항체 및 경쟁 항원의 양을 정확히 조절하여 경쟁을 일으키기 위한 조건검토가 필수적이며 표지 항원을 합성해야만 하는 단점을 갖는다.
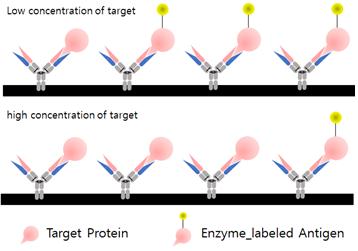
그림 4. Competitive ELISA
2.1.4. 샌드위치 ELISA (Sandwich ELISA)
샌드위치법은 한 개의 항원에 존재하는 상이한 epitope를 인식하는 두 종류의 항체를 사용하는 특징을 가지며 다음과 같은 과정으로 행해진다. 1차 항체가 되는 항체를 플레이트에 고정하고 블로킹 한 후 항원을 첨가하고 일정 시간 반응시켜 1차 항체와 항원을 결합시킨다. 그다음 항체에 결합한 불순물 및 플레이트에 비특이적으로 결합한 항원을 세척하여 제거한다. 그 후 효소 또는 형광 색소를 표지해 둔 항체 (2차 항체)를 첨가하고 일정 시간 반응시킴으로써 1차 항체에 의해 포획되어있는 항원에 2차 항체가 결합되도록 한다. 반응 후에 여분의 2차 항체를 세척하여 제거하고 2차 항체의 효소 활성 및 형광을 측정함으로써 검체 중의 항원 양을 알 수 있다 (그림 5).
샌드위치법은 미량물질의 고감도 검출이 가능하다는 점, 측정 가능한 범위가 넓다는 점, background signal이 낮다는 점 등의 장점이 있는 반면에 동일 단백질 항원을 상이한 epitope로 인식하는 두 종류의 항체를 사용해야 하므로 저분자 항원 검출에는 응용되기 어렵다는 한계점을 갖는다. 즉 hapten과 같은 저분자 항원은 보통 한 개의 epitope밖에 갖고 있지 않은 단가항원이기 때문에 두 종류의 항체로 샌드위치 assay를 하는 것은 불가능하다. 또한 실험 과정이 많기 때문에 이틀 정도의 시간이 소요되며 번거롭다는 단점이 있다.
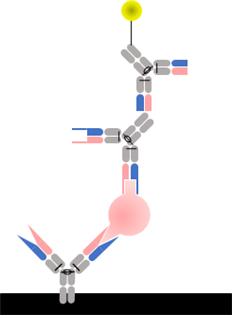
그림 5. Sandwich ELISA
2.1.5. 오픈샌드위치 ELISA (Open-sandwich ELISA)
앞서 기술한 바와 같이 일반적인 샌드위치법은 항원의 상이한 epitope를 인지하는 두 종류의 항체를 필요로 하므로 항원이 저분자화합물 및 펩티드와 같은 저분자일 경우 상이한 epitope를 인지하는 항체를 작성하는 것이 어렵다. 이러한 한계점을 극복할 수 있는 방법으로 한 종류의 항체의 VH와 VL을 이용하여 비경쟁적 면역측정법으로 항원을 검출하는 ELISA법을 오픈샌드위치 ELISA법이라 한다. 이 방법은 항체의 가변영역은 항원이 존재하지 않을 때는 불안정하지만 항원이 결합하면 안정화되는 원리를 이용한 것으로, 항원을 특이적으로 인식하는 항체의 VH단편 및 VL단편을 각각 작성한 다음 한쪽 단편은 표지하고 다른 한쪽 단편은 표지하지 않고 플레이트에 고정한다. 그 후 항원을 표지한 단편과 같이 고정한 단편에 접촉시켜 고정화 단편에 결합한 표지화 단편의 양을 측정한다(그림 6).
오픈샌드위치 방법은 샌드위치방법에 비해 과정이 복잡하지 않으며 단시간에 측정이 가능하다. 샌드위치 법에서는 2회 필요한 항원항체 반응이, 오픈샌드위치 방법에서는 VH-항원-VL 3자간의 복합체가 안정하기 때문에 한 번의 반응으로 충분하기 때문이다. 하지만 오픈샌드위치 법을 적용하기 위해서는 항원의 유무에 따라 VH-VL 사이의 상호작용이 현저히 변화하는 항체가 필요로 된다. 즉, 항원이 존재하지 않을 때는 VH-VL 간 상호작용이 적고, 항원이 존재할 경우에만 VH-항원-VL의 안정한 복합체를 형성하는 항체를 사용할 때 적합한 방법이다.
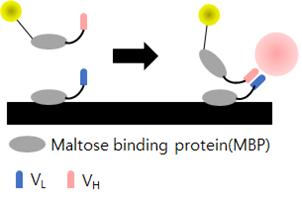
그림 6. Open-sandwich ELISA
2.2. Homogeneous 면역측정법
지금까지의 면역측정법의 대부분은 항체 또는 항원을 플레이트에 고정하는 과정과 비특이적인 흡착을 제거하기 위한 세척 과정이 필요하다. 하지만 이러한 과정은 작업이 복잡하고 시간이 소요되며 측정결과에 편차를 나타낼 수 있기 때문에 고상화 과정 및 세척 과정을 필요로 하지 않는 액상계에서의 homogeneous 측정법의 필요성이 대두되었다.
이러한 배경을 바탕으로, 2012년에 동경대학교 우에다 그룹에서는 상기한 오픈샌드위치 ELISA법을 보다 간편한 homogeneous 측정법으로 발전시킬 수 있는 가능성이 검토되었다. 구체적으로는 정제한 VH단편에 fluorescein 계 색소인 TAMRA를 부착하고, VL단편에는 rhodamine 계 색소인 R110을 부착하여 형광공명에너지이동 (Forster resonance energy transfer, FRET) 현상을 이용하여 VH-VL간 상호작용을 검출하고자 하였다. 결과적으로 FRET 현상이 일어나 항원 존재 하에 용액 중의 형광이 변화하여 항원 농도를 정량 할 수 있었다. 또한 각 항체단편을 형광표지 하기 위해 형광색소 이외에도 Green fluorescent protein (GFP) 유도체를 융합시킨 형광항체단편 (VH-eBFP, VL-eGFP)을 구축하여 재현성 있게 항원 정량에 사용될 수 있음이 밝혀졌다. 이러한 원리를 이용하면 세척과정 없이 항원과 항체 단편을 혼합하는 것만으로 수분 이내에 항원농도를 정량하는 것이 가능하며, 세척과정 없이 세포 내의 항원을 검출함에 사용될 수 있음이 예상되었다.
이러한 결과를 바탕으로 FRET을 이용한 homogeneous 측정법을 개발하는 본래의 실험 목적을 달성하였다고 여겨졌다. 그런데 이때 발생한 예상 밖의 현상에 착목하게 되었는데, TAMRA 표지 VH와 R110 표지 VL를 동일한 몰수로 혼합하였음에도 불구하고 R110 형광의 감소분보다 TAMRA 형광의 증가분이 많다는 점이었다. 이를 확실히 하고자, 대조실험으로 VH만을 TAMRA로 표지하고 VL은 표지하지 않은 후 이들을 동일 몰수로 항원과 혼합한 결과, 항원 농도의존적으로 형광강도가 증가함을 알 수 있었다. 형광강도 변화가 항원 의존성을 나타내기 때문에 이 원리를 이용함으로써 항원 정량이 가능하며, 두 가지 형광색소를 이용해야 할 뿐만 아니라 두 색소사이의 거리를 정밀하게 조절하여야 하는 기존의 FRET 방법과는 달리 본 원리를 이용하면 한 가지 색소만 사용하여도 형광 응답을 얻을 수 있기 때문에 그 사용 가능성을 비약적으로 높일 수 있음이 생각되었다. 이후 본 형광색소표지항체단편을 Quenchbody (Q-body)로 명명하고 작용 메커니즘 및 응용범위의 범용화 등을 포함하여 보다 상세한 검토를 행하였다.
3. 항원이 존재할 때만 빛을 발하는 항체 “Quenchbody”
Q-body를 이용한 면역측정법은, N말단 근방에 부위특이적으로 형광색소를 부착한 항체단편에 대하여, 항원이 존재하지 않을 경우에는 항체내부에 존재하는 tryptophan (Trp) 잔기에 의해 항체 내부에 위치하여 trap되어 있는 색소의 형광이 소광 (quenching)되어 있지만, 항원결합에 의해 공간적으로 색소가 이동하여 소광이 해소되는 지금까지의 형광항체 작성원리에는 존재하지 않았던 새로운 개념을 바탕으로 한 면역측정법이다 (그림 7). 형광색소의 형광강도변화는 항원농도 의존적으로 변화하기 때문에 형광강도를 측정하는 것으로 검체 중의 항원 양을 알 수 있다. 이는 기존의 항체를 이용한 방법과 달리 항원 측정에 있어서 매우 유용한 방법으로 사용될 수 있다. 특히 기존의 분석 방법에 해당하는 ELISA의 경우 항원의 특성에 따라 방식을 나누어야 하는 점 (직접, 간접, 경쟁, 샌드위치, 오픈샌드위치와 같이 상이한 실험방법)과 준비 기간이 상당히 오래 걸린다는 점에서 빠른 분석에 있어서 큰 단점을 갖는다. 하지만 Q-body는 기존의 방식과 다르게 항원과의 1차 반응을 통해서 항원이 존재하면 빛을 발하게 되므로 수분 내에 결과를 확인할 수 있게 된다.
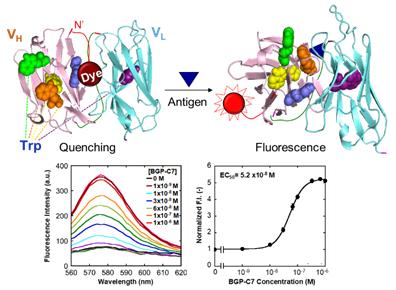
그림 7. Quenchbody의 작동원리 및 anti-BGP Quenchbody를 이용한 항원 (BGP-C7) 검량곡선
3.1. Trp에 의한 형광 quenching
형광은 특정 분자가 전자기파를 흡수해서 빛을 내는 현상을 말하는 것으로 실제 사용되는 일반적인 형광으로는 자외선 빛을 흡수해 가시광선의 빛을 발하는 형태가 있다. 형광은 짧은 파장의 에너지를 흡수해 그보다 긴 파장의 에너지를 빛의 형태로 방출하는 것이다. 짧은 파장의 높은 에너지를 흡수한 전자는 들뜬상태 (Excited state)가 되는데 이는 불안정한 상태이기 때문에 에너지를 방출하면서 다시 원상태로 돌아가게 된다. 이때 방출하는 에너지의 형태가 빛일 경우 형광물질이 되는 것이다.
Quenching 현상은 빛을 발하는 형광물질의 근처에 다른 분자가 존재하게 되면 빛의 강도가 감소하거나 없어지게 되는 현상이다. 형광을 발생시키려면 안정된 전자가 에너지를 받아 들뜬상태에 위치하다가 다시 에너지를 안정된 바닥상태로 떨어뜨려야 한다. 하지만 근처에 있는 분자 (Trp과 같은 방향족 물질)가 이를 방해해 빛의 발산을 막을 수 있게 되는 것이다 (그림 8).
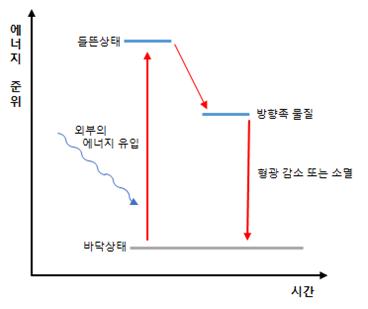
그림 8. Quenching mechanism
Q-body는 이러한 quenching 현상을 이용하여 센서의 역할을 하게 되는데 이것을 가능하게 만들어주는 것이 바로 항체 내부에 분포하는 Trp이다. Trp은 아미노산 중 하나로 대부분의 항체 단편의 항원결합 부위 근처에 분포되어 있으며 이와 상호작용이 가능한 형광 물질의 빛이 소거된다. 이후 항원이 반응계 안에 존재하게 되면 항체-항원과의 결합에 의해 항원결합 부위 근처에 존재하였던 형광 물질이 밖으로 밀려나게 되어 소광 현상이 해소되면서 다시 형광 빛을 발하게 되는 것이다.
지금까지 특정 형광 색소가 고농도의 Trp 잔기 및 구아니딘 존재 하에 소광되는 현상 자체는 보고되어 있었고, 이것은 Trp 잔기 및 구아니딘에서부터 Rhodamine 및 ATTO655와 같은 색소에 Photo-induced electron transfer (PeT) 가 일어나기 때문이라고 알려져 있었다. 이를 바탕으로 Q-body에서도 Trp 잔기에 의해 그와 같은 현상이 일어나는가를 실험적으로 확인하기 위하여, 필자의 연구그룹에서는 골다공증 등의 바이오마커인 BGP를 인식하는 항체 단편 scFv의 내부의 Trp 잔기 5개 (VH의 33, 36, 46, 106번째, VL의 40번째 아미노산)를 각각 구조가 유사한 페닐알라닌으로 치환하여 각각의 BGP 농도 의존적인 형광강도 변화를 비교하였다. 그 결과, 치환하지 않은 야생형에 비해 W47F> W40F> W106F> W33F> W36F의 순서로 항원첨가 시의 형광강도 증가가 적어졌으며, W36F의 경우에도 야생형에 비해 0.7배의 형광강도 감소, W47F에서는 0.4배까지 형광강도가 감소하였다. 이 결과로부터 어떠한 Trp잔기여도 형광소광에 관여하고 있는 것을 알 수 있었고, 이들이 상충적으로 작용하여 항원이 존재하지 않을 때의 색소가 소광된다고 생각 할 수 있었다.
또한 만약 Q-body 내부의 Trp 잔기에 의한 소광이 중요하다면 다른 항체에서도 유사한 현상이 일어날 것으로 생각하였다. 실제로 항체 배열 데이터베이스인 abYsis (www.bioinf.org.uk/abysis)를 사용하여 항체 가변영역 내부의 Trp 잔기의 보존성을 조사한 결과, 항 BGP scFv 의 다섯 개의 Trp 잔기 중에 4개는 다른 항체에서도 94% 이상 보존되어 있으며, Q-body 법은 폭넓은 항체에 적용 가능함이 시사되었다. 여기에서 항 BGP 항체 이외의 항체 유전자를 이용하여 검토한 결과, 여성호르몬인 에스타디올과 같은 저분자에서부터 혈청알부민과 같은 고분자 단백질까지 각종 항원을 인식하는 항체가 항원 의존적으로 형광강도증가 현상을 나타내었다.
3.2. 항원결합에 의한 quenching 해소
항원결합에 의해 소광이 해소되는 이유의 한 가지 힌트가 된 실험결과는, Q-body 계에 항원이 아닌 변성제 (7 M 구아니딘염산 과 100 mM DTT)를 첨가하였을 때, 항원을 첨가한 경우와 거의 비슷하게 형광강도가 증가한 것이다. 즉, 변성제를 첨가함으로써 단백질의 고차구조가 파괴되어 색소와 Trp 잔기와의 공간적 거리가 증가하여 소광이 해소되었다고 여겨진다. 항원을 첨가하는 것에 의해 scFv의 VH와 VL이 공간적으로 이동하여 변성제를 첨가하였을 때와 동일한 현상이 일어났을 가능성이 있다.
또 하나의 실험결과는, TAMRA를 표지 한 Q-body, 항 TAMRA 항체, 그리고 scFv의 C 말단에 부가한 His 태그를 인식하는 항체를 이용한 샌드위치 ELISA에서, 비 변성상태에서 Q-body의 외부에 노출되어있는 표지색소 (TAMRA)의 양을 측정한 결과, 공존하는 항원의 유무에 의해 빛의 강도가 약 3배 변화한 것이었다. 즉, 항원이 존재하지 않을 때의 scFv의 구조는 (오픈샌드위치 면역측정이 성립하는 것에서 생각하더라도) 매우 불안정하지만, 거기에 항원이 추가되면 소수성이 높아져 색소가 상호 작용하기 쉬워지고 VH/VL 계면이 용매로부터 해리되어 색소가 외부로 나가 결과적으로 형광을 발하게 된다고 생각된다.
3.3. Q-body법의 이점과 과제
기존의 면역측정법과 비교한 Q-body 법의 이점은 1) 세척과정이 필요 없으며, 소량의 샘플과 혼합한 후 형광강도를 측정하는 것으로 측정이 완료한다는 매우 간편한 측정기술이라는 점 2) 항체 중에 존재하는 보존성이 높은 Trp 잔기의 소광을 이용하기 때문에 항체의 종류를 바꾸어도 소광효과가 얻어져 다양한 항체를 이용하여 많은 종류의 물질 검출에 폭넓게 적용 가능한 범용성을 갖추고 있다는 점 3) 항원 부위가 한곳밖에 없어도 되기 때문에 저분자화합물에 대해서도 적용 가능한 점을 들 수 있다.
다만 현 단계에서는 항체에 의해 그 응답성이 다소 낮은 경우도 있기 때문에, 다양한 항원에 대한 Q-body의 응답성을 향상시켜 그 범용성을 더욱 넓힐 필요가 있다. 또한 quenching의 원인으로 여겨지는 Trp 잔기와 색소와의 상호작용 등 보다 확실한 Q-body의 원리를 확립하는 것이 앞으로 해결해 나가야 할 과제가 될 것이다.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
